Содержание
- 2. ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ФЕРМЕНТОВ В клинической лабораторной практике речь всегда идет не о количестве фермента, а об
- 3. 2. Абсолютное количество ничего не говорит о его активности. Абсолютное количество фермента может быть большое, а
- 4. Для определения активности фермента используют 2 основных подхода: 1. Убыль субстрата. 2. Прирост продукта.
- 5. ПОНЯТИЕ СТАНДАРТНЫХ УСЛОВИЙ Для того чтобы сравнивать данные об активности ферментов разных определений необходимо проводить их
- 6. 1. Оптимальное для определяемого фермента значение рН; 2. Концентрация субстрата выше насыщающей; 3. Для сложных ферментов
- 7. 4. Время инкубирования смеси строго лимитируется; 5. Стандартная температура принята за 25С°. Другая температура измерения специально
- 8. ЕДИНИЦЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ Поскольку в большинстве случаев измерить количество фермента в абсолютных единицах невозможно, на практике
- 9. Международная единица фермента (Е) – это такое его количество, которое катализирует превращение 1 мкмоль вещества за
- 10. Определяется по формуле: Число единиц фермента (Е) в образце Масса белка в мг в этом образце
- 11. Принципы и последовательность действий при выделении ферментов Ткань Размельчение Экстракция в мягких условиях (например 0,25м р-р
- 12. ИЗОФЕРМЕНТЫ Обнаружены в 1959 году методом гель-электрофореза. Это ферменты которые катализируют одну и ту же реакцию,
- 13. Существует понятие множественные формы ферментов – это негенетически обусловленные модификации одного и того фермента (например активная
- 14. Лактатдегидрогеназа (ЛДГ) – фермент, катализирующий обратимое восстановление пирувата до лактата. Является белком с четвертичной структурой. Состоит
- 15. В цитоплазме клеток и сыворотке крови ЛДГ имеет 5 изоферментов, представленных 5 различными комбинациями 2-х типов
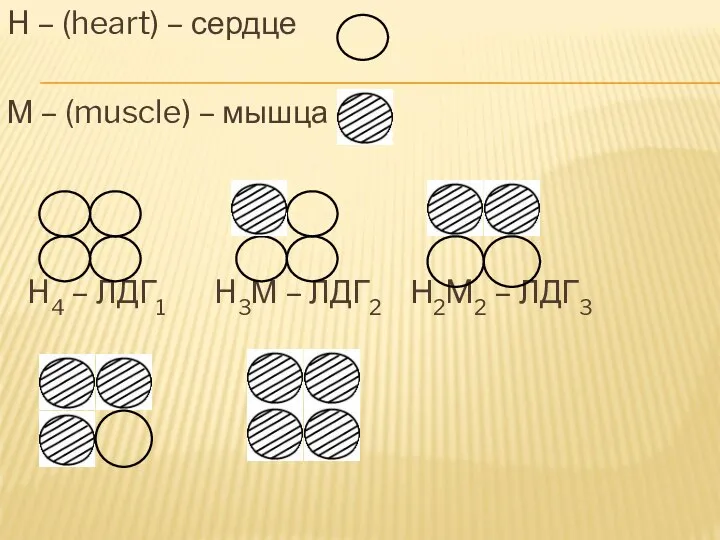
- 16. H – (heart) – сердце М – (muscle) – мышца H4 – ЛДГ1 H3М – ЛДГ2
- 17. Н–протомеры несут более выраженный отрицательный заряд, чем М–протомеры. Т.о. чем больше в комбинации Н-протомеров, тем в
- 18. ЛДГ5 старт ЛДГ4 ЛДГ3 ЛДГ2 ЛДГ1 Анод
- 19. ЛДГ 1 работает в аэробных условиях (сердце), следовательно с небольшим количеством субстрата, следовательно имеет высокую степень
- 20. Т.о. ЛДГ1 участвует в окислении лактата в пируват в тканях с аэробным типом метаболизма (миокард, мозг,
- 21. КРЕАТИНФОСФОКИНАЗА (КФК) Катализирует обратимый перенос фосфатного остатка между АТФ и креатином с образованием АДФ и креатинфосфата.
- 22. Креатинфосфокиназа (КФ 2.7.3.2.) Креатин + АТФ КФК креатинфосфат + АДФ Выделяют 2 типа субъединиц: B –
- 23. ЭНЗИМОПАТОЛОГИЯ Наука которая изучает заболевания связанные с нарушением функционирования энзимов. Нарушения функционирования энзимов – энзимопатии могут
- 24. 1. НАСЛЕДСТВЕННЫЕ ЭНЗИМОПАТИИ Включают в себя врожденные генетические заболевания обусловленные недостаточной активностью фермента или полное выпадение
- 25. 2. ТОКСИЧЕСКИЕ ЭНЗИМОПАТИИ Обусловлены: а) Воздействием на организм токсинов, инфекционных агентов Например: патологическая активация токсином холерного
- 26. 3. АЛИМЕНТАРНЫЕ - ПИЩЕВЫЕ Обусловлены недостаком поступления витаминов, микроэлементов. Например: цинга. Нарушается процесс гидроксилирования остатков пролина.
- 27. ОРГАНОСПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ Существуют ферменты присутствующие практически во всех органах и тканях. Как правило эти ферменты обеспечивают
- 28. В клинической лабораторной практике активность ферментов чаще всего определяют в плазме крови. Ферменты плазмы крови подразделяют:
- 29. 2. Экскреторные – синтезируются в печени, выделяются с желчью, но при определенных условиях могут попадать в
- 30. Для диагностики имеют значения следующие состояния: 1. Гиперферментемия – увеличенный синтез или выброс фермента из пораженного
- 31. ЭНЗИМОДИАГНОСТИКА ИНФАРКТА МИОКАРДА Патогенез: нарушение кровоснабжения участка сердечной мышцы приводит к разрушению кардиомиоцитов и резкому увеличению
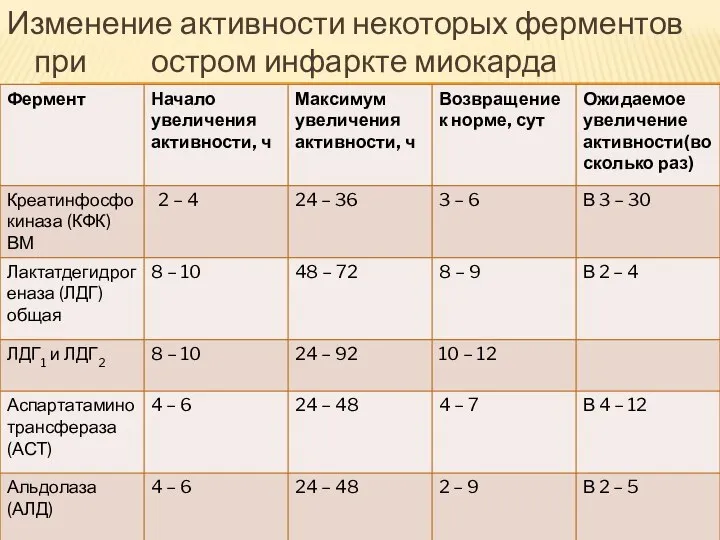
- 32. Изменение активности некоторых ферментов при остром инфаркте миокарда
- 33. Заболевания печени Разрушение гепатоцитов приводит к ↑ АЛТ (аланинаминотрансфераза) в сыворотке крови На практике часто используют
- 34. Коэффициент АЛТ Шмидта = АСТ + ГлДГ ГлДГ – глутаматдегидрогеназа К.ш.> 30 – при гепатитах с
- 35. ЭНЗИМОДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Основным ферментом для энзимодиагностики является α-амилаза. α-амилаза мочи называется диастаза. Повышение активности
- 36. Небольшое увеличение активности дает основание заподозрить патологию поджелудочной железы, но иногда может наблюдаться при других заболеваниях
- 37. Заболевание поджелудочной железы При поражениях поджелудочной железы отмечается также увеличение активности трипсина и липазы
- 38. ЭНЗИМОДИАГНОСТИКА ЗАБОЛЕВАНИЙ ДРУГИХ ОРГАНОВ Основана на явлении органоспецифичности
- 39. Рак предстательной ↑КФ железы (кислой фосфатазы) Рахит ↑ ЩФ (щелочная фосфатаза) Острая и хроническая ↑ЛДГ2, 3
- 41. Скачать презентацию




































 Основные свойства живого
Основные свойства живого Гипотеза А.И. Опарина
Гипотеза А.И. Опарина Презентация на тему "Популяции. Сообщества" - скачать презентации по Биологии
Презентация на тему "Популяции. Сообщества" - скачать презентации по Биологии Функции белков, жиров и углеводов
Функции белков, жиров и углеводов Презентация на тему "Кровеносная система. Кровь" - скачать презентации по Биологии
Презентация на тему "Кровеносная система. Кровь" - скачать презентации по Биологии Презентация на тему "Охрана природы" - скачать презентации по Биологии
Презентация на тему "Охрана природы" - скачать презентации по Биологии Кожа – наружный покровный орган
Кожа – наружный покровный орган Строение и функции корня
Строение и функции корня Физиология возбудимых тканей
Физиология возбудимых тканей Гомологи-аналоги для ЕГЭ
Гомологи-аналоги для ЕГЭ Презентация на тему "Отдел Моховидные" - скачать презентации по Биологии
Презентация на тему "Отдел Моховидные" - скачать презентации по Биологии Презентация на тему "Голосеменные" - скачать презентации по Биологии
Презентация на тему "Голосеменные" - скачать презентации по Биологии Тема урока: Класс Брюхоногие моллюски, или Улитки Д/З: пересказ п.16
Тема урока: Класс Брюхоногие моллюски, или Улитки Д/З: пересказ п.16 Презентация на тему "Технология КРМ на уроках словесности" - скачать презентации по Биологии
Презентация на тему "Технология КРМ на уроках словесности" - скачать презентации по Биологии Медицинская гельминтология
Медицинская гельминтология  Мхи-эпифиты памятника природы федерального значения Калужский городской бор
Мхи-эпифиты памятника природы федерального значения Калужский городской бор Презентация на тему "Изучение зависимости количества стрекоз от времени дня и погодных условий" - скачать презентации по Био
Презентация на тему "Изучение зависимости количества стрекоз от времени дня и погодных условий" - скачать презентации по Био Функционирование популяции и динамика ее численности Учитель биологии высшей категории Мокина Ирина Владимировна. МБОУ – гимна
Функционирование популяции и динамика ее численности Учитель биологии высшей категории Мокина Ирина Владимировна. МБОУ – гимна Рецепторная функция. Постоянные межклеточные контакты. Цитоскелет
Рецепторная функция. Постоянные межклеточные контакты. Цитоскелет Перевалка комнатных растений
Перевалка комнатных растений Жизнь птиц из разных сообществ в зимний период
Жизнь птиц из разных сообществ в зимний период Аттестационная работа. Образовательная программа по внеурочной деятельности Студия ЭКОс
Аттестационная работа. Образовательная программа по внеурочной деятельности Студия ЭКОс Зигмунд Фрейд основатель психоанализа
Зигмунд Фрейд основатель психоанализа Загадочные медузы
Загадочные медузы Динозавры Вымерший порядок пресмыкающихсяпредставители которого соединяли в себе свойства нескольких, ныне обособленных групп
Динозавры Вымерший порядок пресмыкающихсяпредставители которого соединяли в себе свойства нескольких, ныне обособленных групп  Фотобиологиялық әсер спектрлері. Биологиялық жүйелер люминесценциясы
Фотобиологиялық әсер спектрлері. Биологиялық жүйелер люминесценциясы Психогенетика как наука. Методы психогенетики
Психогенетика как наука. Методы психогенетики Здоровый образ жизни
Здоровый образ жизни