Содержание
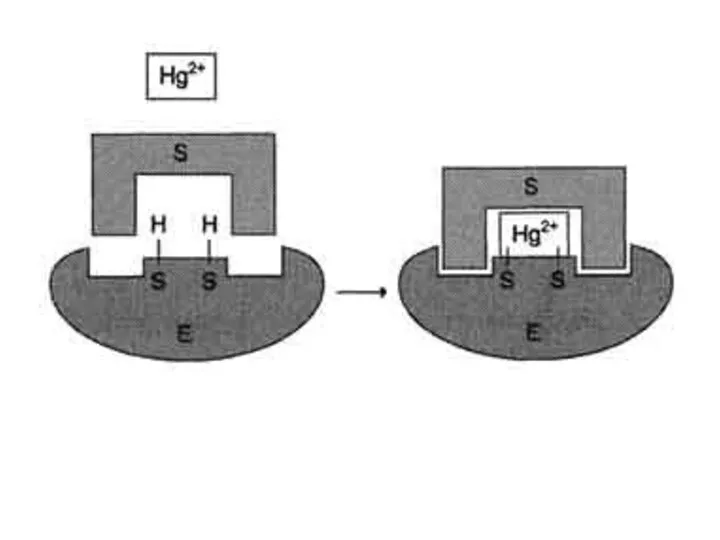
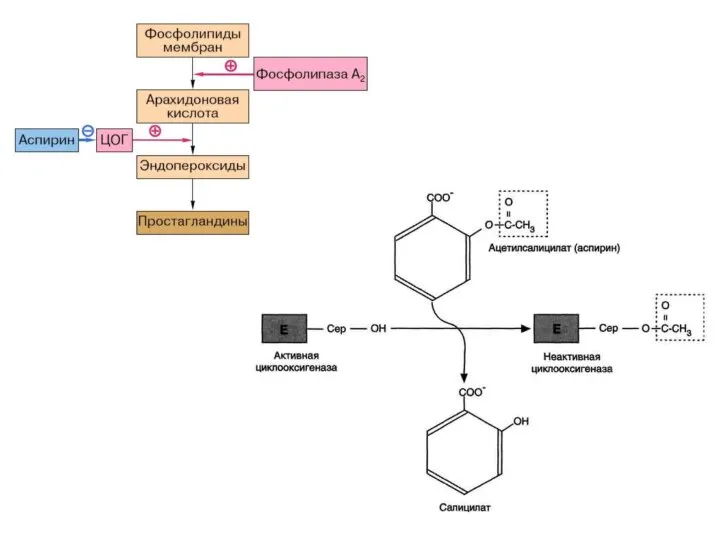
- 2. Ингибиторы – вещества, снижающие активность ферментов
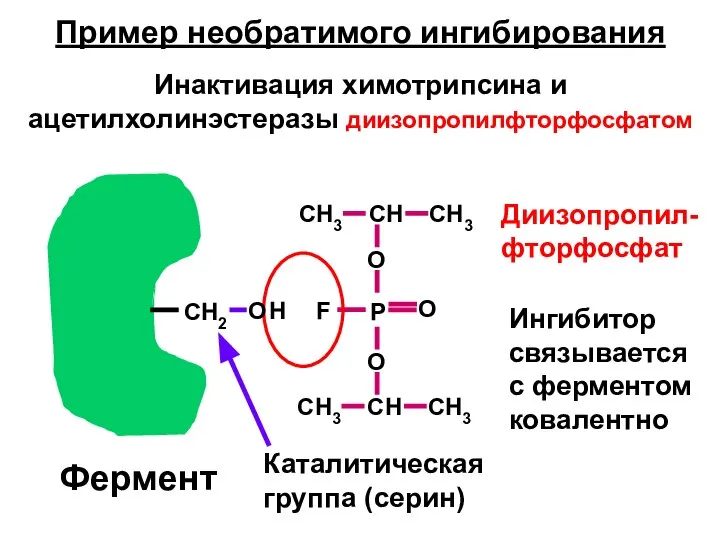
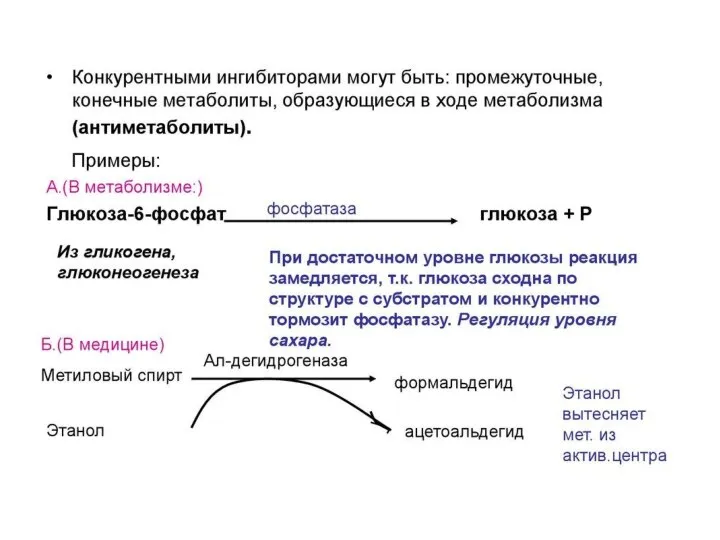
- 4. Пример необратимого ингибирования Инактивация химотрипсина и ацетилхолинэстеразы диизопропилфторфосфатом Фермент CH2 Каталитическая группа (серин) Н F Диизопропил-
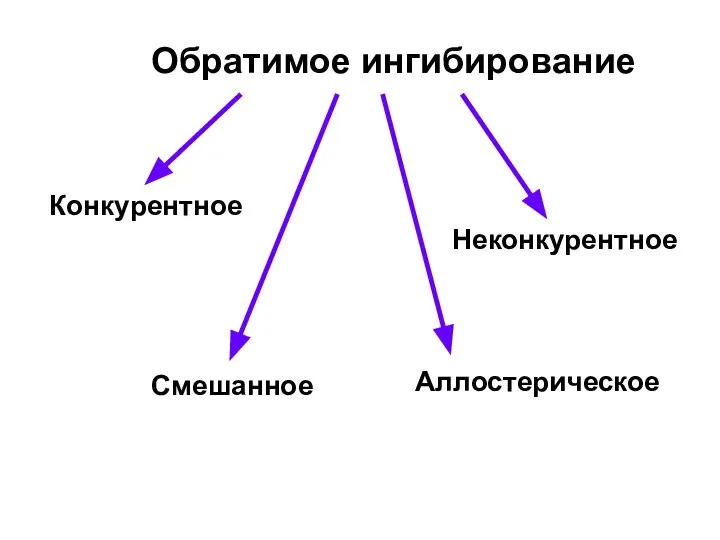
- 8. Обратимое ингибирование Конкурентное Неконкурентное Смешанное Аллостерическое
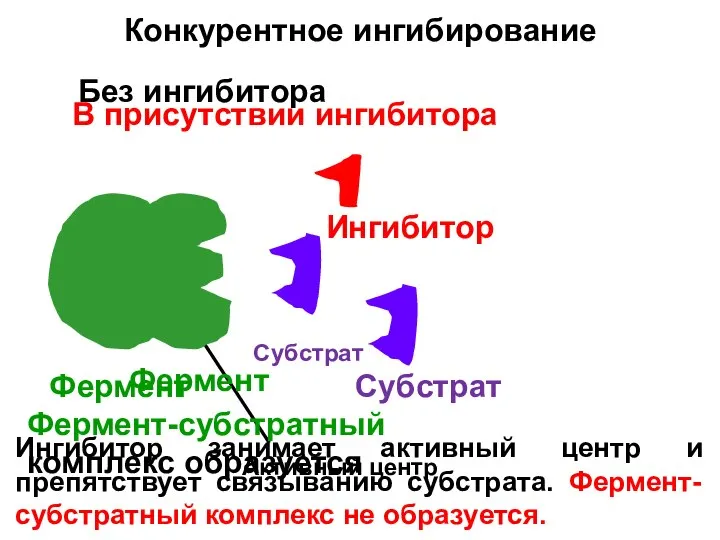
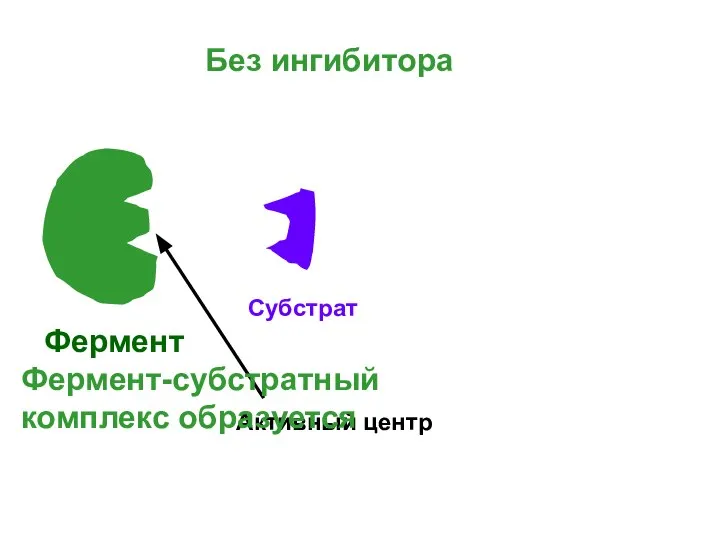
- 9. Конкурентное ингибирование Фермент Субстрат Активный центр Без ингибитора Фермент-субстратный комплекс образуется В присутствии ингибитора Фермент Субстрат
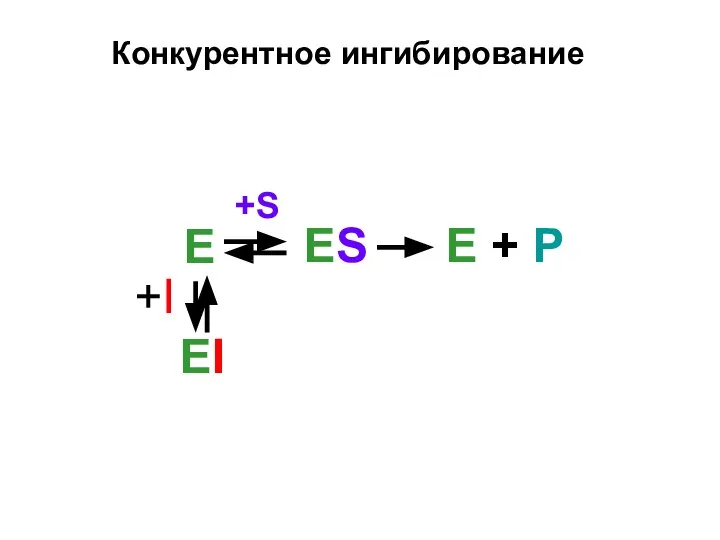
- 12. Конкурентное ингибирование E +S ES E + P +I EI
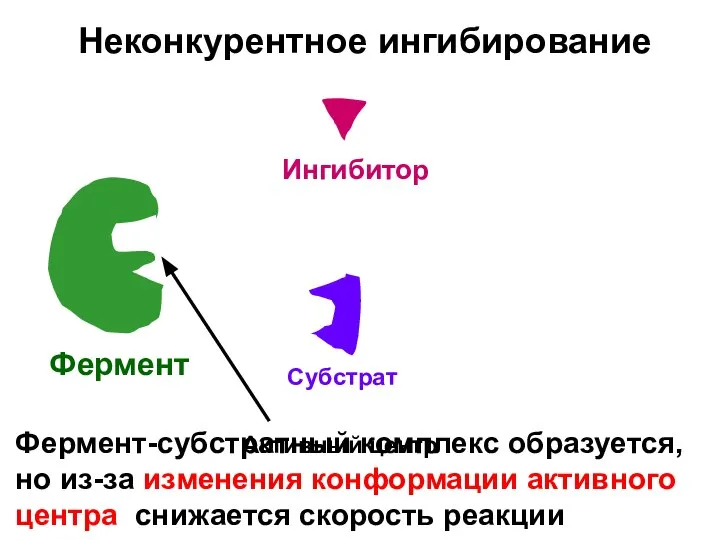
- 13. Неконкурентное ингибирование Фермент Субстрат Активный центр Ингибитор Фермент-субстратный комплекс образуется, но из-за изменения конформации активного центра
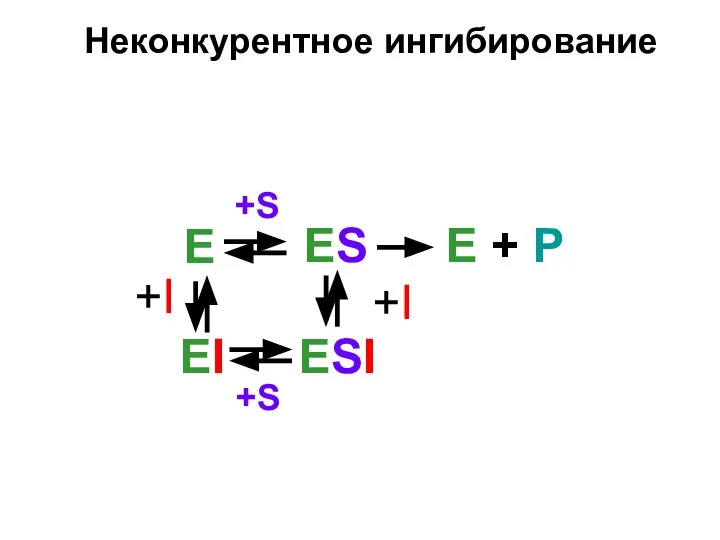
- 14. Неконкурентное ингибирование +S ESI +I E +S ES E + P +I EI
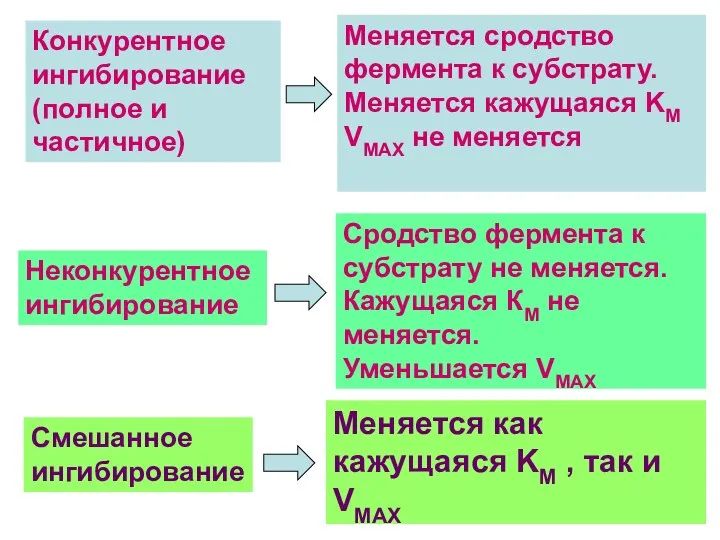
- 15. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это ситуация, когда ингибитор и субстрат не имеют структурного сходства и ингибитор не
- 16. Конкурентное ингибирование (полное и частичное) Меняется сродство фермента к субстрату. Меняется кажущаяся KM VMAX не меняется
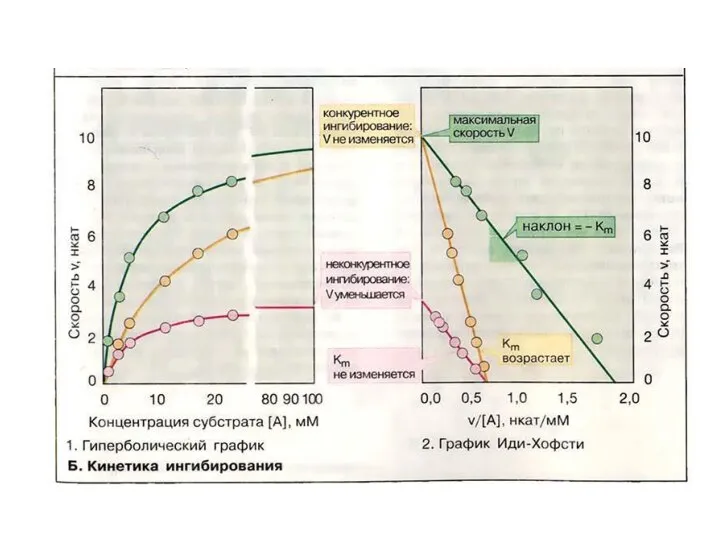
- 18. V [S] Без ингибитора VMAX В присутствии конкурентного ингибитора VMAX/2 KM KM В присутствии неконкурентного ингибитора
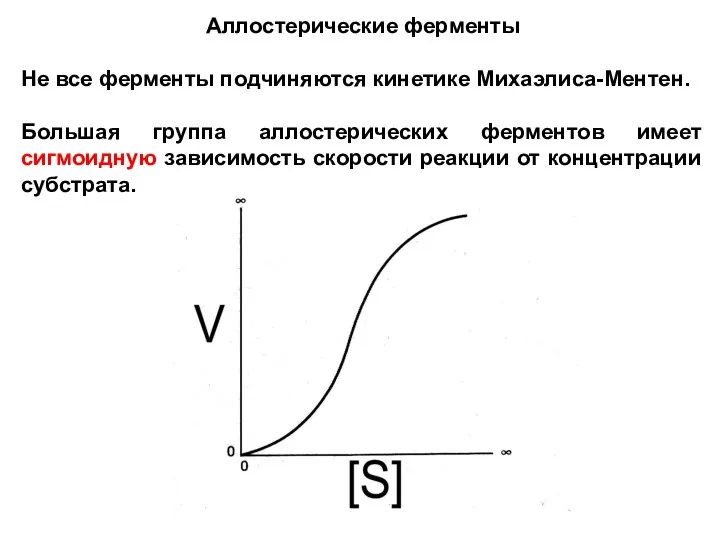
- 19. Аллостерические ферменты Не все ферменты подчиняются кинетике Михаэлиса-Ментен. Большая группа аллостерических ферментов имеет сигмоидную зависимость скорости
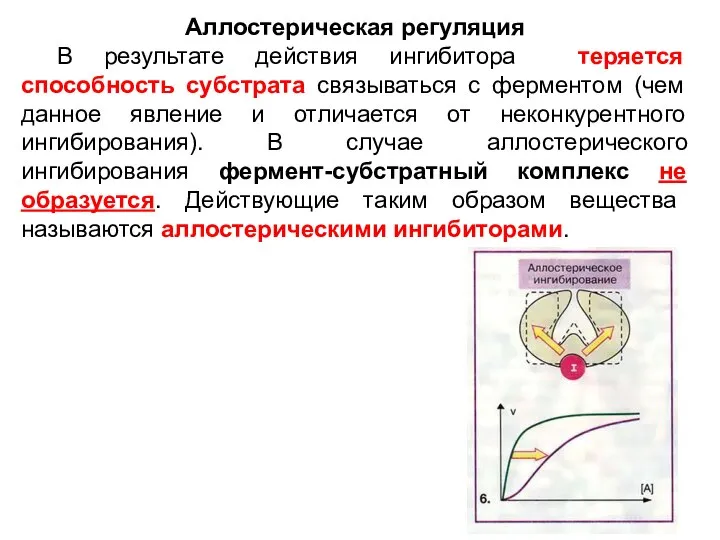
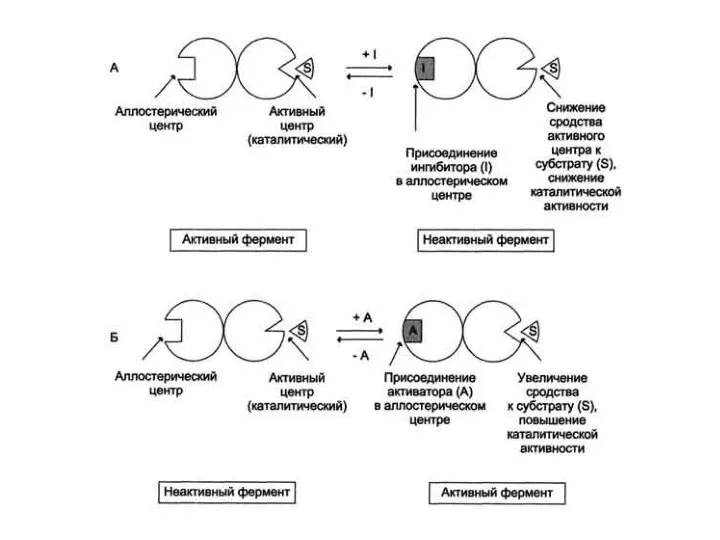
- 20. Аллостерическая регуляция В результате действия ингибитора теряется способность субстрата связываться с ферментом (чем данное явление и
- 21. Фермент Субстрат Активный центр Без ингибитора Фермент-субстратный комплекс образуется
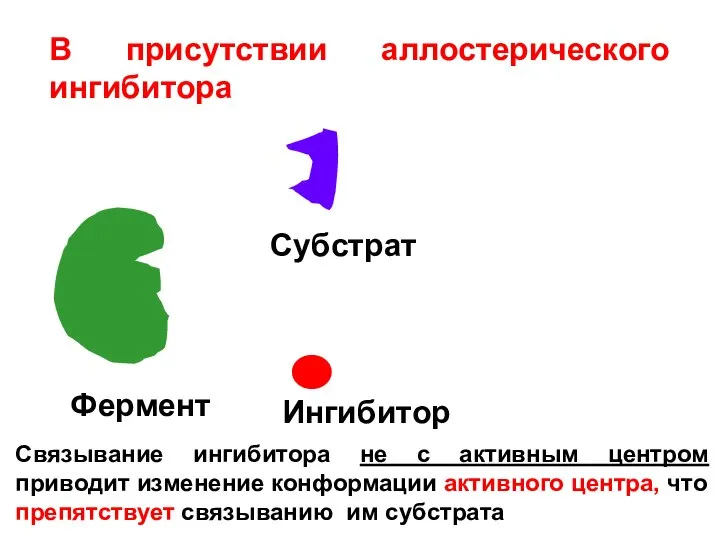
- 22. В присутствии аллостерического ингибитора Фермент Субстрат Ингибитор Связывание ингибитора не с активным центром приводит изменение конформации
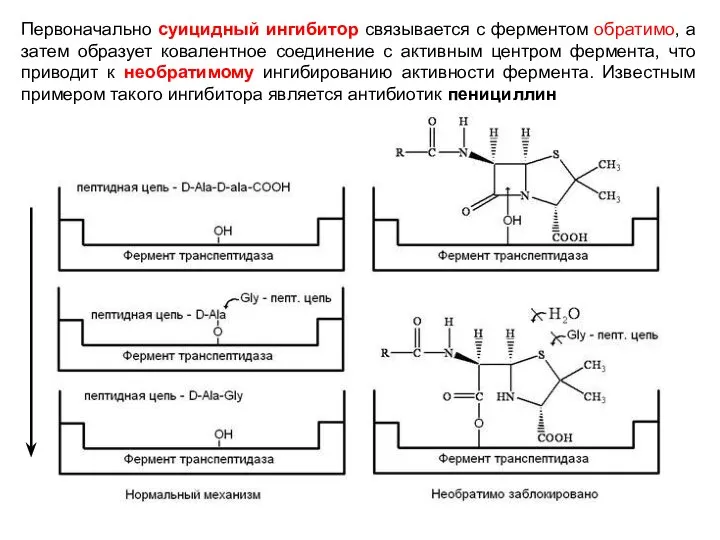
- 28. Первоначально суицидный ингибитор связывается с ферментом обратимо, а затем образует ковалентное соединение с активным центром фермента,
- 30. Скачать презентацию





![V [S] Без ингибитора VMAX В присутствии конкурентного ингибитора VMAX/2 KM](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/676786/slide-17.jpg)



 Торжество весны зеленой
Торжество весны зеленой Презентация на тему Путешествие с растениями по особо охраняемым территориям Кузбасса
Презентация на тему Путешествие с растениями по особо охраняемым территориям Кузбасса Основные экологические законы Презентация по биологии Подготовила учитель биологии Голубева С.В. МКОУ СОШ №4 г. Лесосибирск
Основные экологические законы Презентация по биологии Подготовила учитель биологии Голубева С.В. МКОУ СОШ №4 г. Лесосибирск Презентация на тему "Азбука естественного отбора" - скачать презентации по Биологии
Презентация на тему "Азбука естественного отбора" - скачать презентации по Биологии Хищные растения (насекомоядные или плотоядные)
Хищные растения (насекомоядные или плотоядные) Манул - редкий представитель семейства кошачьих
Манул - редкий представитель семейства кошачьих Живая и неживая природа зимой
Живая и неживая природа зимой Аналіз дендрофлори насаджень лісопарку Дружби народів(західна частина) м. Дніпроперовськ
Аналіз дендрофлори насаджень лісопарку Дружби народів(західна частина) м. Дніпроперовськ Роза, или шиповник (rosa)
Роза, или шиповник (rosa) Презентация на тему "Бинарный урок" - скачать бесплатно презентации по Биологии
Презентация на тему "Бинарный урок" - скачать бесплатно презентации по Биологии Знакомство с разными биоценозами в дошкольном возрасте
Знакомство с разными биоценозами в дошкольном возрасте Леса России. Деревья и кустарники
Леса России. Деревья и кустарники Опорно – двигательная система
Опорно – двигательная система Отряд Хоботные
Отряд Хоботные Одноклеточные или Простейшие животные Белякова Юлия, 7В класс МОУ СОШ №1
Одноклеточные или Простейшие животные Белякова Юлия, 7В класс МОУ СОШ №1  Явище змочування та капілярності в побуті,природі та техніці
Явище змочування та капілярності в побуті,природі та техніці Домашнее задание Изучить §39 Письменно выполнить задание на стр.189 (таблица)
Домашнее задание Изучить §39 Письменно выполнить задание на стр.189 (таблица)  Строение и возрастные особенности сердца. Сердечный цикл и его фазы
Строение и возрастные особенности сердца. Сердечный цикл и его фазы Микроорганизмы- художники
Микроорганизмы- художники Царства живой природы
Царства живой природы Презентация на тему "Нужна ли физика в изучении Опорно-двигательной системы человека" - скачать презентации по Биологии
Презентация на тему "Нужна ли физика в изучении Опорно-двигательной системы человека" - скачать презентации по Биологии Николай Алексеевич Заболоцкий
Николай Алексеевич Заболоцкий Общая характеристика и внешнее строение птиц
Общая характеристика и внешнее строение птиц Опорный конспект по теме «Зрение» Авторы: Морозова Н.В., учитель физики МОУ лицея №40 г.Петрозаводска Янюшкина Г.М., к.п.н., доцент к
Опорный конспект по теме «Зрение» Авторы: Морозова Н.В., учитель физики МОУ лицея №40 г.Петрозаводска Янюшкина Г.М., к.п.н., доцент к Органы выделения
Органы выделения ДЕЗИНФЕКЦИЯ Автор: Филатова А.С.
ДЕЗИНФЕКЦИЯ Автор: Филатова А.С.  Никитский ботанический сад Подготовила учитель биологии МОУ « СОШ с. Усть-Курдюм» Горбунова В.В. 2012г.
Никитский ботанический сад Подготовила учитель биологии МОУ « СОШ с. Усть-Курдюм» Горбунова В.В. 2012г. Хрящевые рыбы. Двоякодышащие рыбы. Кистепёрые рыбы
Хрящевые рыбы. Двоякодышащие рыбы. Кистепёрые рыбы