Ферменты. Механизм ферментативного катализа. Клакссификация ферментов. Общая характеристика представителей класса гидролаз
Содержание
- 2. Цель Дать представление о ферментах, как о биологических катализаторах белковой природы. Ознакомить с общими свойствами и
- 3. ПЛАН ЛЕКЦИИ Ферменты, понятие Механизм действия ферментов Номенклатура и классификация ферментов Значение ферментов в медицине
- 4. Ферменты ФЕРМЕНТЫ - это специализированные белки, образующиеся в клетках и способные ускорять химические процессы, т.е. ферменты
- 5. Термин «фермент» произошел от лат. «fermentum» - закваска, бродило. Был предложен голландским ученым Ван Гельмонтом в
- 6. Долгое время многие ученые продолжали считать ферменты, выделяемые клетками, чем-то принципиально отличным от внутриклеточных ферментов, для
- 7. Сходство ферментов и неорганических катализаторов: катализируют только энергетически возможные реакции; - не изменяют равновесия в обратимых
- 8. Отличия между ферментами и неорганическими катализаторами Ферменты имеют более сложное химическое строение Ферменты обладают высокой мощностью
- 9. Механизм действия ферментов
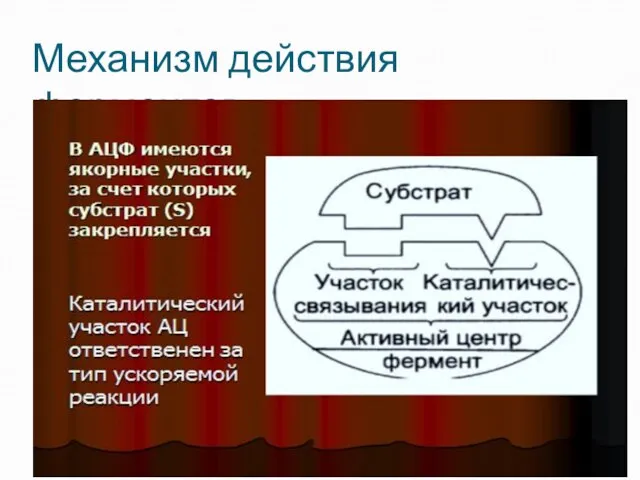
- 10. Активный центр фермента (АЦФ) Это уникальная для каждого Фермента совокупность функциональных групп АК остатков (сер.,цис.,гис. И
- 11. Первая стадия фермент отличается от белка наличием активного центра (АЦФ - участка, с помощью которого фермент
- 13. Первая стадия 1 этап- сближение и ориентации субстрата относительно активного центра фермента Е + S Е
- 14. Вторая стадия 2 этап - образование ЕS комплекса в результате индуцированного взаимодействия Е + S ЕS
- 15. Вторая стадия функционально-активные группы АЦ фермента действуют на субстрат, дестабилизируя связи в нем, вызывая изменение конфигурации
- 16. Третья стадия 3 этап – деформация S и образование нестабильного комплекса Е-ПР (фермент-продукты реакции) ПР –
- 17. Четвертая стадия от нее зависит скорость реакции. Происходит отделение фермента от продуктов реакции ЕР Е +
- 20. Этапы ферментативного катализа 1 этап- сближение и ориентации субстрата относительно активного центра фермента 2 этап -
- 21. 3 этап – деформация S и образование нестабильного комплекса Е-ПР 4 этап – распад комплекса с
- 22. Любая химическая реакция происходит при столкновении молекул реагирующих веществ. Движение молекул реагирующих веществ в системе зависит
- 23. Все катализаторы, в т.ч. ферменты понижают энергетический барьер реакции (снижают энергию активации), что делает возможным более
- 24. Общие свойства ферментов 1. Ферменты – это вещества белковой природы, поэтому они обладают всеми свойствами, характерными
- 25. 2. имеют сложное химическое строение. Различают ферменты-протеины- однокомпонентные ферменты И ферменты-протеиды – двукомпонентные ферменты
- 26. Однокомпонентные ферменты Специфические простые белки. Каталитическая активность зависит от наличия активного центра (АЦ) АЦ имеет два
- 28. Ферменты-протеиды (двукомпонентные) (холоферменты) Состоят из белковой части – апофермент И вещества небелковой природы – кофермент Роль
- 29. Апофермент обуславливает субстратную специфичность фермента (на что действует фермент) Кофермент – обеспечивает специфичность действия фермента, тип
- 30. Двукомпонентные ферменты могут иметь несколько молекулярных форм, которые называются изоферментами
- 31. Изоферменты— молекулярные формы ферментов, катализирующие одну и ту же реакцию с одним и тем же субстратом,
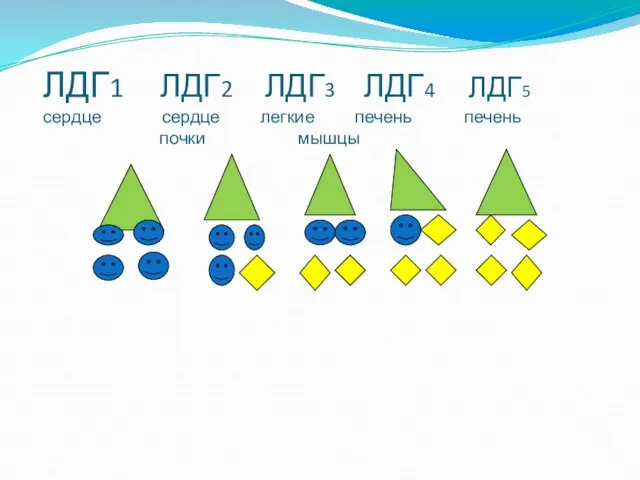
- 32. Лактатдегидрогеназа (ЛДГ) ускоряет реакцию дегидрирования молочной кислоты, имеет пять изоферментов, которые отличаются соотношением различных по строению
- 33. НАД НАДН2 СН3 СН3 СНОН С=О СООН СООН
- 34. Изоф Типы пп цепей ЛДГ1 - 4 цепи Н типа ЛДГ2 - 3 цепи Н-типа и
- 35. Место нахождения ЛДГ1 в сердце; ЛДГ2 в основном, в сердце, почках ЛДГ3 в легких ЛДГ4, в
- 36. ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5 сердце сердце легкие печень печень почки мышцы
- 37. Изоферменты позволяют лучше приспособиться к изменению внешних и внутренних факторов и ведут одну и ту же
- 38. 3. Ферменты обладают специфичностью действия способны избирательно действовать на определенный субстрат и ускорять определенную химическую реакцию.
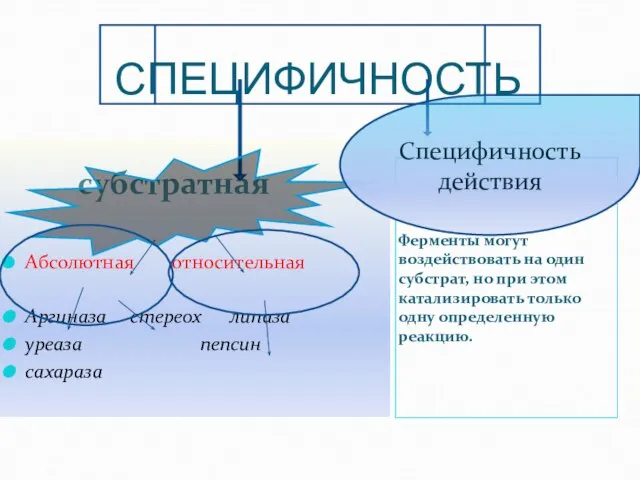
- 39. СПЕЦИФИЧНОСТЬ субстратная Ферменты могут воздействовать на один субстрат, но при этом катализировать только одну определенную реакцию.
- 40. При абсолютной (индивидуальной) специфичности фермент воздействует на один-единственный субстрат. Примером может служить специфичность аргиназы, расщепляющей только
- 41. аргиназа Аргинин орнитин +мочевина сахараза Сахароза глюкоза + фруктоза
- 42. Стереохимическая субстратная специфичность — — высшее проявление абсолютной субстратной специфичности. Фермент катализирует превращение только одного из
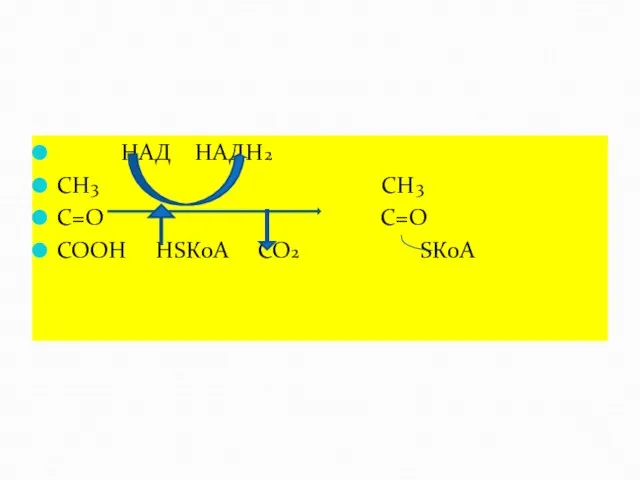
- 43. Специфичность действия - это способность ферментов производить с субстратом лишь одно из возможных химических превращений. Ферменты
- 44. НАД НАДН2 СН3 СН3 С=О С=О СООН НSКоА СО2 SКоА
- 45. Относительная (групповая) специфичность. Фермент, обладающий таким видом субстратной специфичности, может оказывать воздействие на группу сходных субстратов,
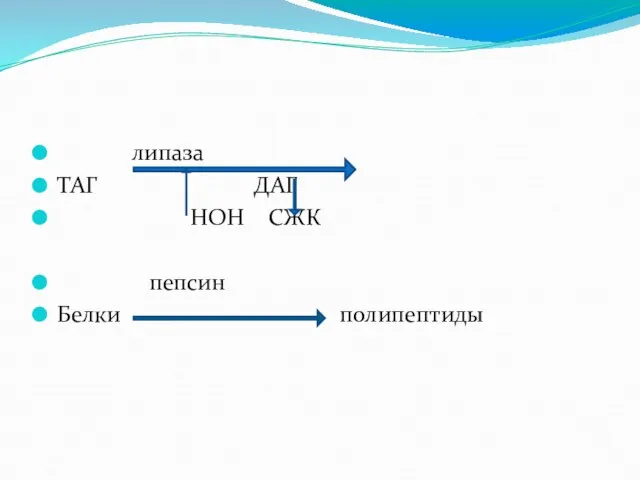
- 46. липаза ТАГ ДАГ НОН СЖК пепсин Белки полипептиды
- 47. 4. Ферменты обладают большой мощностью действия. Большинство реакций, катализируемых ферментами, протекают в 10-100 раз быстрее, чем
- 48. Для характеристики мощности действия ферментов введено понятие катал — число молекул субстрата, подвергающееся воздействию одной молекулы
- 49. Мощность большинства ферментов равна 1000 каталов, мощность действия каталазы — 1.000.000 каталов, амилазы — 240 000,
- 50. 5. Ферменты не входят в состав конечных продуктов, катализируемых ими реакций 6.Ферменты – это катализаторы с
- 51. Факторы, влияющие на активность ферментов
- 52. Влияние рН среды Оптимум рН = 4 - 7 1,5 – 2,0 8,0-9,0 ИЭТ ИЭН ИЭС
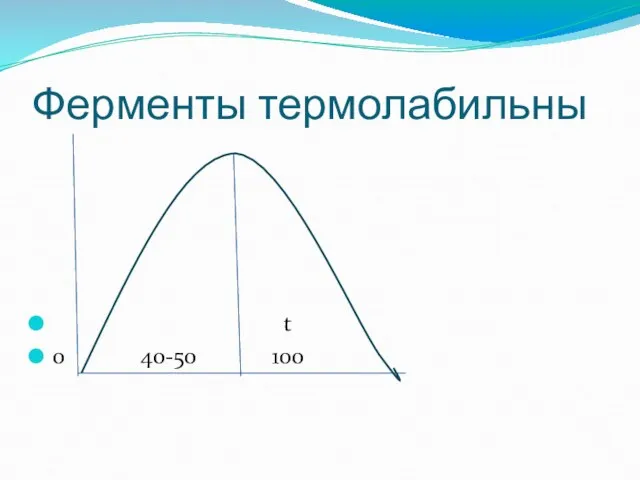
- 53. Ферменты термолабильны t 0 40-50 100
- 54. обратимая Инактивация необратимая
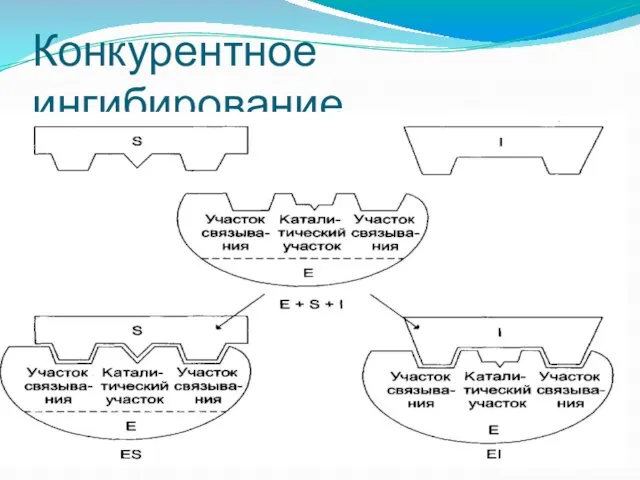
- 55. Конкурентное ингибирование
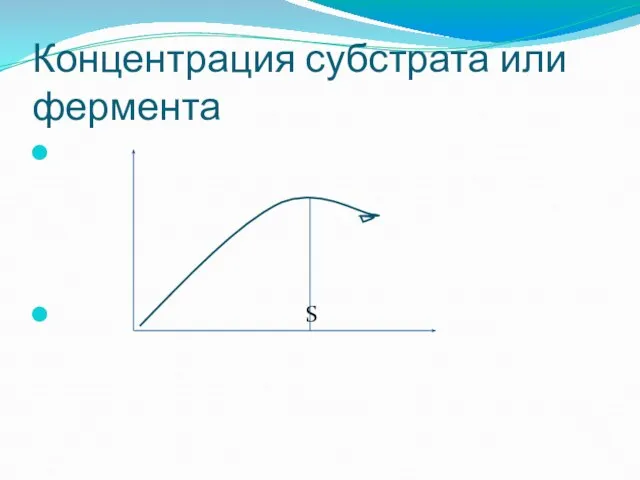
- 56. Концентрация субстрата или фермента S
- 58. 1 класс - Оксидоредуктазы 2 класс - Трансферазы 3 класс - Гидролазы 4 класс - Лиазы.
- 60. Номенклатура и классификация ферментов класс подкласс, подкласс подподкласс, в каждом подподклассе обозначен порядковый номер представителя.
- 61. Поэтому для каждого фермента существует шифр, состоящий из 4 цифр – первая показывает номер класса, вторая
- 62. Шифр для липазы поджелудочной железы – 3.1.1.3., это означает, что липаза п/ж относится к гидролазам, (третий
- 63. 1 класс - Оксидоредуктазы – ускоряют окислительно-восстановительные реакции.
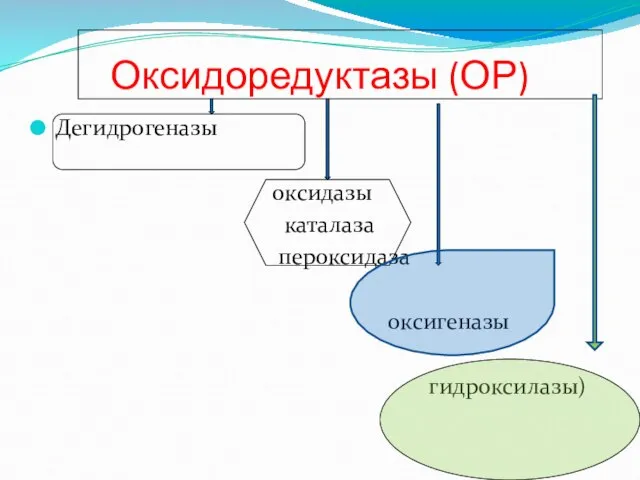
- 64. Оксидоредуктазы (ОР) Дегидрогеназы оксидазы каталаза пероксидаза оксигеназы гидроксилазы)
- 65. дегидрогеназы Дегидрогеназы анаэробные К ДГ относятся ферменты осуществляющие окисление вещества путем дегидрирования (Пиридинферменты) Аэробные ДГ флавинферменты
- 66. оксидазы Цитохромы ЦХ (гемсодержащие гемопротеиды). ЦХ служат переносчиками электронов
- 67. гидропероксидазы Каталаза и пероксидаза Катализируют реакции разложения перекиси водорода
- 68. оксигеназы Гидроксилазы и оксигеназы Способствуют окислению субстрата, включая в его молекулу кислород Гидроксилазы включают атом кислорода
- 69. трансферазы 2 класс - Трансферазы – катализируют перенос атомов или группы атомов от одного вещества на
- 70. гидролазы 3 класс - Гидролазы – катализируют распад сложных веществ на более простые с участием воды.
- 71. лиазы 4 класс - Лиазы – катализируют распад или синтез веществ без участия воды.
- 72. изомеразы 5 класс - Изомеразы – катализируют процесс изомеризации.
- 73. Лигазы или синтетазы 6 класс - Лигазы или синтетазы – ускоряют процесс синтеза с использованием энергии
- 74. Применение ферментов в медицине Ферментные препараты широко используются в медицине: Энзимодиагностика Энзимотерапия В качестве специфических реактивов
- 75. Применение ферментов в медицине Ферментные препараты широко используют в медицине Ферменты в медицинской практике используют в
- 76. Клиническое значение определения отдельных ферментов Большинство ферментов находятся в клетках и их активность в сыворотке крови
- 77. В этой связи наиболее значимыми для клиники являются представители класса гидролаз, трансфераз и ЛДГ. Уровень активности
- 78. Уровень активности сывороточной альдолазы составляет 1-7,5ЕД/л (0,0038-0,020мкМ/мин•мл). Сывороточная альдолаза (фруктозо-1,6-дифосфатаза) увеличивается в основном при заболеваниях скелетной
- 79. ЩФ (щелочная фосфатаза) широко распространена в тканях человека, особенно в слизистой оболочке кишечника, остеобластах, стенках желчевыводящих
- 80. Активность ЩФ повышается при холестазе (застое желчи), или механической желтухе, а также при заболеваниях костей
- 81. Кислая фосфатаза Уровень активности КФ (кислая фосфатаза) в норме 0-6,5МЕ/л. Этот фермент содержится почти во всех
- 82. КФ (кислая фосфатаза) увеличивается в основном при прогрессирующей болезни Педжета (заболевание костной системы) , раке предстательной
- 83. Аланинаминотрансфераза (АЛТ) Аспартатаминотрансфераза (АСТ) АЛТ и АСТ находятся во многих тканях, но больше всего их в
- 84. Активность данных ферментов повышается значительно при остром гепатите, некрозе печени, травматическом повреждении мышц и инфаркте миокарда.
- 85. ГГТ находится в больших количествах в печени, почках, поджелудочной железе. Этот фермент считается маркером рака поджелудочной
- 86. Для клинической диагностики важно понятие «изоферменты» Изоферменты – это множественные формы одного и того же фермента,
- 87. Изоферменты имеют одинаковое строение кофермента (небелковой части) и разное строение апофермента (белковой части), поэтому имеют разную
- 88. Креатинфосфотрансфераза, или креатинфосфокиназа (КФК) имеет 3 изофермента – КФК1 – в нервной ткани, КФК2 - в
- 89. ЛДГ1 находится в сердце и эритроцитах; ЛДГ2 – в основном в почках; ЛДГ3 – в основном
- 90. Клиническое значение определения отдельных ферментов Большинство ферментов находятся в клетках и их активность в сыворотке крови
- 91. В этой связи наиболее значимыми для клиники являются представители класса гидролаз, трансфераз и ЛДГ. Уровень активности
- 92. Уровень активности сывороточной альдолазы составляет 1-7,5ЕД/л (0,0038-0,020мкМ/мин•мл). Сывороточная альдолаза (фруктозо-1,6-дифосфатаза) увеличивается в основном при заболеваниях скелетной
- 93. ЩФ широко распространена в тканях человека, особенно в слизистой оболочке кишечника, остеобластах, стенках желчевыводящих путей, плаценте
- 94. Активность ЩФ повышается при холестазе (застое желчи), или механической желтухе, а также при заболеваниях костей Уровень
- 95. КФ увеличивается в основном при прогрессирующей болезни Педжета (заболевание костной системы) и раке предстательной железы
- 96. АЛТ и АСТ находятся во многих тканях, но больше всего их в сердце и печени. Активность
- 97. ГГТ находится в больших количествах в печени, почках, поджелудочной железе. Этот фермент считается маркером рака поджелудочной
- 98. Для клинической диагностики важно понятие «изоферменты» Изоферменты – это множественные формы одного и того же фермента,
- 99. Креатинфосфотрансфераза, или креатинфосфокиназа (КФК) имеет 3 изофермента - КФК1 – в нервной ткани, КФК2 - в
- 100. ЛДГ1 находится в сердце и эритроцитах; ЛДГ2 – в основном в почках; ЛДГ3 – в основном
- 101. Изоферменты имеют одинаковое строение кофермента (небелковой части) и разное строение апофермента (белковой части), поэтому имеют разную
- 102. Применение гидролаз в медицине гидролазы используются для заместительной терапии. Пепсин, трипсин, панкреатин применяются при гастритах, при
- 103. для растворения тромба при тромбофлебитах, инфаркте миокарда. Стрептокиназа предложена академиком Е. П. Чазовым для введения через
- 104. для рассасывания гематом при операциях на лице, травмах (в виде таблеток, мази, содержащих гидролазы). для рассасывания
- 105. Литература основная Т.Ш.Шарманов, С.М.Плешкова «Метаболические основы питания с курсом общей биохимии», Алматы, 1998 г. Е.С. Северин
- 106. дополнительная Б.Гринстейн, А.Гринстейн «Наглядная биохимия», 2000 г. Т.Т.Березов, Б.Ф.Коровкин «Биологическая химия», 2002 г. Д.Г.Кнорре, С.Д.Мызина «Биологическая
- 108. Скачать презентацию
































































































 Самые-самые домашние животные Каждое животное уникально, но среди домашних питомцев различия между представителями одной пор
Самые-самые домашние животные Каждое животное уникально, но среди домашних питомцев различия между представителями одной пор Редкие растительные волокна
Редкие растительные волокна Микропрепараты
Микропрепараты Презентация на тему "Мхи" - скачать презентации по Биологии
Презентация на тему "Мхи" - скачать презентации по Биологии Паразитические растения и грибы
Паразитические растения и грибы Сравнение Японской и Техасской белой породы перепелов
Сравнение Японской и Техасской белой породы перепелов Надежная защита организма
Надежная защита организма Происхождение человека План: Эволюция приматов Доказательства эволюционного происхождения человека Стадии антропогенеза Чел
Происхождение человека План: Эволюция приматов Доказательства эволюционного происхождения человека Стадии антропогенеза Чел Приспособление организмов к водной среде обитания
Приспособление организмов к водной среде обитания Презентация на тему Размножение растений
Презентация на тему Размножение растений Строение и свойства животной клетки
Строение и свойства животной клетки Лес и его обитатели
Лес и его обитатели Внедрение в приусадебное хозяйство высокоурожайных перспективных сортов картофеля, устойчивых к болезням.
Внедрение в приусадебное хозяйство высокоурожайных перспективных сортов картофеля, устойчивых к болезням.  Экскурсия на водоём. Создатель :Васильева Вита
Экскурсия на водоём. Создатель :Васильева Вита «Причины и профилактика нарушений зрения у школьников» Исследовательская работа
«Причины и профилактика нарушений зрения у школьников» Исследовательская работа  Значение солей в клетке
Значение солей в клетке  Презентация на тему Деление клетки. Митоз.
Презентация на тему Деление клетки. Митоз.  Механіка скорочення м’язового волокна
Механіка скорочення м’язового волокна Лосось атлантичний (сьомга)
Лосось атлантичний (сьомга) Презентация на тему "Живые барометры" - скачать бесплатно презентации по Биологии
Презентация на тему "Живые барометры" - скачать бесплатно презентации по Биологии Экологический урок
Экологический урок Органы кровообращения. Сердце
Органы кровообращения. Сердце Характерные особенности отряда Голубеобразные класса Птицы
Характерные особенности отряда Голубеобразные класса Птицы Презентація на тему:
Презентація на тему: Пластический обмен Синтез белка Сергеева Татьяна Викторовна, учитель биологии и химии МАОУ «СОШ №34» г. Великий Новгород
Пластический обмен Синтез белка Сергеева Татьяна Викторовна, учитель биологии и химии МАОУ «СОШ №34» г. Великий Новгород Органы пищеварительной системы. Строение и функции желудка
Органы пищеварительной системы. Строение и функции желудка Разнообразие цветов и строение цветов. Выполнила ученица 7 класса МБОУ «Гимназия №5» г. Белгорода Мишенина Валерия Руководите
Разнообразие цветов и строение цветов. Выполнила ученица 7 класса МБОУ «Гимназия №5» г. Белгорода Мишенина Валерия Руководите Вымерший вид акул мегалодон
Вымерший вид акул мегалодон