Содержание
- 2. План 14.1 Основы биогеохимии 14.2 Химия s-элементов 14.3 Химия d-элементов 14.4 Химия p-элементов
- 3. 14.1 Биогеохимия – это наука, изучающая распределение химических элементов и их миграцию в биосфере.
- 4. Основным вопросом биогеохимии является вопрос о взаимосвязи живого и неживого вещества.
- 5. Становление биогеохимии как науки произошло в 30-е годы XX века. Ее основоположником является академик В.И. Вернадский.
- 6. В.И. ВЕРНАДСКИЙ (1863-1945) Академик Вернадский– основоположник современных наук о Земле - геохимии, биогеохимии, радиогеологии и др.
- 7. Биосфера – это единственная область Земли, занятая жизнью. Все живые существа в ней образуют биомассу, причем
- 8. Анализируя содержание элементов в земной коре и в живых организмах, Вернадский пришел к выводу, что качественный
- 9. Однако по количественному составу объекты живой и неживой природы существенно отличаются друг от друга.
- 10. 98 % земной коры составляют 8 химических элементов: О, Si, Al, Fе, Са, Na, К, Mg
- 11. В живом организме преобладают 6 элементов: С, H, О, N, P, S, на которые приходится 97,4
- 12. В земной коре преобладают металлы, а в живых организмах - неметаллы.
- 13. Из основных элементов биомассы только кислород и кальций широко представлены в земной коре.
- 14. Такие элементы как кремний, алюминий и железо, находящиеся в земной коре в наибольших количествах, в биомассе
- 15. Согласно теории А.П. Виноградова, живые организмы легко накапливают те химические элементы, которые образуют газы и пары
- 16. Например: С – макро-элемент, т.к. образуемые им оксиды СО и СО2 – газы; Si – микроэлемент,
- 17. БИОГЕННЫМИ называются химические элементы в той или иной форме входящие в состав биомассы и выполняющие в
- 18. К важнейшим биогенным элементам относятся: 6 неметаллов-органогенов: C, O, H, N, P, S; 10 биометаллов (металлов
- 19. По содержанию в биомассе химические элементы делятся на: МАКРОЭЛЕМЕНТЫ (более 10‾2 %): неметаллы-органогены и Cl, а
- 20. МИКРОЭЛЕМЕНТЫ (10‾5-10‾3 %): биометаллы, относящиеся к d-блоку, а так же Ni, Cr, Si, B и др.;
- 21. Установлена взаимосвязь между содержанием элемента в организме и его положением в ПС.
- 22. В подгруппах сверху вниз происходит увеличение токсичности химических элементов и их соединений и, как следствие, уменьшение
- 24. На токсичность химического элемента влияет степень его окисления в соединении. Чем выше степень окисления элемента, тем
- 25. Так, ионы хрома Сr3+ являются малотоксичными, а анионы СrO42- и Cr2O72-, содержащие Cr6+, характеризуются высокой токсичностью.
- 26. А.П. Виноградов сформулировал понятие о БИОГЕОХИ-МИЧЕСКОЙ ПРОВИНЦИИ. 1895-1975
- 27. Это часть биосферы, характеризующаяся экстремальными геохимическими условиями и определенными постоянными реакциями организмов на них (эндемические заболевания,
- 28. Например, Белорусское Полесье характеризуется крайне низким содержанием йода, что приводит к массовым случаям заболевания щитовидной железы
- 29. Спектр йоддефицитных заболеваний весьма широк. Дефицит тиреоидных гормонов у плода приводит к снижению умственного развития, вплоть
- 30. Биогеохимия явилась фундаментом для современной экологической химии, изучающей вопросы, связанные с характеристикой основных химических токсикантов, методами
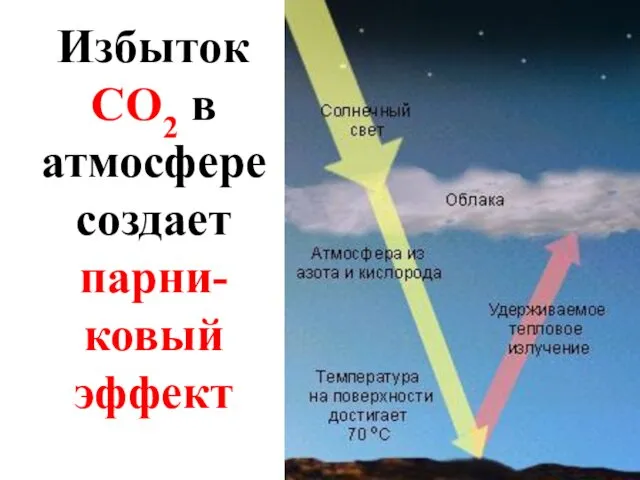
- 31. К важнейшим токсикантам относятся: 1) СО2 – энергетика, промышленность, отопление
- 32. Избыток CO2 в атмосфере создает парни-ковый эффект
- 33. 2) СО – металлургия, транспорт, переработка нефти; СО образует комплекс с гемоглобином (кровь теряет способность переносить
- 34. 3) SO2 – энергетика, химическая промышленность, переработка нефти; является причиной появления кислотных дождей.
- 35. 4) NO и NO2 – двигатели внутреннего сгорания, реактивные двигатели, домны, химическая промышленность; кислотные дожди и
- 36. 5) Hg – производство лаков и красок, обогащение руд, целлюлозно-бумажная промышлен-ность
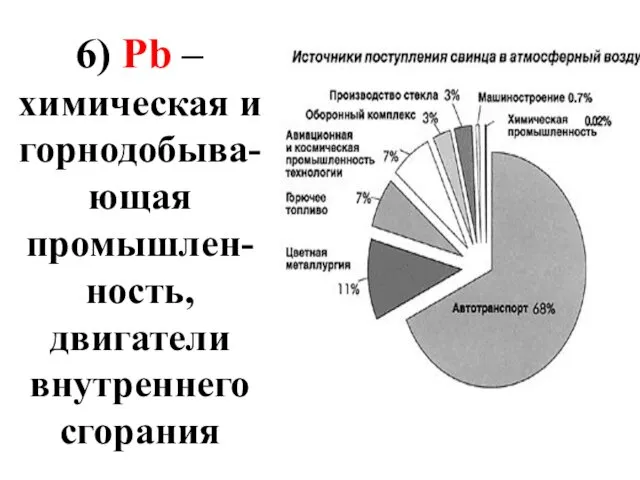
- 37. 6) Pb – химическая и горнодобыва-ющая промышлен-ность, двигатели внутреннего сгорания
- 38. 7) фосфаты химические моющие средства, удобрения
- 39. 8) нефть – нефтеперерабатывающая промышленность, транспортировка нефти
- 40. 9) пестициды – сельское хозяйство, хлорирование воды (диоксины); 10) радиация – производство ядерного топлива, атомная энергетика.
- 41. 14.2 Исходя из современной квантово-механической интерпретации периодической системы, классификация химических элементов производится в соответствии с их
- 42. Она основана на характере заполнения орбиталей электронами. В соответствии с этим принципом все элементы делятся на
- 43. К s-блоку относятся химические элементы с электронной формулой nsx, где х = 1, 2.
- 44. Различают s1-элементы (щелочные металлы и водород ) и s2-элементы (Be, Mg, щелочноземельные металлы и гелий).
- 45. Элементы s-блока – это металлы (исключение составляют H и He). Самыми активными являются щелочные металлы, легко
- 46. Их высокая металличность обусловлена большими атомными радиусами и лишь одним валентным электроном на внешнем уровне. s2-Элементы
- 47. В подгруппах s-элементов сверху вниз металличность атомов усиливается, что обусловлено увеличением атомных радиусов и уменьшением энергии
- 48. В своих соединениях s-металлы проявляют степени окисления +1 (щелочные) и +2 (Be, Mg и щелочноземельные металлы).
- 49. Оксиды и гидроксиды s-металлов имеют основной характер, усиливающий с ростом металличности элементов: NaOH Mg(OH)2 Уменьшение основности
- 50. Исключением являются BeO и Be(OH)2, обладающие амфотерными свойствами: 2 H+ + BeO22- ⇄ Be(OH)2 ⇄ Be2+
- 51. Гидриды s-металлов – твердые солеподобные вещества ионного типа, легко разлагающиеся водой и кислотами: MgH2 + 2
- 52. Особое положение среди s-элементов занимает водород. Согласно современным представлениям, водород с электронной конфигурацией 1s1 нельзя отнести
- 53. К важнейшим биогенным элементам s-блока, кроме H, относятся Na, K, Ca и Mg. Все они являются
- 54. К высокотоксичным элементам относится барий. Например, высшей летальной дозой BaCl2 является 1 г/ 70 кг массы
- 56. 14.3 Элементами d-блока (или переходными элементами) называются элементы, атомы которых имеют электронную конфигурацию ns2(n-1)dх, где х
- 57. Исключение составляют Ag, Cu, Au, Cr, Pt, Nb, Ru, Rh и некоторые другие элементы, для которых
- 58. Появление электронного проскока объясняется повышенной стабильностью d-подуровня: а) полностью заполненного электронами (d10), б) заполненного на половину
- 59. Элементы d-блока расположены в побочных подгруппах I Б –VIII Б; они являются металлами средней и низкой
- 60. Особенностью d-элементов является отсутствие монотонности в изменении их свойств как в подгруппах сверху вниз, так и
- 61. Причиной этого явления является эффект d-сжатия, вызванный проникновением внешних d-электронов к ядру и приводящий к уменьшению
- 62. Сильнее всего эффект d-сжатия проявляется у d1, d2 и d3 –элементов, он практически отсутствует у d9
- 63. R,нм Порядковый номер элемента Зависимость атомных радиусов d-элементов от их порядкового номера в периоде d6 d7
- 64. Наличие эффекта d - сжатия является причиной появления триад d-элементов , относящихся к VIII Б группе.
- 65. Элементы триад имеют сходные физико-химические и биологические свойства из-за близкого значения атомных радиусов.
- 66. Триада железа Fe Co Ni R, нм 0,123 0,118 0,114 ОЭО 1,64 1,70 1,75 d6 d7
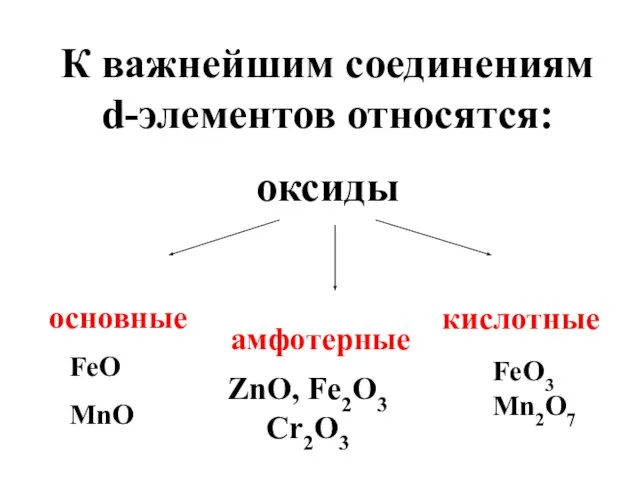
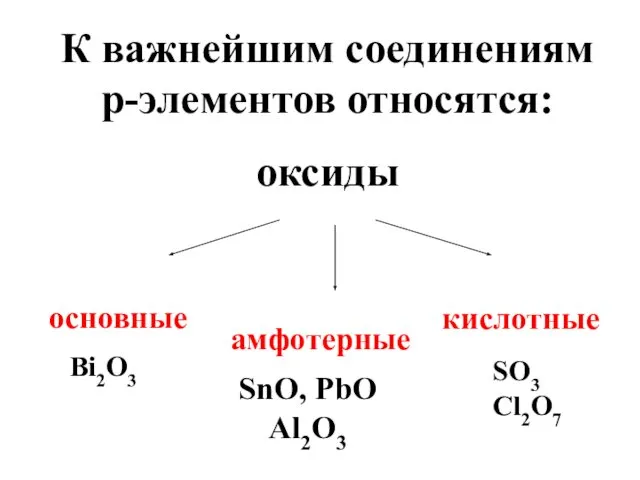
- 67. К важнейшим соединениям d-элементов относятся: оксиды основные кислотные амфотерные FeO MnO ZnO, Fe2O3 Cr2O3 FeO3 Mn2O7
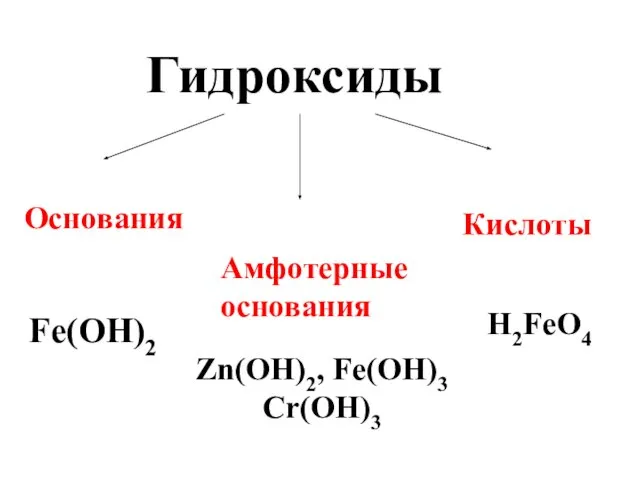
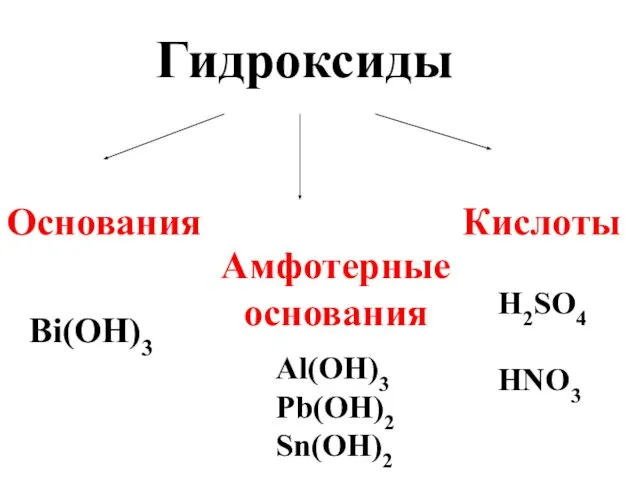
- 68. Гидроксиды Основания Амфотерные основания Кислоты Fe(OH)2 Zn(OH)2, Fe(OH)3 Cr(OH)3 H2FeO4
- 69. Гидриды Большинство d- элементов образуют гидриды переменного состава (TiН1,7; TiH0,9), а платиновые металлы образуют с водородом
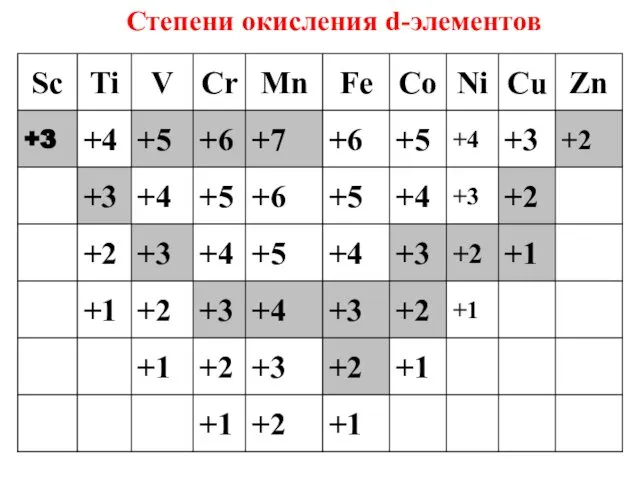
- 70. Для большинства d-элементов характерно многообразие степеней окисления атомов в соединениях.
- 71. Степени окисления d-элементов
- 72. С ростом степени окисления: а) увеличивается кислотность оксидов и гидроксидов, б) возрастают окислительные свойства атомов и
- 73. d-Элементы являются лучшими комплексообразователя-ми, так как для них характерны маленькие ионные радиусы и сравнительно высокие степени
- 74. Самыми сильными комплексообразовате-лями являются элементы триад. Это обусловлено эффектом d– cжатия.
- 75. В биосистемах d-элементы присутствуют только в форме комплексных соединений с биолигандами.
- 76. К биогенным элементам d-блока относятся Fe, Co, Mo, Cu, Zn, Mn. Они являются микроэлементами, выполняющими в
- 77. 14.4 К p-блоку относятся элементы с общей формулой ns2npx, где x = 1-6
- 78. Они расположены в III A – VIII A группах. Халькогены (VI A группа), Галогены (VII A
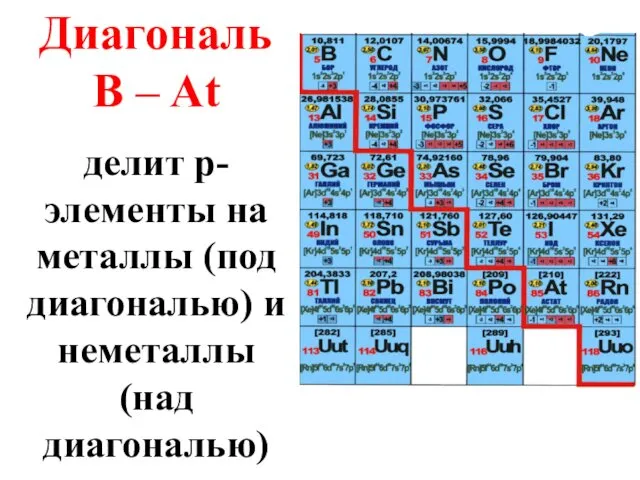
- 79. Диагональ B – At делит p-элементы на металлы (под диагональю) и неметаллы (над диагональю)
- 80. В подгруппах сверху вниз металлические свойства p-элементов усиливаются, а неметаллические ослабевают.
- 81. Об этом свидетельствует уменьшение энергии ионизации, сродства к электрону и электроотрицательнос-ти.
- 82. В периодах слева направо усиливают-ся неметаллические свойства и ослабевают металлические.
- 83. Наиболее активными неметаллами являются галогены и халькогены.
- 84. К важнейшим соединениям p-элементов относятся: оксиды основные кислотные амфотерные Bi2O3 SnO, PbO Al2O3 SO3 Cl2O7
- 85. Кроме того, неметаллы p-блока образуют несолеобразующие оксиды, имеющие высокую физиологическую активность N2O, NO, CO, SiO.
- 86. Гидроксиды Основания Амфотерные основания Кислоты Bi(OH)3 Al(OH)3 Pb(OH)2 Sn(OH)2 H2SO4 HNO3
- 87. C увеличением металличности атомов усиливается основность оксидов и гидроксидов, а с увеличением неметалличности - возрастает кислотность
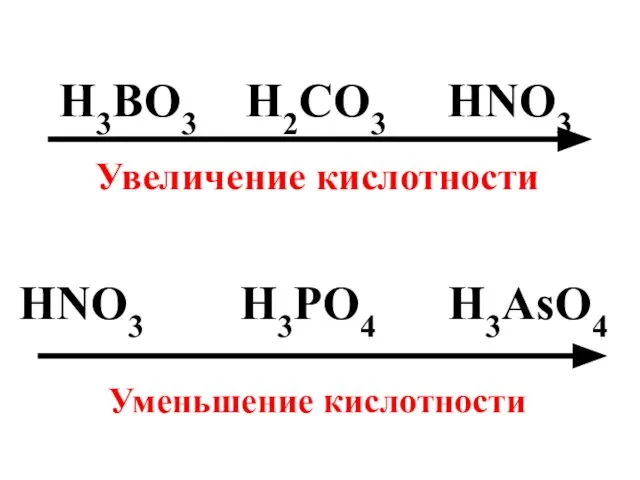
- 88. H3BO3 H2CO3 HNO3 Увеличение кислотности HNO3 H3PO4 H3AsO4 Уменьшение кислотности
- 89. Подобно d-элементам, p-элементы характеризуются многообразием степеней окисления атомов в их соединениях.
- 90. С увеличением степени окисления атомов возрастает кислотность оксидов и гидроксидов элементов p-блока: HClO HClO2 HClO3 HClO4
- 91. Гидриды p-металлов (AlH3)x, SnH2 – это твердые кристаллические вещества, разлагаемые водой и кислотами.
- 92. Водородные соединения p-неметаллов – газы, растворяющиеся в воде с образованием: a)бескислородных кислот (HCl, H2S и др.),
- 93. Кроме того, элементы IV A- группы углерод и кремний образуют водородные соединения CH4 и SiH4 не
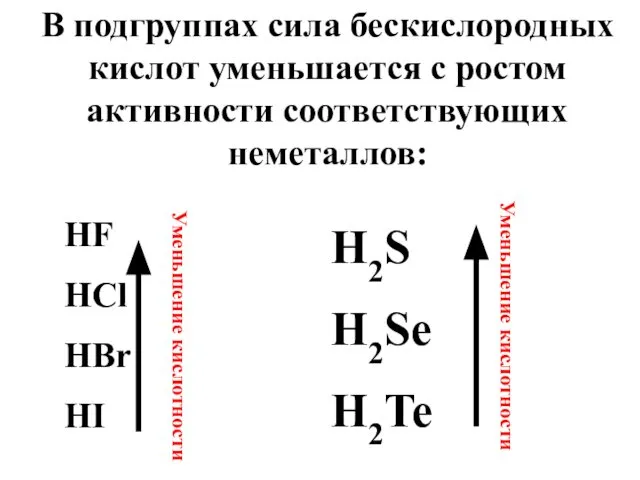
- 94. В подгруппах сила бескислородных кислот уменьшается с ростом активности соответствующих неметаллов: HF HCl HBr HI H2S
- 95. Важнейшими биогенными элементами p-блока являются неметаллы-органогены С, O, N, P, S. Они, а также Cl, содержатся
- 97. Скачать презентацию




















































































 Насекомые Смоленской области Автор: Коляда Елена Владимировна учитель начальных классов МБОУ ЯСОШ№4 Г.Ярцево
Насекомые Смоленской области Автор: Коляда Елена Владимировна учитель начальных классов МБОУ ЯСОШ№4 Г.Ярцево  Строение и функции семян
Строение и функции семян Методологические основы физиологии
Методологические основы физиологии Презентация на тему "Деление клеток. Митоз" - скачать презентации по Биологии
Презентация на тему "Деление клеток. Митоз" - скачать презентации по Биологии Презентация на тему "Влияние шоколада на организм человека" - скачать презентации по Биологии
Презентация на тему "Влияние шоколада на организм человека" - скачать презентации по Биологии Тема: Спинной, продолговатый мозг. Варолиев мост. Тема: Спинной, продолговатый мозг. Варолиев мост. План: 1. Роль спинного мозга в п
Тема: Спинной, продолговатый мозг. Варолиев мост. Тема: Спинной, продолговатый мозг. Варолиев мост. План: 1. Роль спинного мозга в п Евгеника
Евгеника Тип кольчатые черви. (Часть 1)
Тип кольчатые черви. (Часть 1) Опорно-двигательный аппарат
Опорно-двигательный аппарат Фазан звичайний Підготувала: Учениця 8 класу Сірчишин А.
Фазан звичайний Підготувала: Учениця 8 класу Сірчишин А. Зимующие птицы
Зимующие птицы Плоды. Классификация плодов
Плоды. Классификация плодов Речной угорь
Речной угорь Свойства живого
Свойства живого Растения Бахчисарайского района
Растения Бахчисарайского района Презентация на тему Воздушная одежда Земли. (5 класс)
Презентация на тему Воздушная одежда Земли. (5 класс) Пресмыкающиеся, особенности строения, многообразие
Пресмыкающиеся, особенности строения, многообразие Движение крови по сосудам. (8 класс)
Движение крови по сосудам. (8 класс) Физиология Дыхательной Системы Лаборатория полисистемных исследований
Физиология Дыхательной Системы Лаборатория полисистемных исследований Селекция животных “Борька” – гибрид домашней козы и сибирского козерога.
Селекция животных “Борька” – гибрид домашней козы и сибирского козерога. Общая характеристика рефлекторной деятельности
Общая характеристика рефлекторной деятельности Грибы. Какие они?
Грибы. Какие они? Грегор Ян Мендель - отец генетики
Грегор Ян Мендель - отец генетики Топырақ түсінігі
Топырақ түсінігі Зелёная аптека
Зелёная аптека Основы экологии. Приспособление организмов к среде обитания
Основы экологии. Приспособление организмов к среде обитания Презентация по биологии Отряд перепончатокрылые
Презентация по биологии Отряд перепончатокрылые  Эукариотическая клетка. Цитоплазма. Органоиды.
Эукариотическая клетка. Цитоплазма. Органоиды.