Содержание
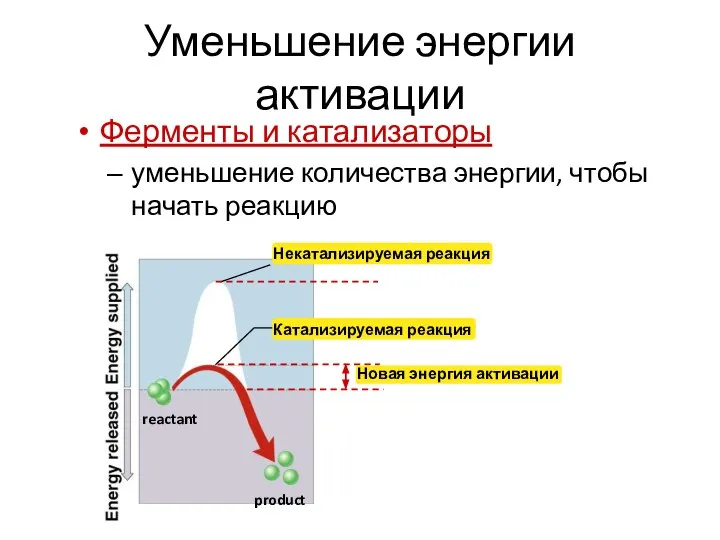
- 2. Уменьшение энергии активации Ферменты и катализаторы уменьшение количества энергии, чтобы начать реакцию reactant product Некатализируемая реакция
- 3. Примеры конкретных ферментов Липазы - это группа ферментов, которые помогают переваривать жиры в кишечнике. Амилаза -
- 4. Свойства ферментов Специфичность Каждый фермент действует на определенный субстрат H связи и ионный связи Не вступает
- 6. Тема урока Конкурентное и неконкурентное ингибирование ферментов. Регуляция активности ферментов. Цели обучения 11.4.1.3 сравнивать конкурентное и
- 7. Ингибитор Чтобы обеспечить правильную работу систем организма, иногда необходимо замедлить работу ферментов. Например, если энзим производит
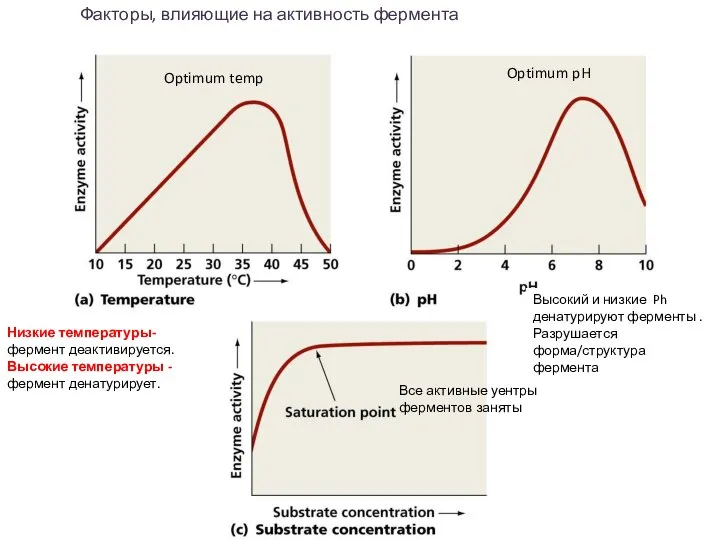
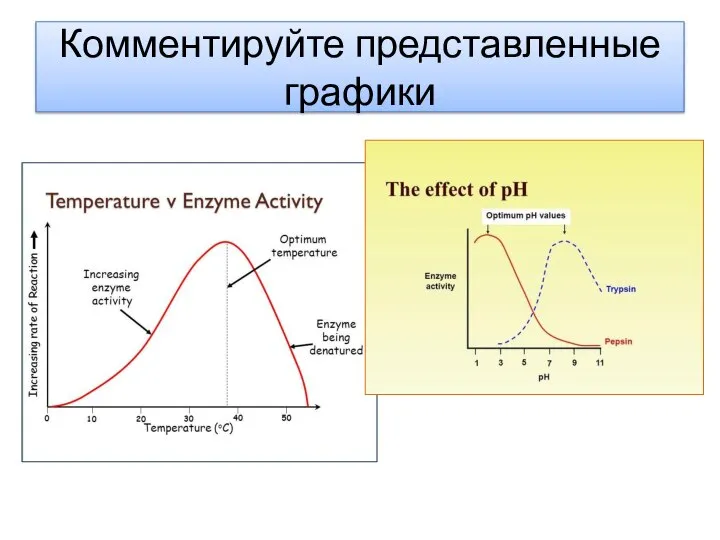
- 8. Факторы, влияющие на активность фермента Высокий и низкие Ph денатурируют ферменты . Разрушается форма/структура фермента Низкие
- 9. https://www.youtube.com/watch?v=99Xlu3pTQ0s – 2 min https://yandex.kz/video/search?text=compare+competitive+and+non-competitive+inhibition+of+enzymes – 1.07 min
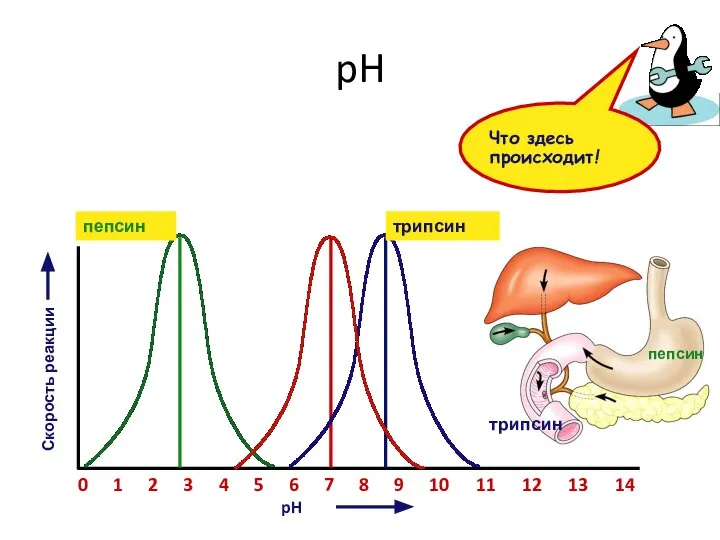
- 10. 7 pH pH Скорость реакции 2 0 1 3 4 5 6 8 9 10 пепсин
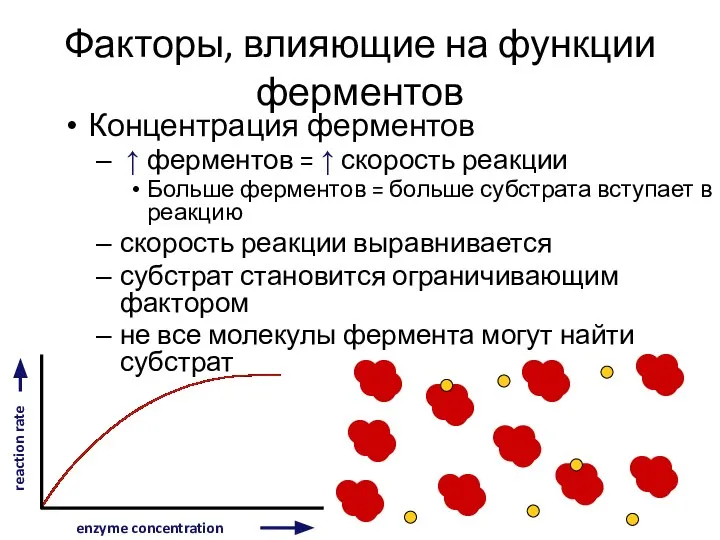
- 11. Факторы, влияющие на функции ферментов Концентрация ферментов ↑ ферментов = ↑ скорость реакции Больше ферментов =
- 12. Комментируйте представленные графики
- 14. Соединения, которые регулируют ферменты Ингибиторы молекулы, которые снижают активность фермента конкурентное ингибирование Неконкурентное ингибирование ингибирование обратной
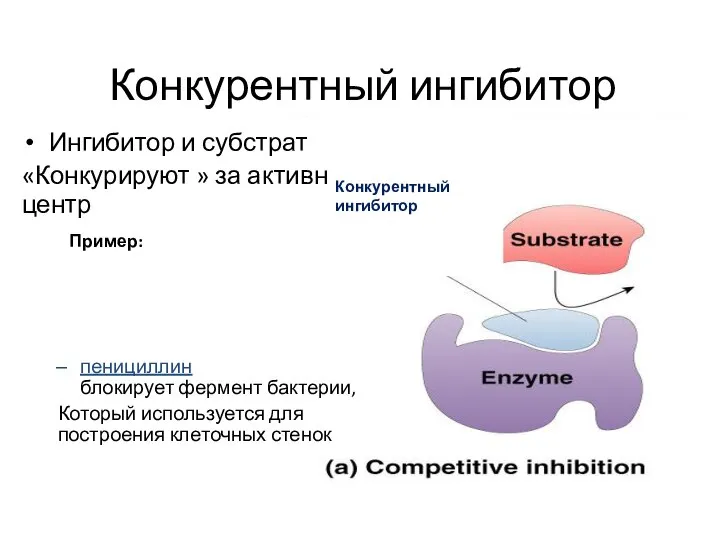
- 15. Конкурентный ингибитор Ингибитор и субстрат «Конкурируют » за активный центр пенициллин блокирует фермент бактерии, Который используется
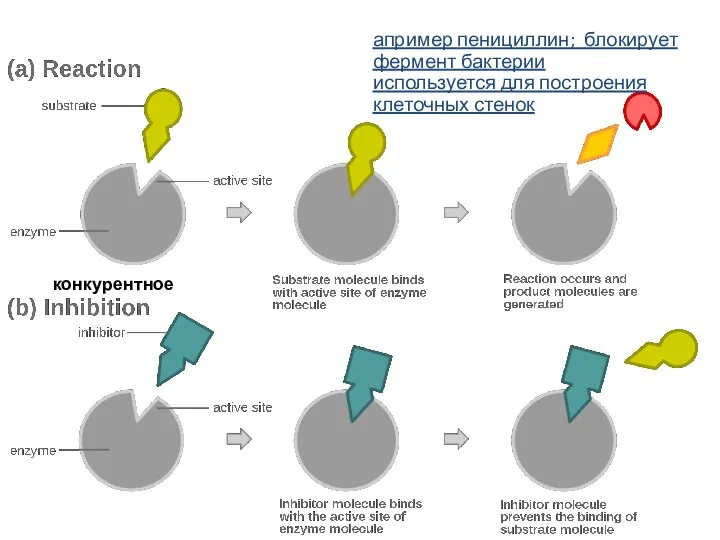
- 16. конкурентное апример пенициллин; блокирует фермент бактерии используется для построения клеточных стенок
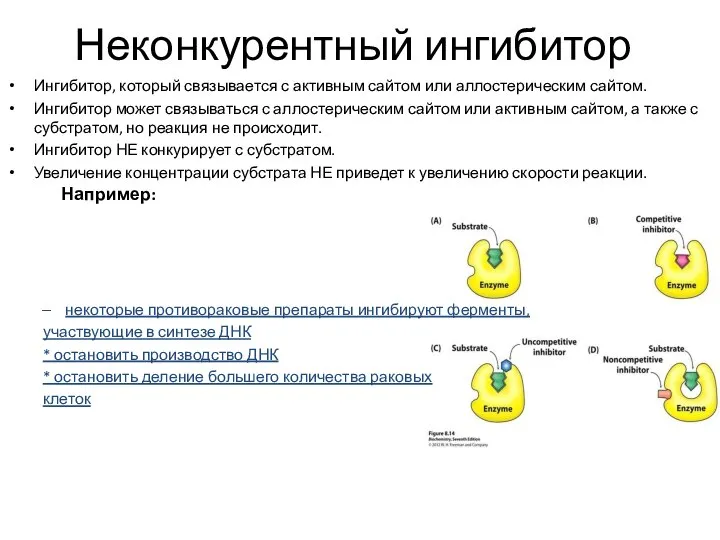
- 17. Неконкурентный ингибитор Ингибитор, который связывается с активным сайтом или аллостерическим сайтом. Ингибитор может связываться с аллостерическим
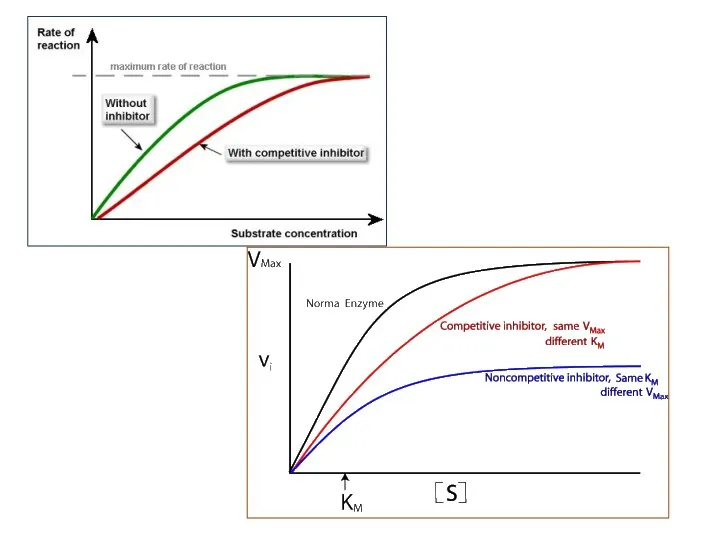
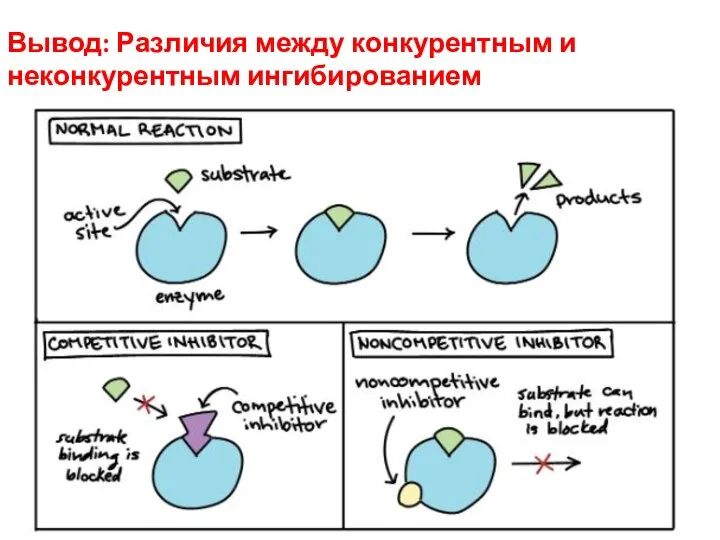
- 18. Вывод: Различия между конкурентным и неконкурентным ингибированием
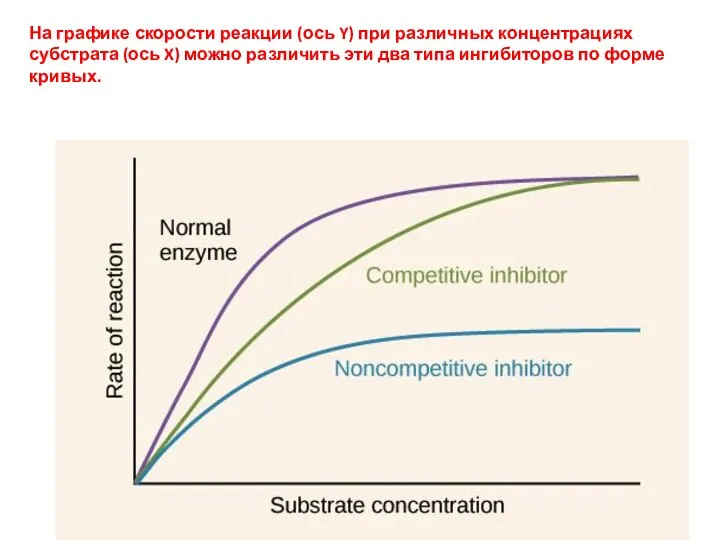
- 19. На графике скорости реакции (ось Y) при различных концентрациях субстрата (ось X) можно различить эти два
- 21. Скачать презентацию







 Презентация на тему "Генная память по принципу нейронных соединений" - скачать презентации по Биологии
Презентация на тему "Генная память по принципу нейронных соединений" - скачать презентации по Биологии Фиброзная оболочка глазного яблока
Фиброзная оболочка глазного яблока Презентация на тему Строение и жизнедеятельность бактерий
Презентация на тему Строение и жизнедеятельность бактерий Ученые – биологи, внесшие большой вклад в развитие современных наук о человеке
Ученые – биологи, внесшие большой вклад в развитие современных наук о человеке  Презентация на тему Развитие представлений о возникновении жизни
Презентация на тему Развитие представлений о возникновении жизни  Презентация по биологии ученицы 6”А” класса Средней школы №13 г. Владивосток Сытник Татьяны и Вайтулевич Ярославы «Водоросли»
Презентация по биологии ученицы 6”А” класса Средней школы №13 г. Владивосток Сытник Татьяны и Вайтулевич Ярославы «Водоросли» Биохимический мониторинг миокардитов у цыплят-бройлеров и алгоритмы разработки схем фармакопрофилактики
Биохимический мониторинг миокардитов у цыплят-бройлеров и алгоритмы разработки схем фармакопрофилактики Презентация на тему Экосистема леса
Презентация на тему Экосистема леса  Презентация на тему "Фруктовые деревья" - скачать бесплатно презентации по Биологии
Презентация на тему "Фруктовые деревья" - скачать бесплатно презентации по Биологии Презентация на тему "Осанка. Предупреждение плоскостопия" - скачать презентации по Биологии
Презентация на тему "Осанка. Предупреждение плоскостопия" - скачать презентации по Биологии Презентация на тему "Хрящевые рыбы" - скачать презентации по Биологии
Презентация на тему "Хрящевые рыбы" - скачать презентации по Биологии Деление клетки
Деление клетки Загрязнение окружающей среды
Загрязнение окружающей среды  Аскариды, лечение аскаридоза у детей Общая информация об аскаридозе. Аскаридоз является одним из широко распространенных г
Аскариды, лечение аскаридоза у детей Общая информация об аскаридозе. Аскаридоз является одним из широко распространенных г Презентация на тему "Большая синица" - скачать презентации по Биологии
Презентация на тему "Большая синица" - скачать презентации по Биологии Класс хрящевые рыбы. Отряды: акулы, скаты, химерообразные
Класс хрящевые рыбы. Отряды: акулы, скаты, химерообразные Шелкопряд
Шелкопряд Жизненный цикл клетки
Жизненный цикл клетки Социальный проект. Молодёжное музейное объединение МКОУ СОШ № 4.
Социальный проект. Молодёжное музейное объединение МКОУ СОШ № 4. Криоконсервация эмбрионов
Криоконсервация эмбрионов Функциональная анатомия. Верхние конечности
Функциональная анатомия. Верхние конечности Биологические мембраны
Биологические мембраны Птица секретарь
Птица секретарь Неклітинні форми життя
Неклітинні форми життя Конкурс знатоков химии и биологии
Конкурс знатоков химии и биологии Ядовитые грибы и ягоды
Ядовитые грибы и ягоды Презентация на тему "Красная книга" - скачать презентации по Биологии
Презентация на тему "Красная книга" - скачать презентации по Биологии Презентация на тему "Энергетический обмен" - скачать презентации по Биологии
Презентация на тему "Энергетический обмен" - скачать презентации по Биологии