Содержание
- 2. Энзимология Основная цель исследований в энзимологии - изучение химических основ биологических процессов живых систем, интеграция химии,
- 3. Ключевое место в развитии современной биомолекулярной химии и технологии занимают ферменты (энзимы) – белковые катализаторы различных
- 4. Структурная биохимия Белки. Первичная, вторичная, третичная и четвертичная структура белков Основой биополимерной цепи, формирующей белки и
- 5. Белки. В соответствии с принципами химической термодинамики процесс протекает самопроизвольно, если свободная энергия ΔGº реакции отрицательно.
- 6. Строение белков. Ферменты –это белки с каталитическими функциями. Ферменты (энзимы)–это глобулярные белки, содержащие как регулярные участки,
- 7. Аминокислоты — структурные компоненты белков. Аминокислоты — структурные компоненты белков. В природе известно более 500 различных
- 8. Аминокислоты — структурные компоненты белков Боковые цепи аминокислот (радикал) могут быть гидрофобными или гидрофильными, У растений
- 9. Аминокислоты Все аминокислоты, за исключением глицина NH2CH2COOH, имеют хиральный (оптически активный) атом в α-положении NH2 –C*H(R)
- 10. Аминокислоты Первичная структура белка записана в молекулах ДНК в виде последовательности тринуклеотидных фрагментов – кодонов. При
- 11. Аминокислоты Лейцин, серин, аргинин имеют 6 кодонов, а триптофан и метионин – один кодон. Наиболее распространенной
- 12. Пептиды. Пептиды. Аминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты. Образующаяся при
- 13. Пептиды. К олигопептидам относятся окситоцин, вазопрессин, тиреотропин, а также брадикинин (пептид боли) и некоторые опиаты («естественные
- 14. Строение белков. Основой белка является полипептидная цепь (первичная структура), в которой аминокислоты связаны ковалентной амидной (пептидной)
- 15. Первичная структура Первичная структура — последовательность аминокислот, ковалентно связанных в полипептидную цепь. Важными особенностями первичной структуры
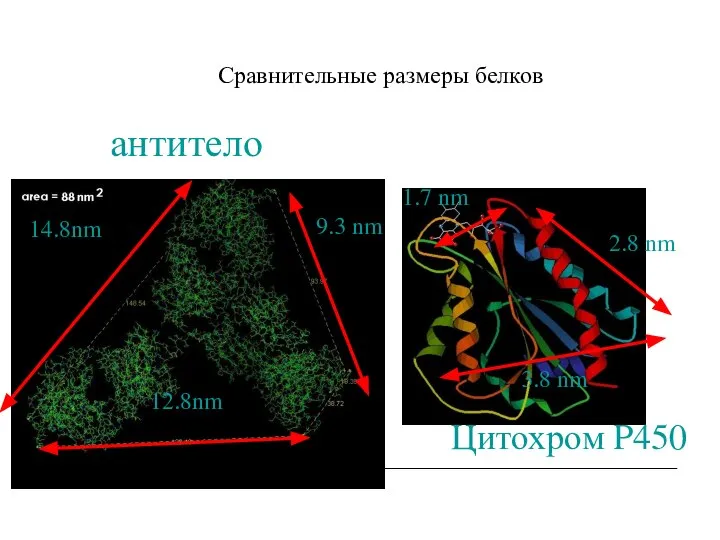
- 16. Сравнительный размер белков. Слева направо: Антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент) 14-12
- 17. Сравнительные размеры белков 14.8nm 12.8nm 9.3 nm 1.7 nm 3.8 nm 2.8 nm антитело Цитохром P450
- 19. Структурная химия белков Базисным положением структурной химии белка является представление о том, что последовательность аминокислот полипептидной
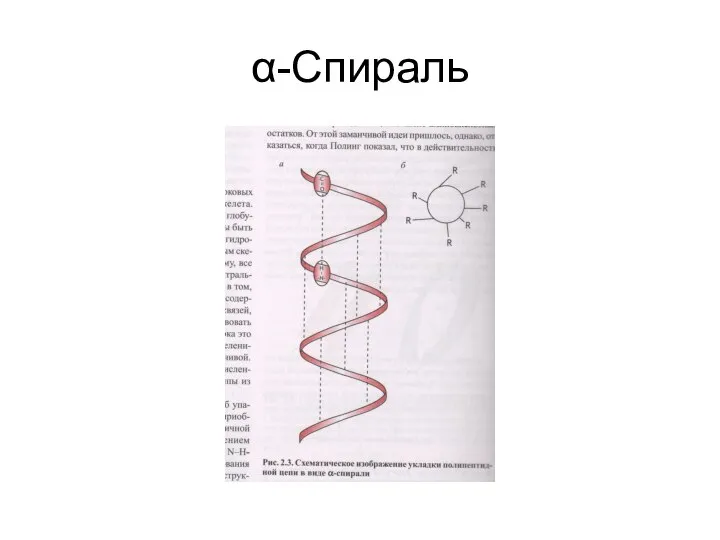
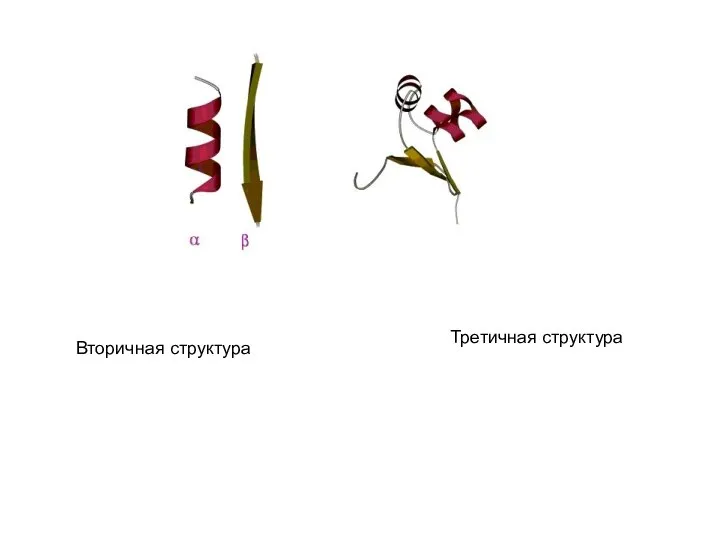
- 20. Вторичная структура белков α- Спирали и -структуры (складки или листы) стабилизированы водородными связями. Водородные связи образуется
- 21. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями
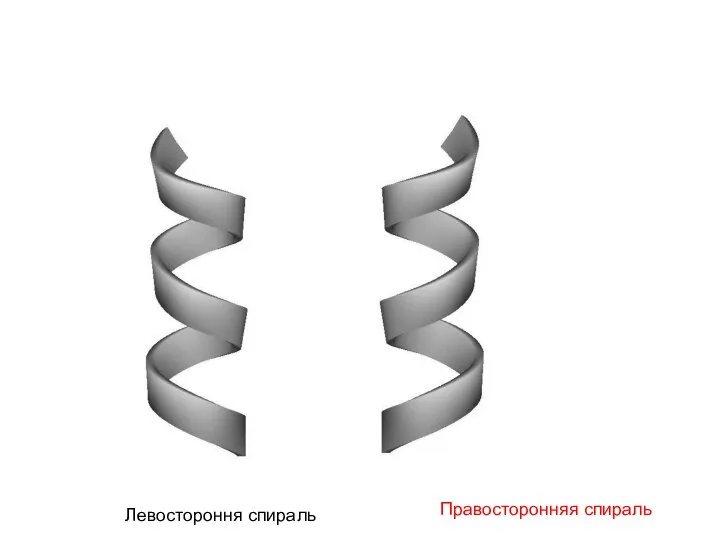
- 22. α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 4 аминокислотных остатка, спираль стабилизирована
- 23. β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными
- 24. α-Спираль
- 25. Левостороння спираль Правосторонняя спираль
- 26. β-листы (складчатые слои)
- 27. Третичная и четвертичная структура белков Третичная структура белка - это расположение его полипептидной цепи в пространстве,
- 28. Четвертичная структура белков К числу олигомерных белков относится гемоглобин (2 идентичные α- и 2 идентичные β-субъединицы),
- 29. Внутри- и межмолекулярные связи в белках (по силе взаимодействий) 1. Ковалентные пептидные связи (первичная структура). 2.
- 30. Третичная и четвертичная структура белков А –третичная Б- четвертичная структура
- 31. Вторичная структура Третичная структура
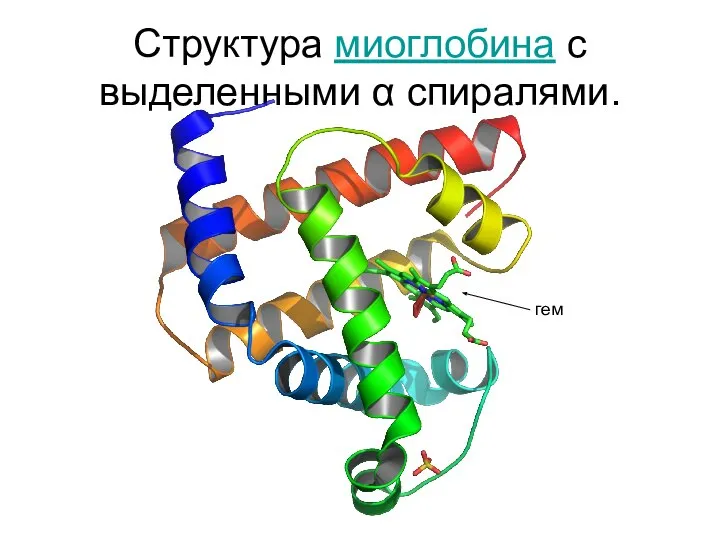
- 33. Структура миоглобина с выделенными α спиралями. гем
- 34. Большинство белков свернуто в глобулы. Такие глобулы устойчивы в водных системах благодаря тому, что их полярные
- 35. Классификация белков по элементному составу По составу белки разделяют на 2 основных класса: Простые белки дают
- 36. Биомедицинская химия, 2011 том 57, вып. 1, с.31-60. ОСНОВНЫЕ ПРИНЦИПЫ КОНФОРМАЦИОННОГО РАЗНООБРАЗИЯ БЕЛКОВ ДЛЯ МЕДИКО-БИОЛОГОВ А.С.
- 37. Методы изучения структуры белков Рентгеноструктурный анализ Спектроскопия ядерного магнитного резонанса. Атомная силовая микроскопия (AFM) Масс-спектрометрия (MS)
- 38. Химическая модификация аминокислот белков Химическая модификация аминокислот белков используется для идентификации функциональных групп активных центров, а
- 39. Модификация белков 1. Модификация белков протонированием. Аминогруппы, карбоксильные группы, SH- группа цистеина, имидазольная группа гистидина, фенольная
- 40. Модификация белков 2. Модификация по аминогруппе. Свободная аминогруппа N-концевой аминокислоты, ε -аминогруппа лизина). Реакции с альдегидами,
- 41. Модификация белков 4. Фенольная группа тирозина. Реакция электрофильного замещения в ароматическом кольце. 5. Имидазольная группа гистидина.
- 42. Модификация белков Бифункциональные сшивающие агенты. (Диальдегиды). Реагируют по аминогруппам.
- 43. Классификация белков по простетическим группам Класс Простетическая группа Нуклеопротеидные системы Рибосомы РНК Вирус табачной мозаики РНК
- 44. Классификация белков по простетическим группам Гемопротеиды Гемоглобин железопротопорфирин Цитохром с Цитохром Р450 Флавопротеиды флавонуклеотиды (FMN, FAD)
- 45. Функциональная биохимия. Каталитические реакции Во многих случаях скорость реакции резко изменяется в присутствии специальных веществ -
- 46. Функциональная биохимия Если катализатор находится в одной фазе с реакционной смесью, то процесс называется гомогенным, в
- 47. Химия каталитического действия ферментов В обычных химических реакциях концентрация реагентов выше, чем в ферментативных реакциях. Однако,
- 48. Ферменты – эффективные катализаторы Раствор фермента в концентрации 10-11 М эквивалентен по реакционной способности 10 М
- 49. Сравнительные значения скоростей реакции гидролиза Реагент катализатор температура,С V (М с-1) мочевина H3O+ 62 7.4 10-7
- 50. Каталитические константы ферментов Каталитическая константа или число оборотов определяется как максимальная скорость ((М с -1), деленная
- 51. Единицы ферментативной активности МЕ (IU) международная единица активности – активность фермента, превращающего 1 мкмоль субстрата в
- 52. Каталитические константы ферментов kcat (с-1) Фермент Субстрат kcat (с-1) Каталаза H2O2 9 ×106 Ацетилхолинэстераза ацетилхолин 1.2
- 53. Классификация белков в соответствии с выполняемыми функциями 1) каталитически активные белки (ферменты), 2) белки –ингибиторы ферментов,
- 54. Классификация белков в соответствии с выполняемыми функциями 7) мембранные белки, 8) сократительные белки, 9) рецепторные белки,
- 55. Классификация ферментов (по механизму действия) Цифровые коды классификации ферментов (КФ или EC – от англ. Enzyme
- 56. Классификация ферментов (по механизму действия) Класс 1. Оксидоредуктазы. Катализируют окислительно-восстановительные реакции. Пример: алкогольдегидрогеназа, каталаза, пероксидаза. Класс
- 57. Классификация ферментов Класс 3. Гидролазы. Катализируют реакции гидролиза. Пример: карбоксиэстераза, пепсин, трипсин, химотрипсин, ацетил-СоА-гидролаза Класс 4.
- 58. Классификация ферментов Класс 6. Лигазы (синтетазы). Катализируют реакции конденсации двух молекул, сопряженные с гидролизом пирофосфатной связи
- 59. Август 2018 г Класс 7. Транслоказы Катализируют перенос гидрона (H+ )
- 60. August 2018 Translocases (EC 7): A new EC Class EC 7.1 contains enzymes catalysing the translocation
- 62. Антитела-катализаторы (каталитически активные антитела, абзимы) Антитела являются белками, синтезируемыми иммунной системой для защиты организма от чужеродных
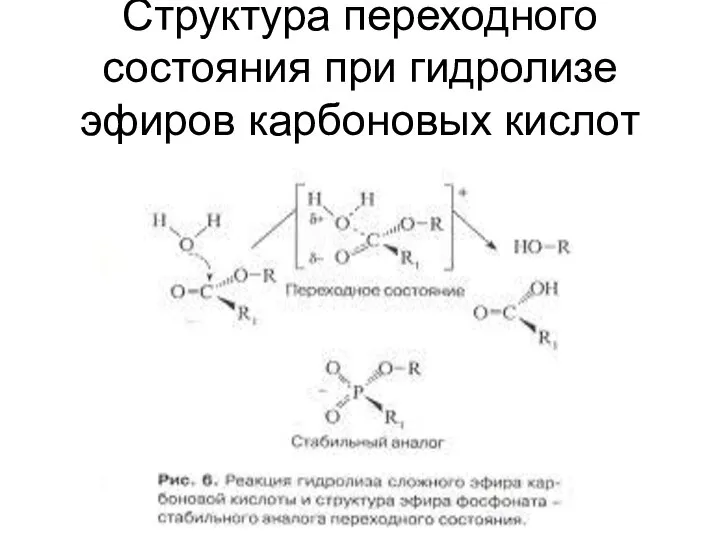
- 63. Антитела-катализаторы (каталитически активные антитела, абзимы) Например, при гидролизе карбоксильных эфиров переходным состоянием является тетраэдр. Эго можно
- 64. Структура переходного состояния при гидролизе эфиров карбоновых кислот
- 65. Переходное состояние гидролиза эфиров карбоновых кислот
- 66. РНК-содержащие ферменты (рибозимы) Рибозимы – каталитически активные молекулы РНК Некоторые ферменты являются комплексами белка и РНК,
- 67. Белок-белковые взаимодействия (интерактомика) При исследовании белок-белковых взаимодействий (взаимодействий различных белков) необходимо выяснить характер взаимодействий. Для этого
- 68. Белок-белковые комплексы Белок-белковые взаимодействия Взаимодействия белковых молекул (белок-белковые взаимодействия) имеют основополагающее значение для ряда важнейших процессов,
- 69. Примером функционально-значимых белок-белковых взаимодействий является взаимодействие белков в системе цитохром Р450 (гемопротеин) НАДН-зависимая редуктаза (флавопротеин) цитохром
- 70. Успехи биологической химии, 49, 2009, с. 429–442, ДИНАМИЧЕСКАЯ ПРОТЕОМИКА В МОДЕЛИРОВАНИИ ЖИВОЙ КЛЕТКИ. БЕЛОК-БЕЛКОВЫЕ ВЗАИМОДЕЙСТВИЯ. А.
- 71. Белок–белковые взаимодействия лежат в основе большинства биологических процессов, и роль их наиболее многообразна у многоклеточных организмов.
- 72. Для исследования природы связей, стабилизирующих белковые комплексы, используют методы исследования структуры белков, а также химические и
- 73. ТЕХНОЛОГИИ БЕЛКОВОЙ ИНТЕРАКТОМИКИ Существующее разнообразие методических подходов, применяемых для изучения ББВ (белок-белковых взаимодействий), обусловлено тем, что
- 74. Примеры белок-белковых взаимодействий БЕЛОК-БЕЛКОВЫЕ ВЗАИМОДЕЙСТВИЯ В КОМПЛЕКСЕ ФЕРМЕНТОВ ФАЗЫ КАРБОКСИЛИРОВАНИЯ, ВЫДЕЛЕННОМ ИЗ ЛИСТЬЕВ Beta vulgaris, образуемых
- 75. Примеры белок-белковых взаимодействий. Прионы Прио́ны (англ. prion от protein — «белок» и infection — «инфекция». Все
- 76. Во второй половине 90-х годов, когда была определена аминокислотная последовательность белка приона РrР и выявлен ген
- 77. К 01 декабря 2020 г. представить рефераты Темы рефератов: Белок-белковые комплексы и их медицинская значимость. Интеактомика.
- 78. Список литературы по энзимологии www.studmedlib.ru В.Элиот, Д.Элиот, Биохимия и молекулярная биология. НИИ Биомедхимии, М. 2000. Т.
- 80. Скачать презентацию







































































 Древесных ассортимент СНГ. Хвойные и лиственные деревьи
Древесных ассортимент СНГ. Хвойные и лиственные деревьи Образование половых клеток. МЕЙОЗ Презентация учителя МОУ «СОШ № 4 г. Ртищево Саратовской области» Калюгиной Н.В.
Образование половых клеток. МЕЙОЗ Презентация учителя МОУ «СОШ № 4 г. Ртищево Саратовской области» Калюгиной Н.В. Класс Рыбы
Класс Рыбы Открытый урок по биологии Размножение и развитие лягушки. Учитель: Шиляева Вера Анатольевна
Открытый урок по биологии Размножение и развитие лягушки. Учитель: Шиляева Вера Анатольевна Сообщества. Экосистемы
Сообщества. Экосистемы Биоритмы человека
Биоритмы человека Общий обзор дыхательной системы
Общий обзор дыхательной системы Применение коллагена и его производные
Применение коллагена и его производные Презентация на тему Скелет человека
Презентация на тему Скелет человека  Как живые организмы переносят неблагоприятные для жизни условия.
Как живые организмы переносят неблагоприятные для жизни условия. Законы Менделя. (Занятие 3)
Законы Менделя. (Занятие 3) Паразитические черви
Паразитические черви  Презентация на тему "БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ И КЛАССИФИКАЦИЯ СОРНЫХ РАСТЕНИЙ" - скачать презентации по Биологии
Презентация на тему "БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ И КЛАССИФИКАЦИЯ СОРНЫХ РАСТЕНИЙ" - скачать презентации по Биологии Зоогенные факторы
Зоогенные факторы Презентация на тему Обмен веществ и энергии Метаболизм
Презентация на тему Обмен веществ и энергии Метаболизм Эндокринная система человека. Гормоны
Эндокринная система человека. Гормоны Подцарство Простейшие (Protozoa) 7 класс 9 урок Зоология
Подцарство Простейшие (Protozoa) 7 класс 9 урок Зоология  Начало… Корни биологических знаний уходят в глубокую древность. Судя по наскальным рисункам, уже 30 тысяч лет назад люди, вероятно, пытались постичь закономерности окружающей их действительности.
Начало… Корни биологических знаний уходят в глубокую древность. Судя по наскальным рисункам, уже 30 тысяч лет назад люди, вероятно, пытались постичь закономерности окружающей их действительности.  Земноводные и пресмыкающиеся Спасского района Нижегородской области
Земноводные и пресмыкающиеся Спасского района Нижегородской области Презентация на тему Мейоз
Презентация на тему Мейоз  Презентация на тему "Как возникла Земля" - скачать презентации по Биологии
Презентация на тему "Как возникла Земля" - скачать презентации по Биологии Женьшень. Полезное растение
Женьшень. Полезное растение Класс Двудольные растения. Семейства Крестоцветные и Розоцветные
Класс Двудольные растения. Семейства Крестоцветные и Розоцветные Строение и функции клетки
Строение и функции клетки Космическая биология и медицина Кондаков Сергей
Космическая биология и медицина Кондаков Сергей Задания по теме Эмбриогенез 1 и 2 часть
Задания по теме Эмбриогенез 1 и 2 часть Развитие представлений о происхождении жизни на Земле. Гипотеза Опарина-Холдейна
Развитие представлений о происхождении жизни на Земле. Гипотеза Опарина-Холдейна Лист. Внешнее строение листа
Лист. Внешнее строение листа