Содержание
- 2. Краткий план лекции 1. Классификация ЛВ. Общая характеристика фармакопейного анализа ЛВ. Реактивы, используемые в фармакопейном анализе.
- 3. Классификация ЛВ 1. Неорганические вещества (производные s-, p- и d-элементов). 2. Органические вещества 2.1. Алифатические соединения
- 4. Классификация ЛВ (продолжение) 2.3. Гетероциклические соединения 2.3.1. Соединения, содержащие один гетероатом (производные фурана, бензофурана, пиридина, хинолина,
- 5. Фармацевтический анализ (анализ ЛВ и ЛС) Фармацевтический анализ – это раздел науки о химической характеристике и
- 6. Фармацевтический анализ (классификации) В зависимости от поставленных задач: 1. Фармакопейный анализ 2. Постадийный контроль производства ЛВ
- 7. Критерии фармацевтического анализа 1. Избирательность (специфичность, селективность) – способность однозначно оценивать определяемый компонент выбранным методом независимо
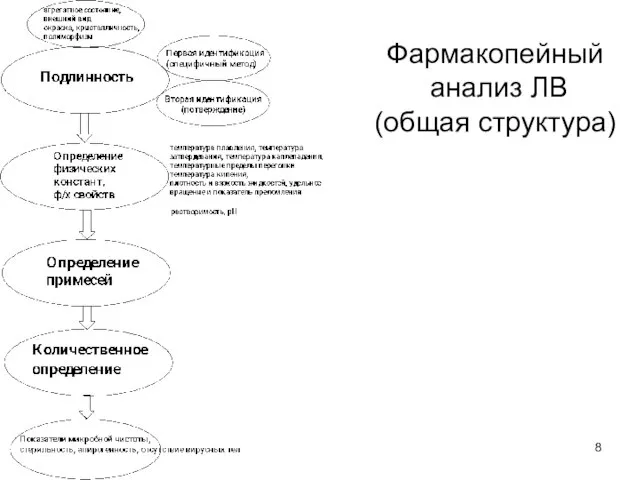
- 8. Фармакопейный анализ ЛВ (общая структура)
- 9. Химическое название Используется номенклатура IUPAC (International Union Pure Applied Chemistry) – Международный союз чистой и прикладной
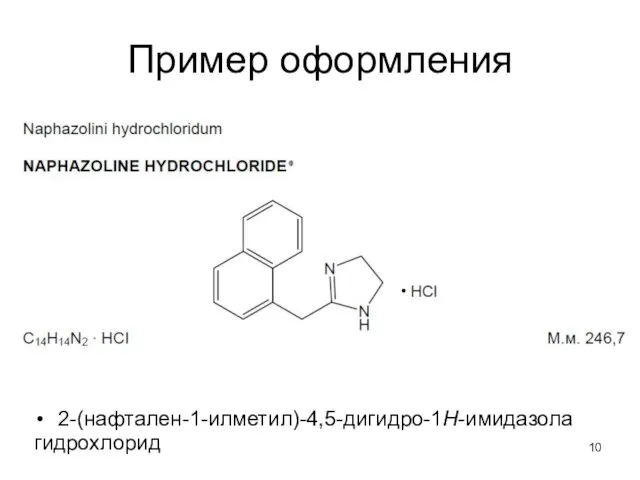
- 10. Пример оформления 2-(нафтален-1-илметил)-4,5-дигидро-1Н-имидазола гидрохлорид
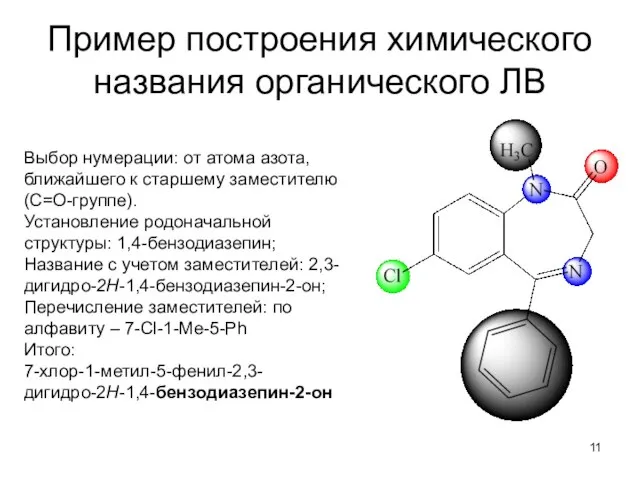
- 11. Пример построения химического названия органического ЛВ Выбор нумерации: от атома азота, ближайшего к старшему заместителю (С=О-группе).
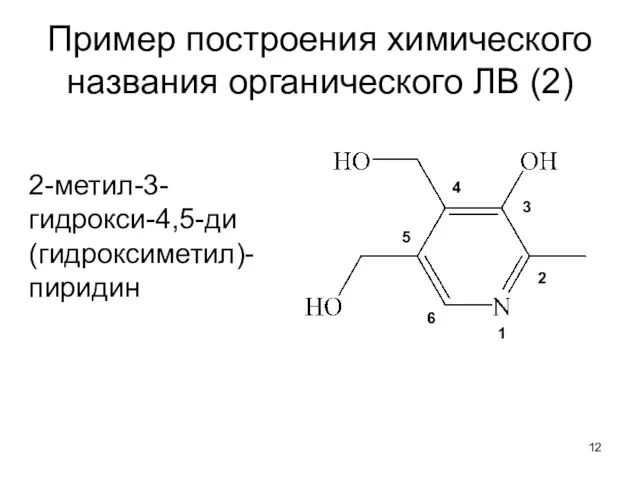
- 12. Пример построения химического названия органического ЛВ (2) 2-метил-3-гидрокси-4,5-ди (гидроксиметил)-пиридин
- 13. Описание ЛВ 1. Агрегатное состояние (жидкость, газ, твердое вещество, кристалличность), цвет, запах, особые свойства (гигроскопичность, легкая
- 14. Описание ЛВ - полиморфизм Полиморфные формы проявляют одинаковые химические свойства в растворах и расплавах, но в
- 15. Полиморфизм (примеры) Аллотропные формы углерода: a) лонсдейлит; б) алмаз; в) графит; г) аморфный углерод; д) C60
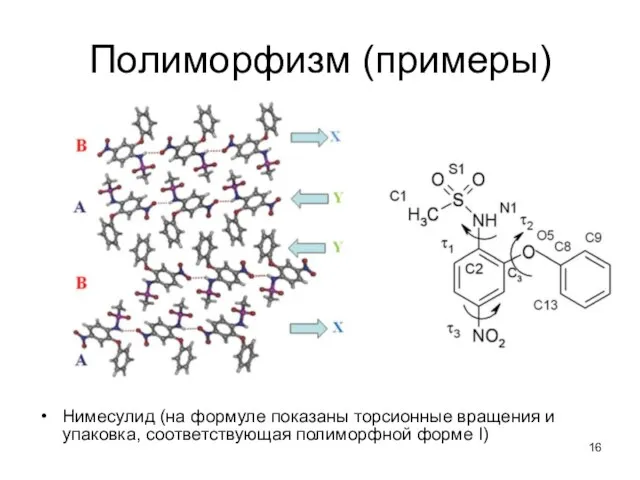
- 16. Полиморфизм (примеры) Нимесулид (на формуле показаны торсионные вращения и упаковка, соответствующая полиморфной форме I)
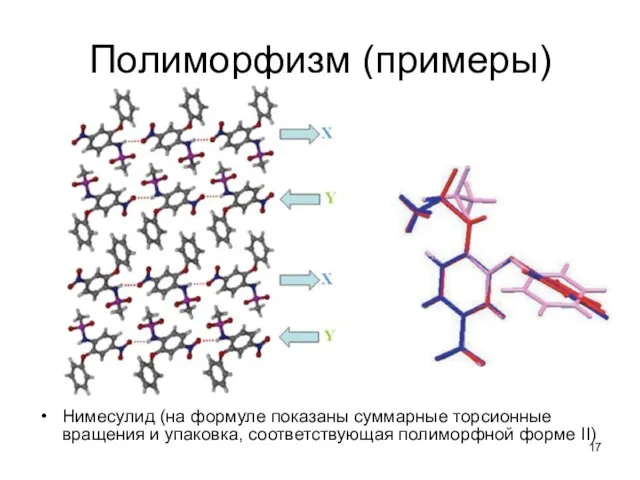
- 17. Полиморфизм (примеры) Нимесулид (на формуле показаны суммарные торсионные вращения и упаковка, соответствующая полиморфной форме II)
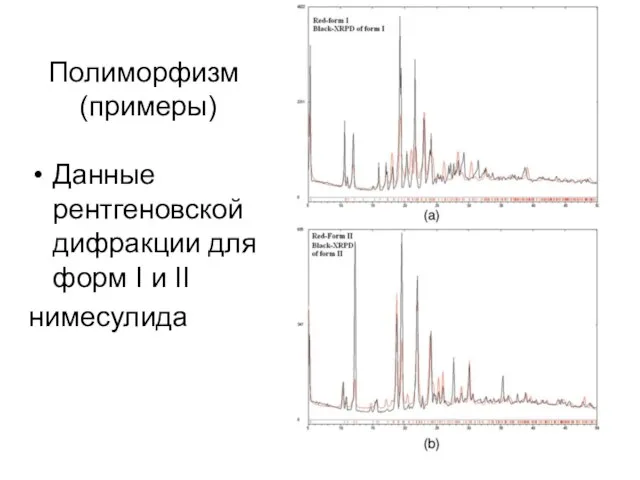
- 18. Полиморфизм (примеры) Данные рентгеновской дифракции для форм I и II нимесулида
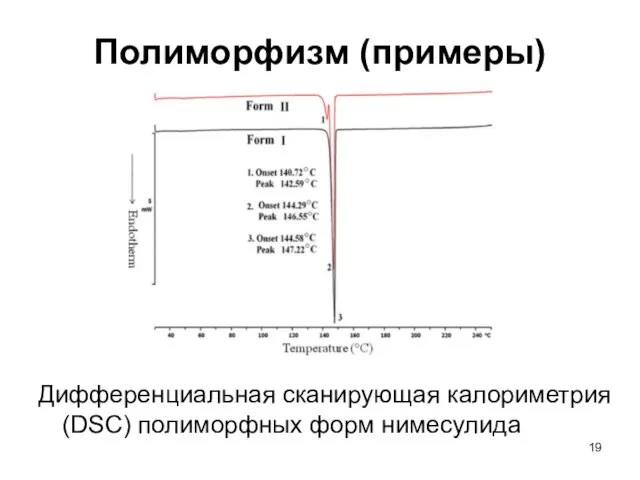
- 19. Полиморфизм (примеры) Дифференциальная сканирующая калориметрия (DSC) полиморфных форм нимесулида
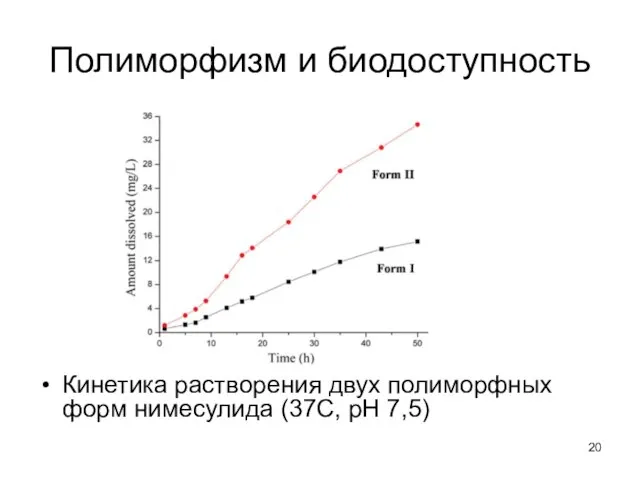
- 20. Полиморфизм и биодоступность Кинетика растворения двух полиморфных форм нимесулида (37С, рН 7,5)
- 21. Методы исследования полиморфных форм 1. Рентгеновская дифракция (порошок и кристаллы) 2. Дифференциальная сканирующая калориметрия, микрокалориметрия 3.
- 22. Размер частиц (порошки, пеллеты) Для определения размера частиц использую наборы сит с квадратными отверстиями, изготовленные из
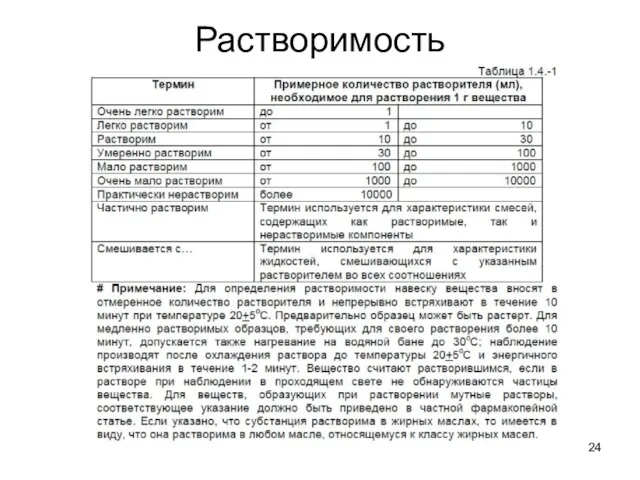
- 23. Растворимость Данные о растворимости вещества означают приблизительную растворимость при температуре 20°С, если нет других указаний. Выражение
- 24. Растворимость
- 25. Кислотно-основные свойства Не приводятся в нормативных документах по контролю качества ЛВ, но имеют решающее значение при
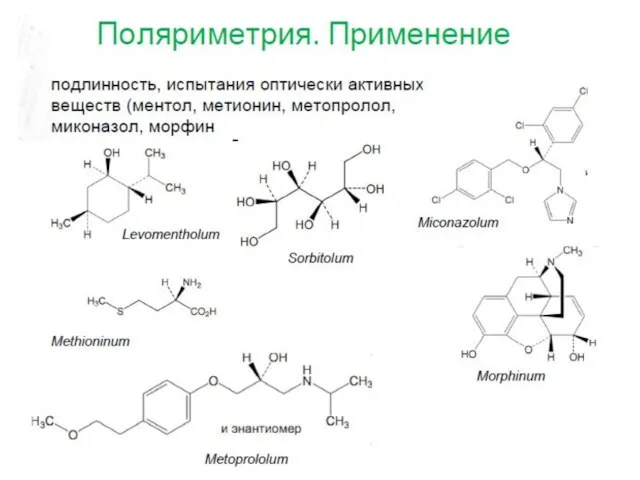
- 26. Методы определения физических констант 1. Гравиметрия 2. Рефрактометрия 3. Поляриметрия 4. Вискозиметрия (капиллярная, ротационная) 5. Термометрия
- 27. Относительная плотность (d20) Относительная плотность d представляет собой отношение массы определенного объема вещества к массе равного
- 28. Относительная плотность
- 30. Показатель преломления
- 31. Рефрактометры
- 33. Оптическое вращение
- 34. Оптическое вращение
- 36. Поляриметрия (оборудование)
- 37. Вязкость Вязкость (внутреннее трение) – свойство текучих тел оказывать сопротивление передвижению одной их части относительно другой.
- 38. Вязкость (капиллярный метод) Методика. Испытуемую жидкость, имеющую температуру 20оС, если в частной статье не обозначена другая
- 39. Температурные пределы перегонки
- 40. Температура плавления 1. Капиллярный метод определения температуры плавления. Температура плавления, определенная капиллярным методом, представляет собой температуру,
- 41. Определение температуры плавления (инструментальное) Видео процесса плавления Цветное видео высокого разрешения позволяет изучать вещества, которые плавятся
- 42. Подлинность (методы) 1. Химические реакции подлинности: А. Общие реакции на подлинность по функциональным группам (первичные ароматические
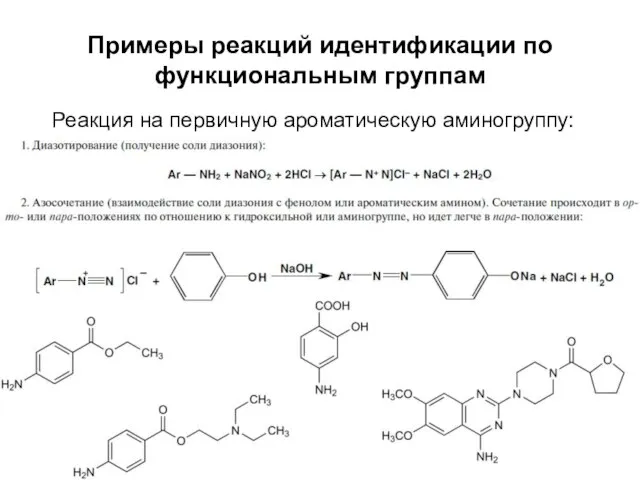
- 43. Примеры реакций идентификации по функциональным группам Реакция на первичную ароматическую аминогруппу:
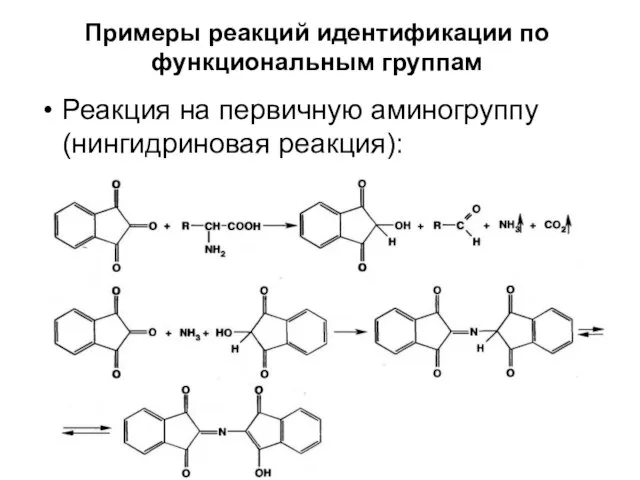
- 44. Примеры реакций идентификации по функциональным группам Реакция на первичную аминогруппу (нингидриновая реакция):
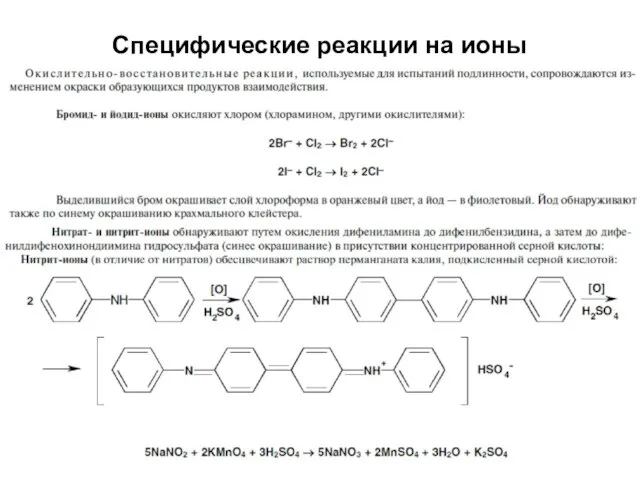
- 45. Специфические реакции на ионы
- 46. Специфические реакции на ионы
- 47. Специфические реакции на ионы Специфические реакции на ионы подразделяются: 1. Реакции осаждения 2. ОВ реакции 3.
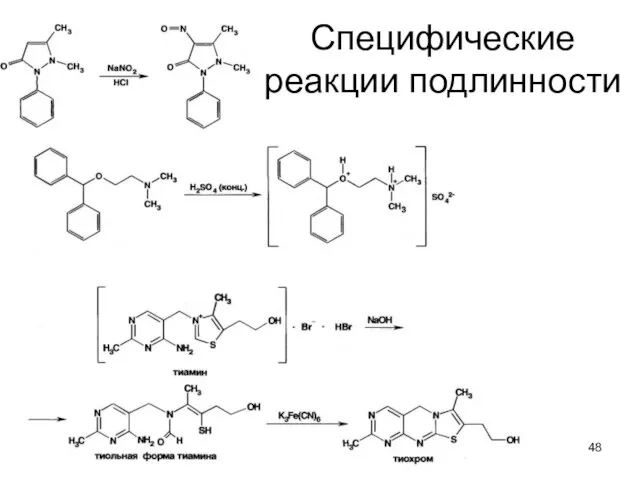
- 48. Специфические реакции подлинности
- 57. Подлинность (методы) 2. Инструментальные методы 2.1. ИК-спектроскопия (ИК-Фурье) 2.2. Абсорционная спектрофотометрия в УФ и/или видимой области
- 58. Подлинность (методы) 3. Физические методы (определение физических констант): 3.1. Температура плавления, кипения, температурные пределы перегонки. 3.2.
- 59. Подлинность (доказательство) Установление подлинности ЛВ проводится как минимум 2 методами! Первая идентификация – специфичный инструментальный метод
- 60. Примеси (классификация) 1. Общие технологические примеси – попадающие в процессе производства. 1.1. Реагентные примеси (SO42-,Cl-, сульфатная
- 61. Примеси 1. Летучие (характеризуются потерей в массе при высушивании). 2. Неорганические (устанавливаются при определении сульфатной золы,
- 62. Потеря в массе при высушивании (метод гравиметрии) Является суммарным неспецифичным показателем, характеризующим наличие воды (влаги), остаточных
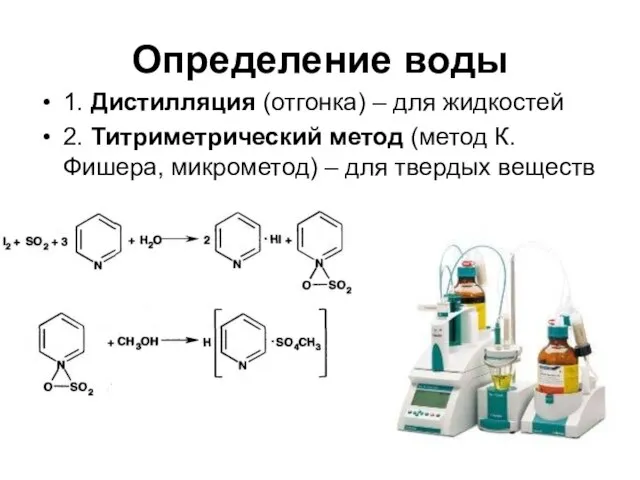
- 63. Определение воды 1. Дистилляция (отгонка) – для жидкостей 2. Титриметрический метод (метод К. Фишера, микрометод) –
- 64. Физические и химические свойства, характеризующие чистоту Прозрачность и степень мутности. Прозрачные растворы – при освещении их
- 65. Определение золы Метод гравиметрии 1. Общая зола (ЛРС, ряд органических ЛВ) – сжигание навески (1.0000 г)
- 66. Определение «тяжелых» металлов А. Стадия пробоподготовки: 1. Растворение в воде (для ЛВ, хорошо растворимых в воде)
- 67. Остаточные органические растворители (классификация) В основе классификации лежит потенциальная опасность растворителей для организма человека и окружающей
- 68. Остаточные органические растворители (классификация, продолжение) Класс 3. Малотоксичные растворители (с низким потенциалом токсичности у человека, не
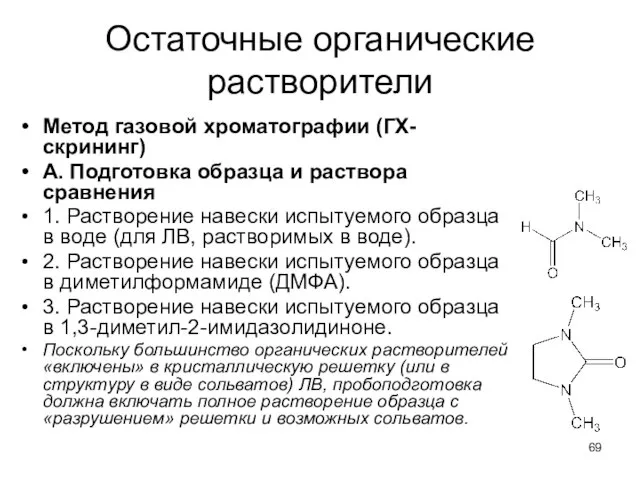
- 69. Остаточные органические растворители Метод газовой хроматографии (ГХ-скрининг) А. Подготовка образца и раствора сравнения 1. Растворение навески
- 70. Остаточные органические растворители (анализ) Б. Парофазовая пробоподготовка – проводится для перевода ООР из раствора в парогазовую
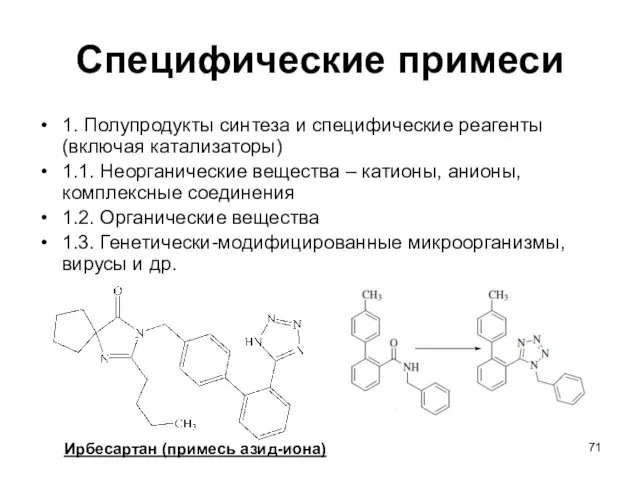
- 71. Специфические примеси 1. Полупродукты синтеза и специфические реагенты (включая катализаторы) 1.1. Неорганические вещества – катионы, анионы,
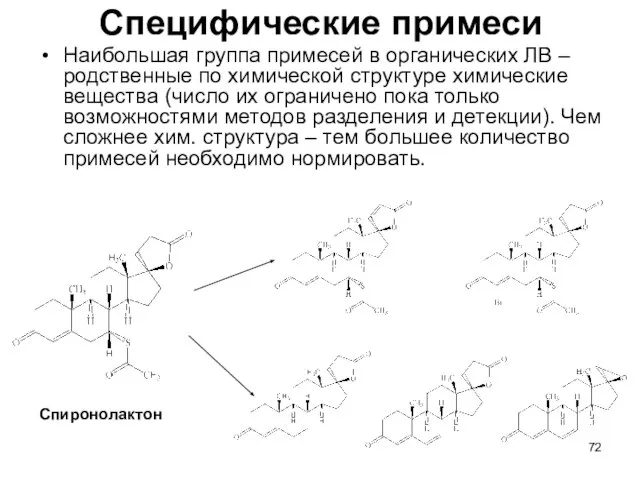
- 72. Специфические примеси Наибольшая группа примесей в органических ЛВ – родственные по химической структуре химические вещества (число
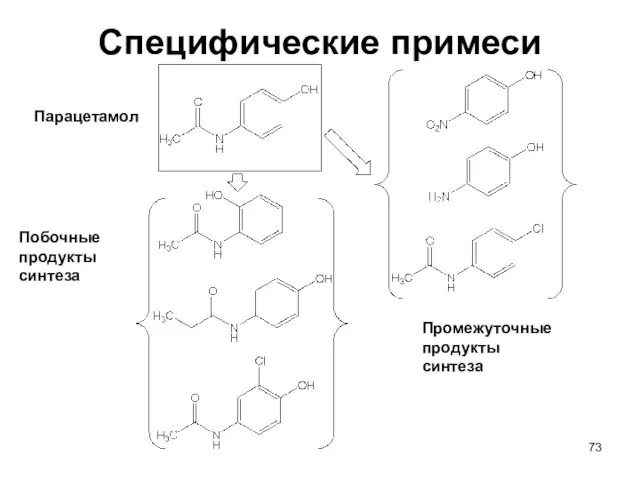
- 73. Специфические примеси Промежуточные продукты синтеза Побочные продукты синтеза Парацетамол
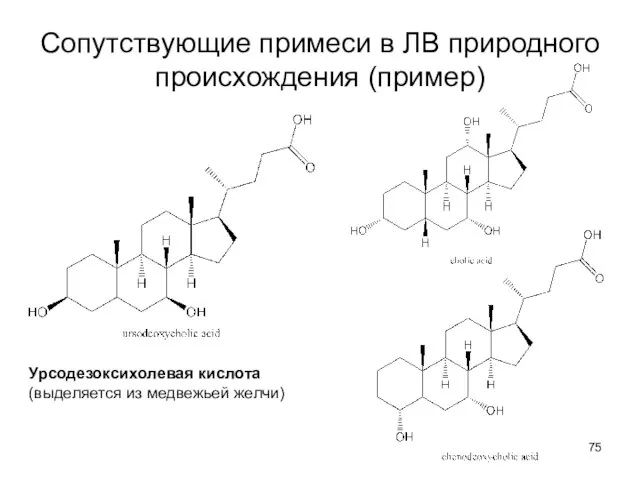
- 74. Специфические примеси Сопутствующие примеси в ЛВ природного происхождения: А. химически родственные аналоги (обладают биологической (фармакологической) активностью,
- 75. Сопутствующие примеси в ЛВ природного происхождения (пример) Урсодезоксихолевая кислота (выделяется из медвежьей желчи)
- 76. Специфические примеси Продукты разложения и взаимодействия: 1. с технологическими примесями (тяжелыми металлами (d-элементы являются катализаторами многих
- 77. Стрессовые испытания - Испытания устойчивости ЛВ под воздействием ряда факторов (температура, реагенты, освещение) с целью доказательства
- 78. Стрессовые испытания (условия) 1. Температура – последовательное повышение температуры при хранении образца ЛВ на 10оС (50,
- 80. Скачать презентацию
























































 БИОНИКА Биология – техника Францева Татьяна Владимировна, учитель биологии МБУСОШ № 48 г. Нижнеудинска
БИОНИКА Биология – техника Францева Татьяна Владимировна, учитель биологии МБУСОШ № 48 г. Нижнеудинска Хищные растения
Хищные растения Обмен веществ и энергии
Обмен веществ и энергии Презентация Дробление
Презентация Дробление Способы размножение растений. Размножение споровых растений
Способы размножение растений. Размножение споровых растений Гаструляция. способы гаструляции
Гаструляция. способы гаструляции Жужелица полевая
Жужелица полевая Рост усоногих раков на поверхности раковины мидий
Рост усоногих раков на поверхности раковины мидий Распространение плодов и семян.
Распространение плодов и семян.  Любимое домашнее животное (2 класс)
Любимое домашнее животное (2 класс) Жизненные циклы растений
Жизненные циклы растений Цветочно-декоративные растения и способы их использования для озеленения территории
Цветочно-декоративные растения и способы их использования для озеленения территории Зоологическая викторина
Зоологическая викторина Отдел magnoliophyta (anthophyta) – цветковые или покрытосеменные растения
Отдел magnoliophyta (anthophyta) – цветковые или покрытосеменные растения Презентация на тему "Туберкулез" - скачать бесплатно презентации по Биологии
Презентация на тему "Туберкулез" - скачать бесплатно презентации по Биологии Две основные теории специфичности ферментов
Две основные теории специфичности ферментов Рысь. Виды рысей
Рысь. Виды рысей Красная книга России: рыбы, земноводные пресмыкающиеся
Красная книга России: рыбы, земноводные пресмыкающиеся Самые длинные сухопутные животные Самые крупные обитатели морей и океанов являлись одновременно и самыми длинными водными жи
Самые длинные сухопутные животные Самые крупные обитатели морей и океанов являлись одновременно и самыми длинными водными жи Вода – колыбель жизни. Жизнь на земле зародилась в воде
Вода – колыбель жизни. Жизнь на земле зародилась в воде Репликация. Синтез ДНК по матрице ДНК
Репликация. Синтез ДНК по матрице ДНК Птицы леса НСО
Птицы леса НСО Генетические аспекты постэмбрионального развития. (Лекция 11)
Генетические аспекты постэмбрионального развития. (Лекция 11) Экосистема. Луг
Экосистема. Луг Презентация на тему "Пресмыкающиеся2" - скачать бесплатно презентации по Биологии
Презентация на тему "Пресмыкающиеся2" - скачать бесплатно презентации по Биологии Физиология системы пищеварения. Характеристика процессов пищеварения в ротовой полости и желудке
Физиология системы пищеварения. Характеристика процессов пищеварения в ротовой полости и желудке Строение бактериальной клетки
Строение бактериальной клетки Вегетативні органи рослин: стебло, листок
Вегетативні органи рослин: стебло, листок