Содержание
- 2. Полимеразная цепная реакция (ПЦР) ПЦР – это метод лабораторной диагностики, направленный на выявление специфического участка ДНК
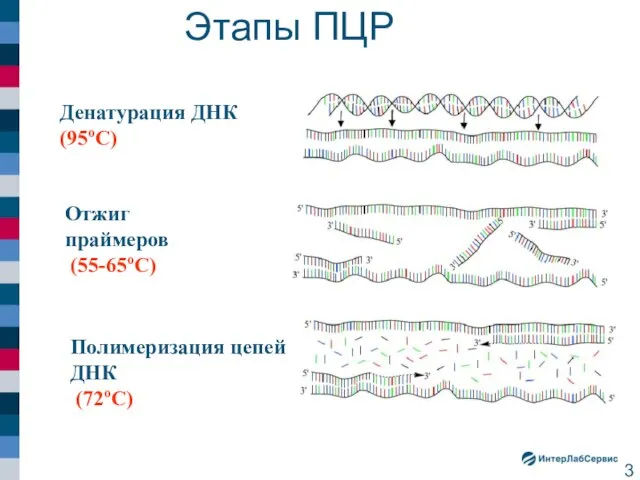
- 3. Этапы ПЦР Денатурация ДНК (95оС) Отжиг праймеров (55-65оС) Полимеризация цепей ДНК (72оС)
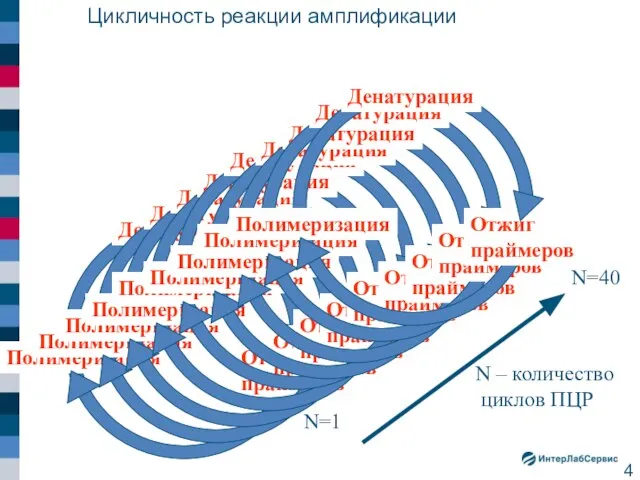
- 4. Цикличность реакции амплификации N=1 N=40 N – количество циклов ПЦР
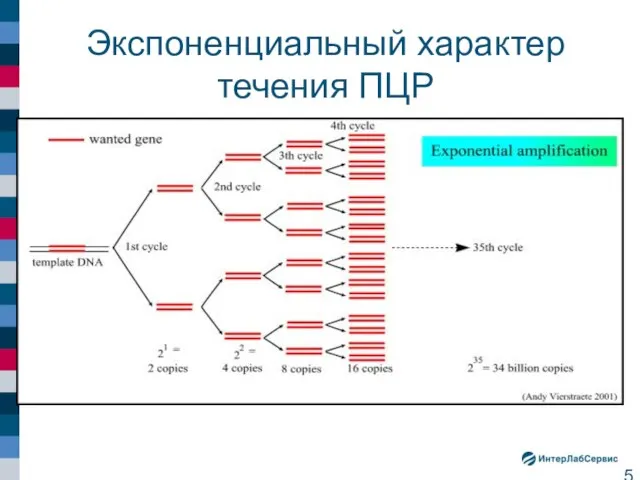
- 5. Экспоненциальный характер течения ПЦР
- 7. Основные характеристики ПЦР Высокая чувствительность, основанная на экспоненциальном принципе накопления продукта. Высокая специфичность, основанная на выявлении
- 8. Характеристика тест-систем на основе ПЦР Высокая специфичность, основанная на выявлении уникальных для микроорганизма участках генетического материала
- 9. Преимущества метода ПЦР Прямой метод обнаружения возбудителя Широкий спектр биологического материала Кровь, сыворотка Моча Фекалии Соскобы,
- 10. Особенности применения метода ПЦР Адекватный материал Где искать? Когда искать? Хранение, транспортировка материала Как хранить? Как
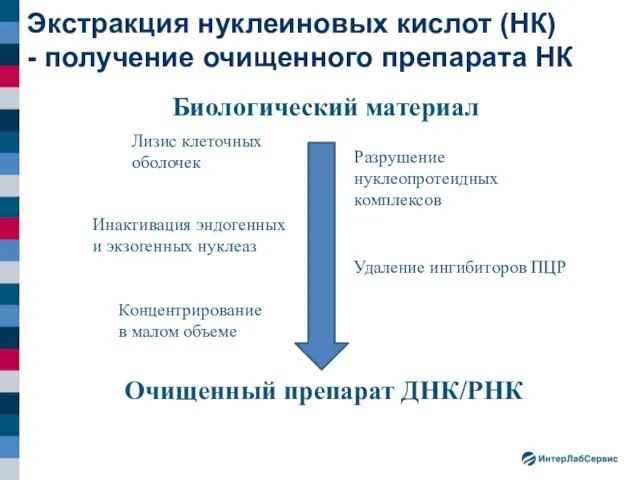
- 11. Экстракция нуклеиновых кислот (НК) - получение очищенного препарата НК
- 12. Гемоглобин Гепарин Иммуноглобулины Билирубины и желчные кислоты Слизь (мукополисахариды) Гормоны Ферменты Ионы металлов (Ca2+, Fe3+) Соли
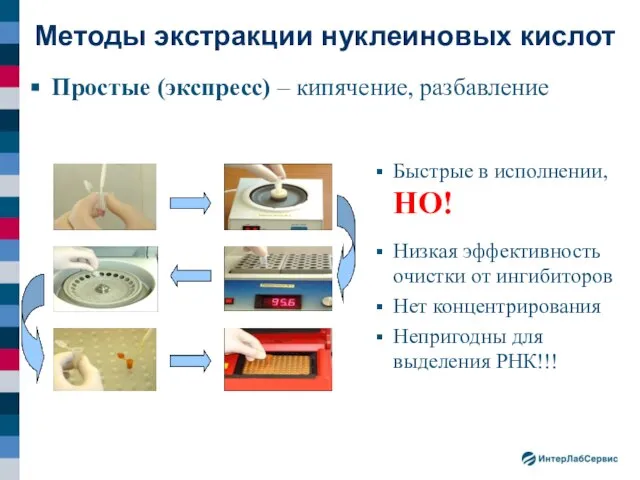
- 13. Быстрые в исполнении, НО! Низкая эффективность очистки от ингибиторов Нет концентрирования Непригодны для выделения РНК!!! Методы
- 14. Сложные – сорбция ДНК/РНК на носителе/ преципитация НК и удаление ингибиторов промыванием Длительные и трудоемкие (по
- 15. Сложные методы экстракции нуклеиновых кислот Лизис хаотропными агентами (н-р. гуанидинтиоцианат) ⇒ сорбция ДНК/РНК на силикагеле или
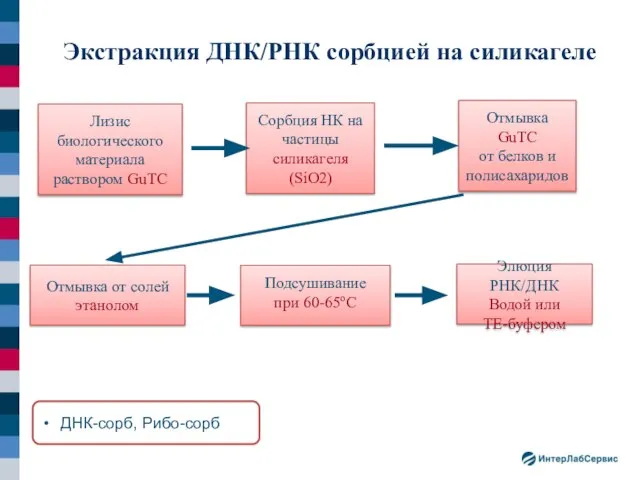
- 16. Экстракция ДНК/РНК сорбцией на силикагеле Отмывка от солей этанолом Элюция РНК/ДНК Водой или TE-буфером Подсушивание при
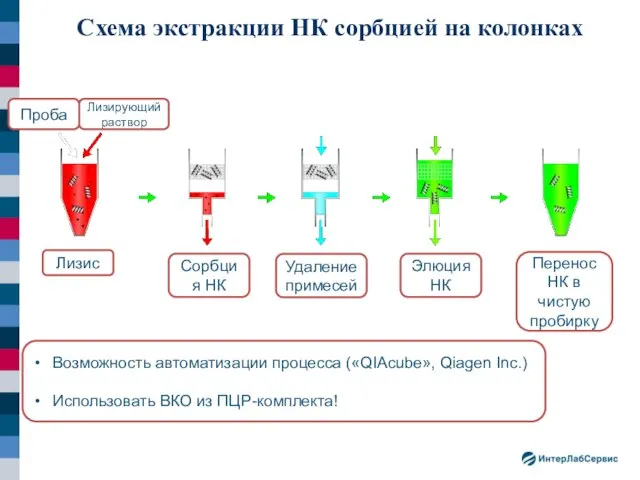
- 17. Схема экстракции НК сорбцией на колонках Лизис Сорбция НК Удаление примесей Элюция НК Перенос НК в
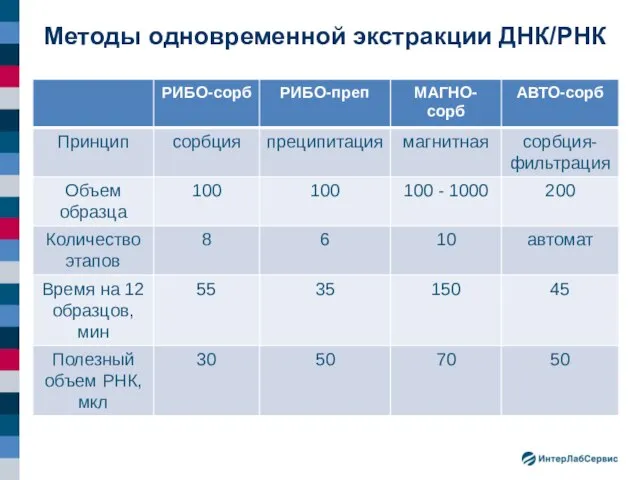
- 18. Методы одновременной экстракции ДНК/РНК
- 19. Контроль взятия и сохранности материала (эндогенный) Потери ДНК/РНК (эффективность экстракции) Полнота удаления ингибиторов Контроль за работой
- 20. РНК/ДНК Эндогенный – экзогенный Флуоресцентные - электрофоретические Общая классификация (ВК)
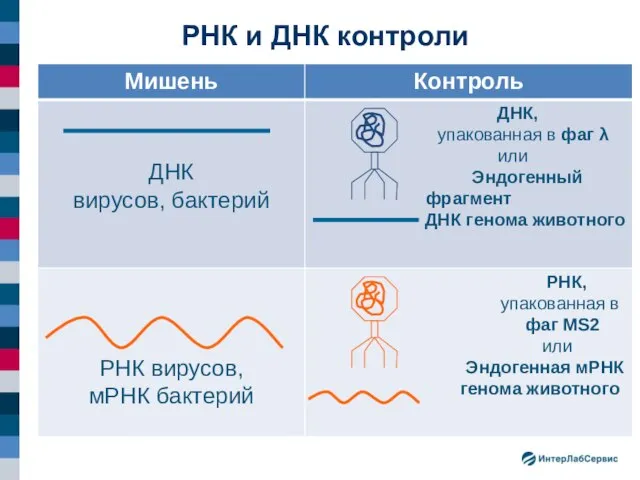
- 21. РНК и ДНК контроли
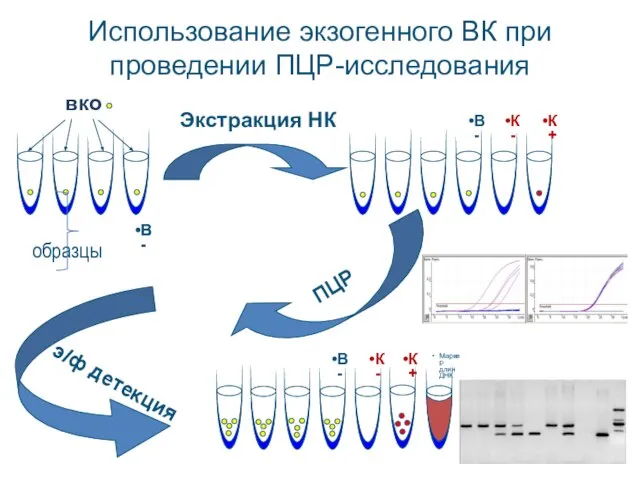
- 23. Экстракция НК э/ф детекция вко В- образцы Использование экзогенного ВК при проведении ПЦР-исследования В- В- К-
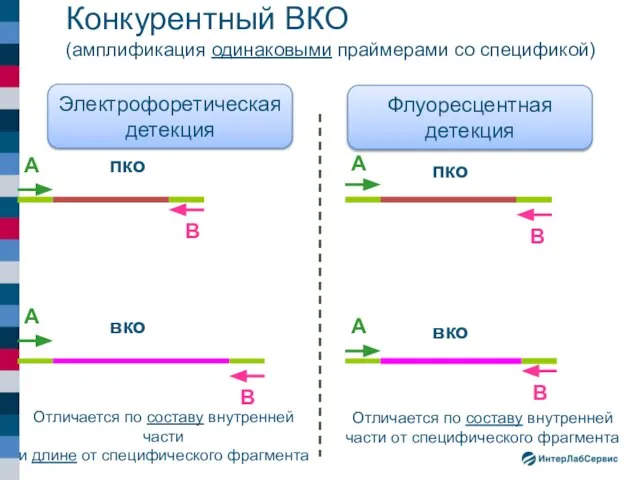
- 24. Конкурентный ВКО (амплификация одинаковыми праймерами со спецификой) А А В пко вко пко вко Отличается по
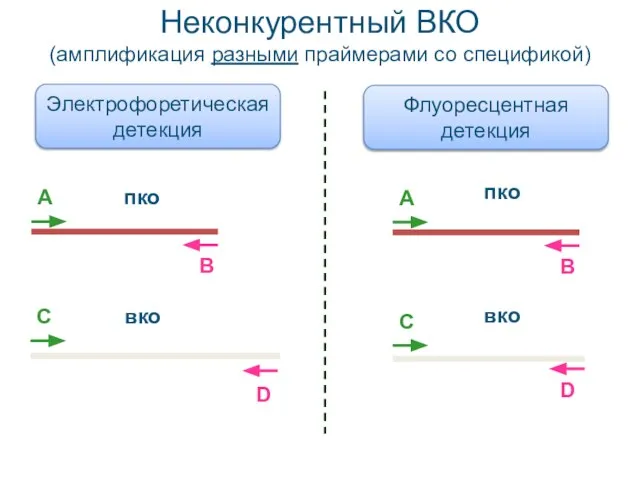
- 25. Неконкурентный ВКО (амплификация разными праймерами со спецификой) пко вко пко вко Электрофоретическая детекция Флуоресцентная детекция
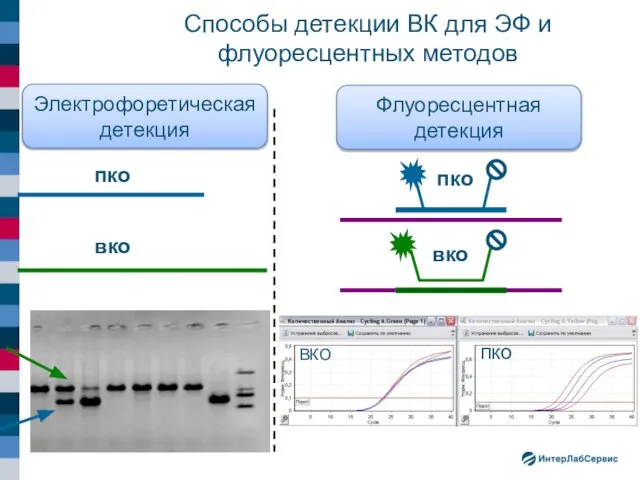
- 26. Способы детекции ВК для ЭФ и флуоресцентных методов пко вко пко вко ВКО пко Электрофоретическая детекция
- 27. Адекватный вид материала Зачем искать? Где искать? Когда искать? Правильное взятие материала Хранение и транспортировка по
- 28. Цель Мониторинг Скрининг Выявление этиологического агента другие Патогенез Где искать? Когда искать? Возраст и пол Вид
- 29. Асептика и антисептика Одноразовые пробирки Индивидуальные инструменты Количество, достаточное для повторного исследования Понятная маркировка Правильная упаковка
- 30. Кровь, сыворотка/плазма Материал из респираторного тракта Урогенитальные мазки Сперма Фекалии, помет, ректальные мазки Молоко Корма Вода
- 31. Цельная кровь Отбор в одноразовые пробирки ЭДТА или цитратом натрия Гемолитик РИБО-сорб (РНК), РИБО-преп (РНК+ДНК), ДНК-сорб-В(ДНК)
- 32. Кровь Биохимия, серология, ИФА Пробирка покрыта тонкодисперсными частицами диоксида кремния, которые ускоряют процесс образования кровяного сгустка
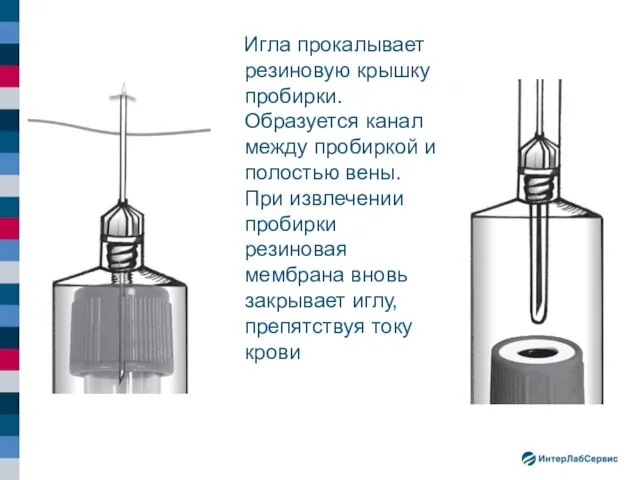
- 35. Игла прокалывает резиновую крышку пробирки. Образуется канал между пробиркой и полостью вены. При извлечении пробирки резиновая
- 36. КРС Лошади Из яремной вены (v. jugularis) Кровь берут в нижней трети шеи Из хвостовой вены
- 37. Свиньи Из ушной вены (v. auricularis) Из яремной вены (v.jugularis) Из хвостовой вены (v .сoccygea) Из
- 38. Мелкие домашние животные из лучевой (v. radialis) вены из бедренной (v. femoralis) вены Можно комплектовать пробирку
- 39. Материал из респираторного тракта Мазки из рото- и носоглотки Стерильный одноразовый зонд из акрона или вискозы
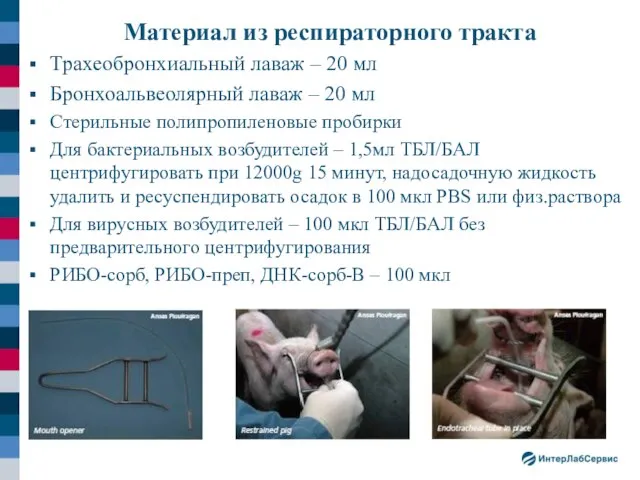
- 41. Материал из респираторного тракта Трахеобронхиальный лаваж – 20 мл Бронхоальвеолярный лаваж – 20 мл Стерильные полипропиленовые
- 42. Материал из урогенитального тракта Мазки, соскобы РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100 мкл Смывы с препунция РИБО-сорб,
- 43. Фекалии, помет Не менее 5 гр в стерильном контейнере 10-20% суспензия РИБО-сорб, РИБО-преп, ДНК-сорб-В – 100
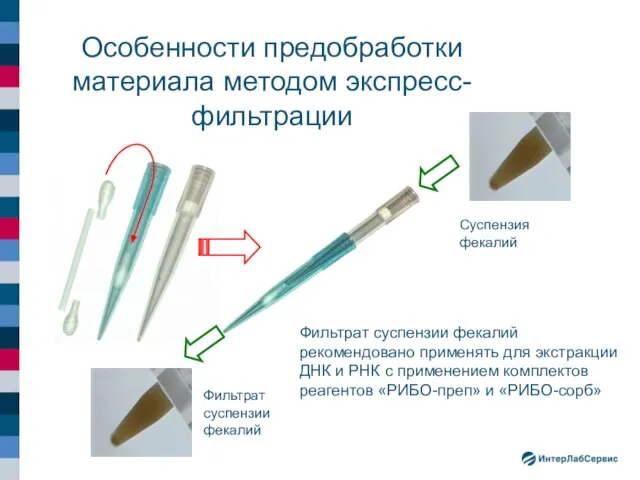
- 44. Особенности предобработки материала методом экспресс-фильтрации Суспензия фекалий Фильтрат суспензии фекалий Фильтрат суспензии фекалий рекомендовано применять для
- 45. Патматериал Фрагменты тканей и органов 1х1х1 см Отбор из очага поражения Формирование усредненной пробы Гомогенизация РИБО-сорб,
- 46. Транспортировка и хранение Транспортировка В течение суток при температуре +2 - +8 без заморозки Более суток
- 47. РАБОТА НАД ОШИБКАМИ
- 48. Ошибки преаналитического этапа Ошибки аналитического этапа Ошибки постаналитического этапа
- 49. Ошибки преаналитического этапа Место взятия биологического материала Правильность взятия биологического материала Обработка биологического материала Хранение биологического
- 50. Взятие биологического материала Неверное определение места предполагаемой локализации инфекционного процесса, особенно для микроорганизмов, имеющих тропность ко
- 51. Взятие биологического материала Материал должен содержать максималь-ную концентрацию микроорганизмов Минимальное количество примесей, спо-собных ингибировать ПЦР (слизь,
- 52. Обработка биологического материала Необходимо использовать антикоагулянты Присутствие гепарина в крови (антикоагу-лянтная терапия) может привести к ложно-отрицательному
- 53. Хранение биологического материала Разрушение РНК и ДНК возбудителей при нарушении сроков хранения и условий транспортировки Замораживание
- 54. Нормативная документация СП 1.2.036-96 СП 1.3.1285-03 СП 1.3.2322-08
- 55. Ошибки аналитического этапа Выбор системы пробоподготовки Технологические ошибки
- 56. Выбор системы пробоподготовки Неправильный выбор системы пробоподготовки Использование экспресс-методов на «сложных» образцах, может привести к ложноотрицатель-ным
- 57. Технологические ошибки Электрофоретическая детекция Риск принять неспецифические фрагменты за специфические при отсутствии К+ и маркером длин
- 58. Ошибки постаналитического этапа Ошибки интерпретации результатов ПЦР Сравнение результатов ПЦР и ИФА Сравнение ПЦР и микроскопии
- 59. Ошибки интерпретаци результатов ПЦР Неверная интерпретация результатов ПЦР-анализа, вследствие ошибочных представлений об инфекционном агенте или о
- 60. Сравнение результатов ПЦР и ИФА Наличие серологического окна Развитие иммунологической толерантности Генетически обусловленная серонегативность Выявление «иммунологического
- 61. Сравнение результатов ПЦР и микроскопии Низкая чувствительность микроскопии Субъективность оценки результатов Ограниченный спектр выявляемых патогенов
- 63. Скачать презентацию












































 Изучение изменчивости, критериев вида, результатов искусственного отбора на сортах культурных растений
Изучение изменчивости, критериев вида, результатов искусственного отбора на сортах культурных растений Мой питомец черепаха
Мой питомец черепаха Тема урока: «Цветок, его строение и значение»
Тема урока: «Цветок, его строение и значение»  ПРОИСХОЖДЕНИЕ МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
ПРОИСХОЖДЕНИЕ МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ Наука о растениях - ботаника. Мир растений
Наука о растениях - ботаника. Мир растений Презентация на тему Три атома
Презентация на тему Три атома Презентация на тему "Воробей" - скачать бесплатно презентации по Биологии
Презентация на тему "Воробей" - скачать бесплатно презентации по Биологии Влияние субстрата на качество цветоносных побегов при выгонке лилий
Влияние субстрата на качество цветоносных побегов при выгонке лилий Мышцы верхней конечности
Мышцы верхней конечности Вода и питьевой режим
Вода и питьевой режим Эволюционная теория Жана Батиста Ламарка
Эволюционная теория Жана Батиста Ламарка Презентация на тему "Историческое прошлое людей. Расы человека" - скачать презентации по Биологии
Презентация на тему "Историческое прошлое людей. Расы человека" - скачать презентации по Биологии БИОЛОГИЯ И ПАТОЛОГИЯ РЫБ Скляров Сергей Павлович Старший преподаватель кафедры паразитологии и ветсанэкспертизы, анатомии и пат
БИОЛОГИЯ И ПАТОЛОГИЯ РЫБ Скляров Сергей Павлович Старший преподаватель кафедры паразитологии и ветсанэкспертизы, анатомии и пат Значение бактерий в природе и жизни человека
Значение бактерий в природе и жизни человека Селекция животных
Селекция животных ИНФАРКТ - ЭТО ПРИГОВОР…
ИНФАРКТ - ЭТО ПРИГОВОР… Физические изменения у подростков
Физические изменения у подростков Презентация на тему "Що необхідно знати про туберкульоз" - скачать бесплатно презентации по Биологии
Презентация на тему "Що необхідно знати про туберкульоз" - скачать бесплатно презентации по Биологии Органические вещества в клетке. (10 класс)
Органические вещества в клетке. (10 класс) Тип Плоские черви
Тип Плоские черви Функции крови и лимфы
Функции крови и лимфы Презентация на тему "Мифы о курении и реальность" - презентации по Биологии
Презентация на тему "Мифы о курении и реальность" - презентации по Биологии Лекция Биоэнергетика и окислительное фосфорилирование
Лекция Биоэнергетика и окислительное фосфорилирование Структура бактериальной клетки. (Лекция 2)
Структура бактериальной клетки. (Лекция 2) Лесные растения мая
Лесные растения мая Млекопитающие. По страницам Красной книги новосибирской области
Млекопитающие. По страницам Красной книги новосибирской области Изучение ценопопуляции прострела раскрытого в окрестностях д. Клавдино
Изучение ценопопуляции прострела раскрытого в окрестностях д. Клавдино Плесневелые грибы
Плесневелые грибы