Содержание
- 2. По химическому составу различают: -простые белки (протеины) -белки, состоящие только из аминокислот -сложные белки (протеиды) Содержат
- 3. ПРОСТЫЕ БЕЛКИ. Построены из остатков аминокислот и при гидролизе распадаются только на свободные аминокислоты. Группы: Альбумины
- 4. КОЛИЧЕСТВЕННОЕ СООТНОШЕНИЕ БЕЛКОВЫХ ФРАКЦИЙ Больше всего в крови альбумина. В зависимости от доли белковой фракции, представленной
- 5. АЛЬБУМИНЫ И ГЛОБУЛИНЫ Глобулярные простые белки альбумины и глобулины наиболее распространены в растительном и в животном
- 6. АЛЬБУМИН Альбумин — это основной белок крови, вырабатываемый в печени человека. Альбумины выделяют в отдельную группу
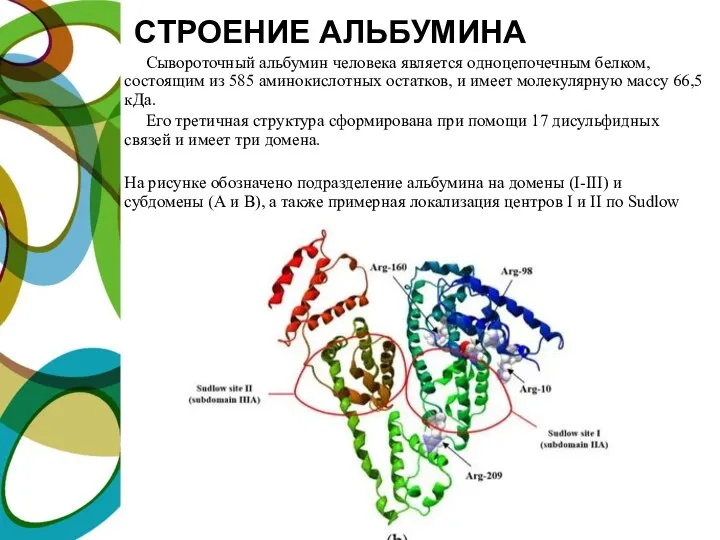
- 7. СТРОЕНИЕ АЛЬБУМИНА Сывороточный альбумин человека является одноцепочечным белком, состоящим из 585 аминокислотных остатков, и имеет молекулярную
- 8. ГЛОБУЛИНЫ Глобулины – широко распространённая группа глобулярных белков, обычно сопутствующая альбуминам. Глобулины имеют более высокую молекулярную
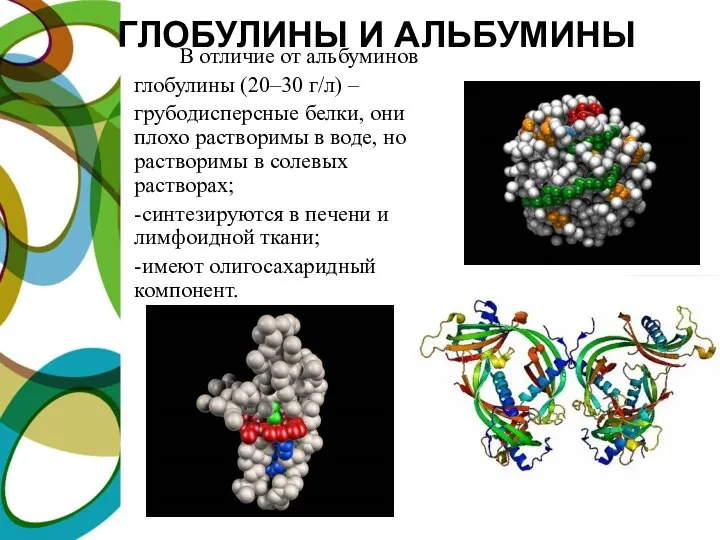
- 9. ГЛОБУЛИНЫ И АЛЬБУМИНЫ В отличие от альбуминов глобулины (20–30 г/л) – грубодисперсные белки, они плохо растворимы
- 11. ГИСТОНЫ Гистоны (от греч. histos - ткань) - тканевые белки многоклеточных организмов, связанных с ДНК хроматина.
- 12. СТРОЕНИЕ ГИСТОНОВ Гистоны организованы таким образом, что двухполосная ДНК обвивает белковый центр, состоящий из этих белков,
- 13. ПРОТАМИНЫ Протамины – низкомолекулярные положительно заряженные ядерные белки с резко выраженными основными свойствами (щелочные белки), с
- 14. СВОЙСТВА ПРОТАМИНА -Отсутствует денатурации при нагревании. -Образуют соли с кислотами и комплексы с кислыми белками. -Протамины
- 15. ГЛЮТЕЛИНЫ И ПРОЛАМИНЫ Глобулярные простые белки глютелины и проламины – белки растительного происхождения, характеризующиеся высоким содержанием
- 16. ПРЕДПОЛАГАЕТСЯ, ЧТО ОНИ ПРЕЖДЕ ВСЕГО ОБЕСПЕЧИВАЮТ ФИЗИОЛОГИЧЕСКУЮ ФУНКЦИЮ НЕРВНЫХ ВОЛОКОН.
- 17. БЕЛКИ ПРОТЕИНОИДЫ (СКЛЕРОПРОТЕИНЫ) Фибриллярные простые белки протеиноиды (склеропротеины) – это белки мышечных тканей, кожных покровов, костей,
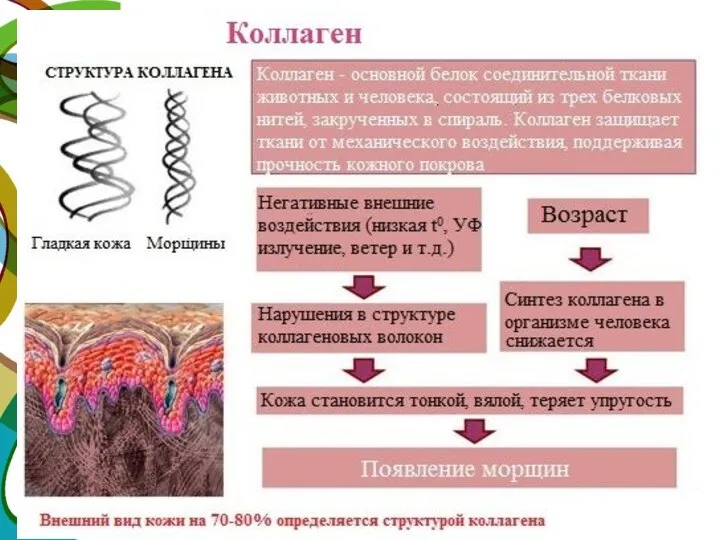
- 18. Коллаген – широко распространённый в организме белок, составляет около трети всех белков организма. Более 80% всего
- 20. ИНТЕРЕСНЫЙ ФАКТ КОЛЛАГЕН Коллаген, долго нагреваемый в воде при 56-1000С, переходит в растворимый клей, или глютин
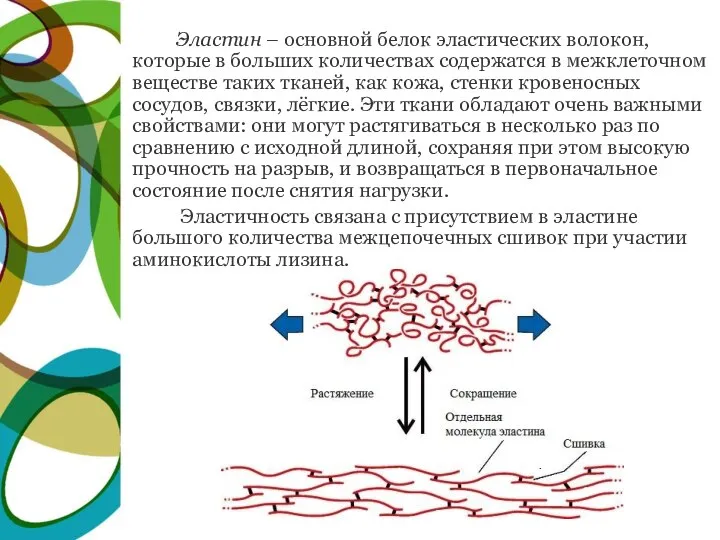
- 21. Эластин – основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей,
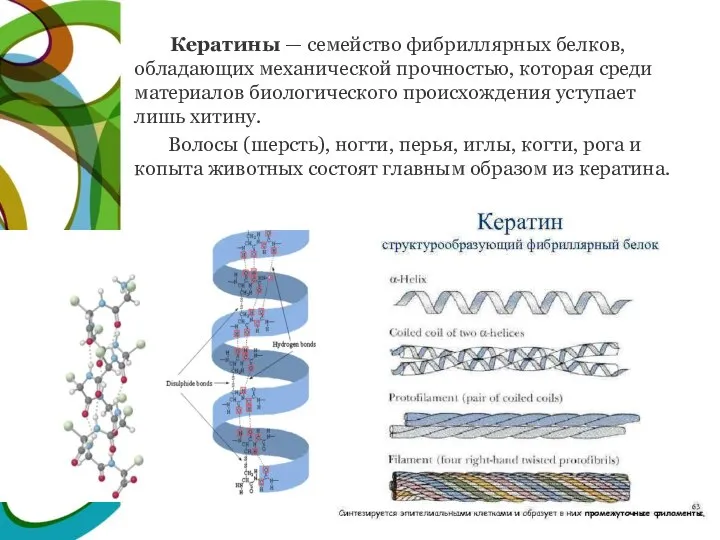
- 22. Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину.
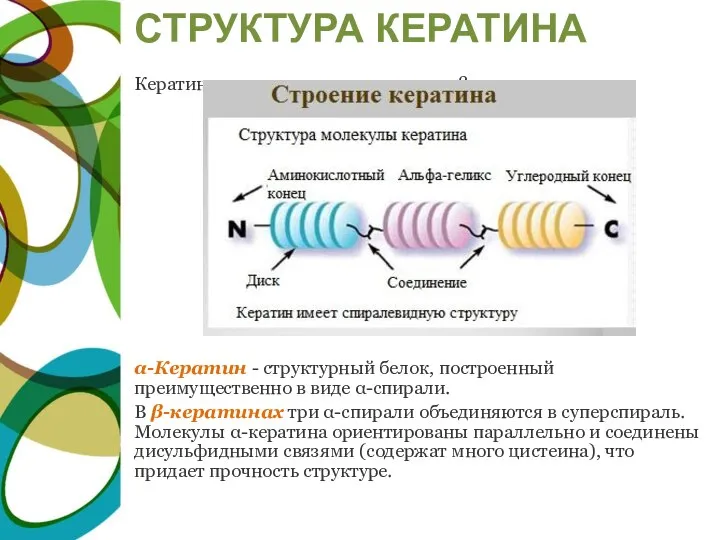
- 23. СТРУКТУРА КЕРАТИНА Кератины могут иметь α-структуру и β-структуру. α-Кератин - структурный белок, построенный преимущественно в виде
- 24. Фиброин шелка – фибриллярный белок, выделяемый паукообразными и некоторыми насекомыми и составляющий основу нитей паутины и
- 26. Скачать презентацию
















 Продукты питания из «чёрного списка» Выполнила ученица 8 класса МОУ гимназии г.Зуевка Кировской области Мохова Анастасия
Продукты питания из «чёрного списка» Выполнила ученица 8 класса МОУ гимназии г.Зуевка Кировской области Мохова Анастасия Развитие микробиологии, вирусологии, иммунологии. Ведущие направления и достижения
Развитие микробиологии, вирусологии, иммунологии. Ведущие направления и достижения Презентация на тему Многообразие птиц
Презентация на тему Многообразие птиц  Развитие зоологии краткая история 7 класс
Развитие зоологии краткая история 7 класс  Дикие животные в зимнем лесу.
Дикие животные в зимнем лесу.  Биология как наука. Краткая история развития биологии. Система биологических наук Презентация для 10 класса по программе И.Б. Ага
Биология как наука. Краткая история развития биологии. Система биологических наук Презентация для 10 класса по программе И.Б. Ага Анатомия и физиология, как науки
Анатомия и физиология, как науки Физиология дыхания
Физиология дыхания Обмен веществ. Питание. Пищеварение
Обмен веществ. Питание. Пищеварение Важность охраны живого мира планеты
Важность охраны живого мира планеты Презентация на тему "Виды информационных моделей: схемы" - скачать презентации по Биологии
Презентация на тему "Виды информационных моделей: схемы" - скачать презентации по Биологии Внутреннее строение, размножение и развитие рыб
Внутреннее строение, размножение и развитие рыб  Кто такие птицы?
Кто такие птицы? Совершенствование биообъекта методами генной и клеточной инженерии
Совершенствование биообъекта методами генной и клеточной инженерии Приспособленность организмов к действию факторов среды
Приспособленность организмов к действию факторов среды Систематика и эволюция высших растений. Номенклатура растений
Систематика и эволюция высших растений. Номенклатура растений Геномы органелл. Нуклеоид бактерий. Упаковка ДНК прокариот
Геномы органелл. Нуклеоид бактерий. Упаковка ДНК прокариот Элементарные факторы эволюции
Элементарные факторы эволюции Основы цитологии. Соединительная ткань
Основы цитологии. Соединительная ткань ХУДО ДЕЛО Нет худа без добра Как не сойти с ума с от борьбы с лишним весом
ХУДО ДЕЛО Нет худа без добра Как не сойти с ума с от борьбы с лишним весом  Генетика: методические особенности и приёмы решения задач
Генетика: методические особенности и приёмы решения задач Физиология бактерий. Рост и размножение бактерий
Физиология бактерий. Рост и размножение бактерий Распознавание однолетних и многолетних цветковых растений
Распознавание однолетних и многолетних цветковых растений Бионика
Бионика Презентация на тему "Развитие представлений о возникновении жизни" - скачать бесплатно презентации по Биологии
Презентация на тему "Развитие представлений о возникновении жизни" - скачать бесплатно презентации по Биологии ВИРУСЫ – НЕКЛЕТОЧНАЯ ФОРМА ЖИЗНИ…
ВИРУСЫ – НЕКЛЕТОЧНАЯ ФОРМА ЖИЗНИ… Головний мозок
Головний мозок  Клеточный уровень жизни Изучить структуру клеток Механизм устойчивости клетки как биосистемы Клетка –элементарная структур
Клеточный уровень жизни Изучить структуру клеток Механизм устойчивости клетки как биосистемы Клетка –элементарная структур