Соединительные петли - это фрагменты полипептидной цепи, которые нельзя отнести ни
к α-спирали, ни к β-складчатому листу.
Структура из четырех аминокислотных остатков, обеспечивающая поворот фрагмента полипептидной цепи на 180°, получила название β-изгиб, или β-поворот.
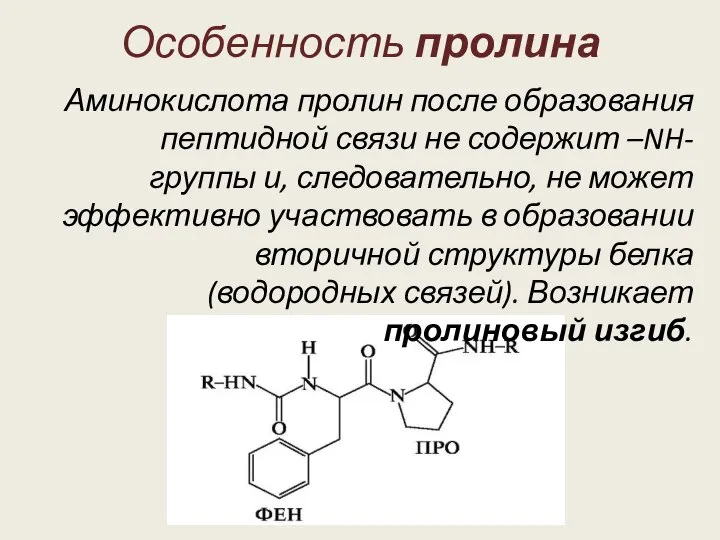
В области β-изгиба часто оказывается пролин. Существование β-изгиба и соединительных петель позволяет уложить элементы вторичной структуры в компактную глобулу.
Вторичная структура и соединительные петли, связывающие между собой отдельные ее элементы: а - α-спираль; б - антипараллельный β-складчатый лист



 Презентация на тему "Тип Хордовые. Подтипы: Бесчерепные и Черепные,или Позвоночные." - скачать презентации по Биологии
Презентация на тему "Тип Хордовые. Подтипы: Бесчерепные и Черепные,или Позвоночные." - скачать презентации по Биологии Презентация на тему "Липиды" - скачать презентации по Биологии
Презентация на тему "Липиды" - скачать презентации по Биологии Презентация на тему Биогеоценозы. Экосистемы. Строение и свойства.
Презентация на тему Биогеоценозы. Экосистемы. Строение и свойства. Дыхательная система.
Дыхательная система. Потребности человека
Потребности человека Тварини будівельники
Тварини будівельники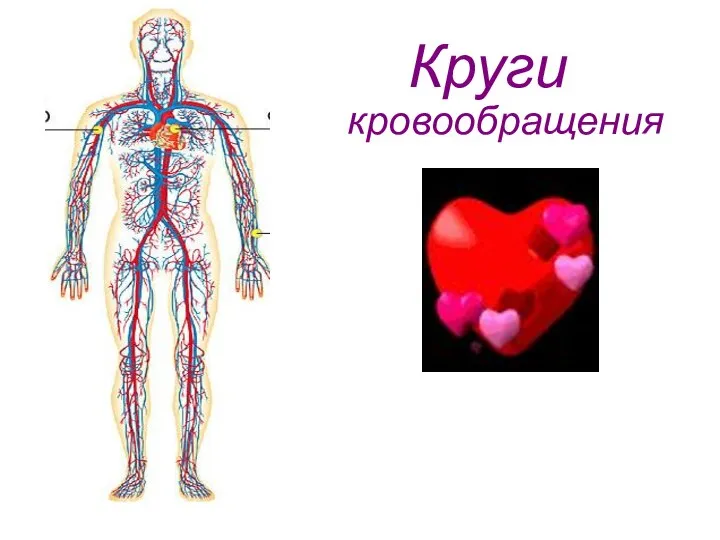 Круги кровообращения. Артериальная система человека
Круги кровообращения. Артериальная система человека Гүлдер және олардың мағынасы
Гүлдер және олардың мағынасы Приспособленность организмов к действию факторов среды
Приспособленность организмов к действию факторов среды Как питаются разные животные?
Как питаются разные животные? About viruses. Quiz
About viruses. Quiz Диплодок
Диплодок Плауны. Хвощи. Папоротники
Плауны. Хвощи. Папоротники Тигры Выполнила ученица 7 класса Неклюдовской школы: Кутейникова Ксения. Учитель : Отряскина Т.А.
Тигры Выполнила ученица 7 класса Неклюдовской школы: Кутейникова Ксения. Учитель : Отряскина Т.А. Многообразие водорослей
Многообразие водорослей  Распространение плодов и семян
Распространение плодов и семян Презентация к уроку на тему «Многообразие насекомых» Подготовлена учителем биологии Русиной Е.В. МАОУ гимназия № 111 г.Уфа, К
Презентация к уроку на тему «Многообразие насекомых» Подготовлена учителем биологии Русиной Е.В. МАОУ гимназия № 111 г.Уфа, К Пищевые вещества
Пищевые вещества Могут ли современные средства контрацепции защитить на 100% от болезней, передающихся половым путем? Донецкая ОШ № 97 Презентацию п
Могут ли современные средства контрацепции защитить на 100% от болезней, передающихся половым путем? Донецкая ОШ № 97 Презентацию п Есть в травах и цветах целительная сила
Есть в травах и цветах целительная сила Влияние музыки на организм человека
Влияние музыки на организм человека Психология восприятия. Общие определения
Психология восприятия. Общие определения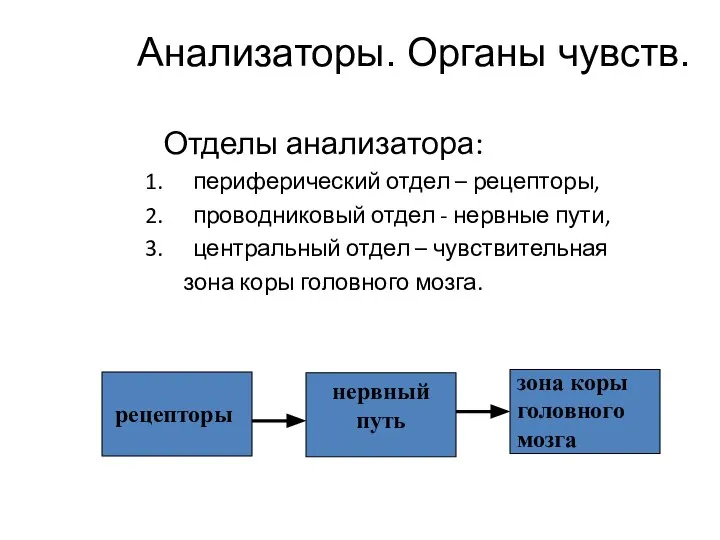 Анализаторы. Органы чувств. Глаз. Ухо
Анализаторы. Органы чувств. Глаз. Ухо Лес и его ярусы
Лес и его ярусы Презентация на тему "Какого витамина Вам не хватает?" - скачать презентации по Биологии
Презентация на тему "Какого витамина Вам не хватает?" - скачать презентации по Биологии Евелева С.Ю., ГОУ Лицей №329
Евелева С.Ю., ГОУ Лицей №329 СПИННОЙ МОЗГ. СТРОЕНИЕ Спинной мозг лежит в позвоночном канале представляет собой длинный тяж (его длина у взрослого человека око
СПИННОЙ МОЗГ. СТРОЕНИЕ Спинной мозг лежит в позвоночном канале представляет собой длинный тяж (его длина у взрослого человека око Вирусы. Строение вируса
Вирусы. Строение вируса