Содержание
- 2. Электрический ток может протекать в пяти различных средах: Металлах Вакууме Полупроводниках Жидкостях Газах
- 3. Жидкости по степени электропроводности делятся на: диэлектрики (дистиллированная вода) проводники (электролиты) полупроводники (расплавленный селен)
- 4. Электрический ток в жидкостях Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом
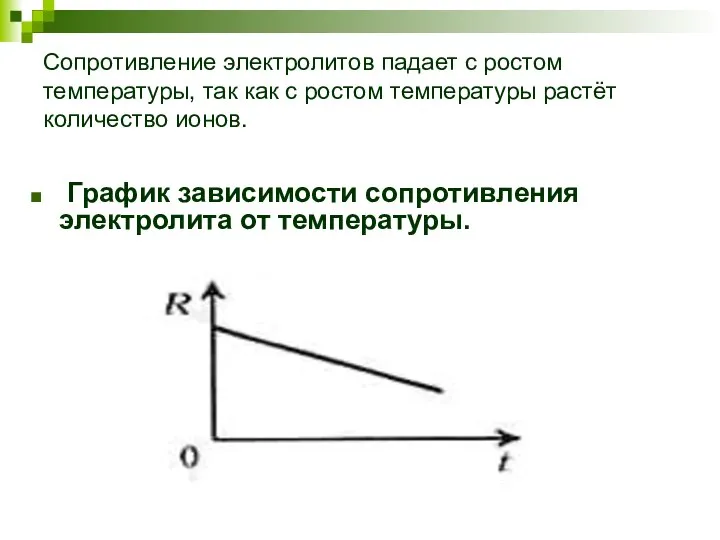
- 5. Сопротивление электролитов падает с ростом температуры, так как с ростом температуры растёт количество ионов. График зависимости
- 6. Электролитическая диссоциация - при растворении в результате теплового движения происходят столкновения молекул растворителя и нейтральных молекул
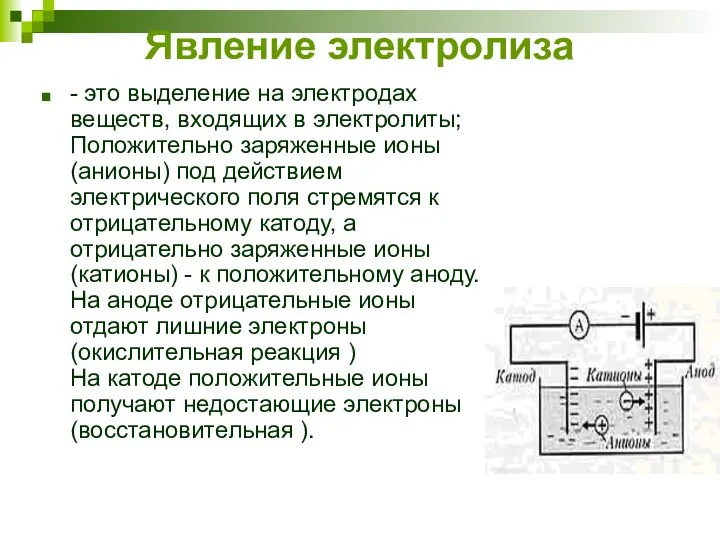
- 7. Явление электролиза - это выделение на электродах веществ, входящих в электролиты; Положительно заряженные ионы (анионы) под
- 8. Законы электролиза Фарадея. Законы электролиза определяют массу вещества, выделяемого при электролизе на катоде или аноде за
- 10. Скачать презентацию





 Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха
Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха Анализ связи северо-южной асиммметрии солнечной активности
Анализ связи северо-южной асиммметрии солнечной активности Электроемкость. Конденсатор
Электроемкость. Конденсатор Техническая термодинамика. Термодинамичекие потенциалы. Эффект Джоуля-Томсона. (Лекция 5)
Техническая термодинамика. Термодинамичекие потенциалы. Эффект Джоуля-Томсона. (Лекция 5) Молекулярно-кинетическая теория газов. (Лекция 2)
Молекулярно-кинетическая теория газов. (Лекция 2) Өз құрылымы мен құрамы болмайтын бөлшекті
Өз құрылымы мен құрамы болмайтын бөлшекті Специальная теория относительности. Постулаты теории относительности Урок в 11 классе. Подготовила учитель МБОУ СОШ с. Никиф
Специальная теория относительности. Постулаты теории относительности Урок в 11 классе. Подготовила учитель МБОУ СОШ с. Никиф Обозначения на схеме
Обозначения на схеме Электрические цепи с распределенными параметрами
Электрические цепи с распределенными параметрами Аттестационная работа. Программа дополнительного образования Методы решения физических задач
Аттестационная работа. Программа дополнительного образования Методы решения физических задач Реальная жидкость. Вязкость
Реальная жидкость. Вязкость  Основные понятия электросвязи. Информация, сообщение, сигнал
Основные понятия электросвязи. Информация, сообщение, сигнал Статика. Равновесие тел
Статика. Равновесие тел Давление газа
Давление газа Явище змочування та капілярності в побуті,природі та техніці. . Войтенко Ольга 10-Б
Явище змочування та капілярності в побуті,природі та техніці. . Войтенко Ольга 10-Б  Важелі в тілі людини
Важелі в тілі людини Законы Ньютона
Законы Ньютона Колебания и волны
Колебания и волны Полезная и вредная электризация
Полезная и вредная электризация Введение. Машины и их классификация
Введение. Машины и их классификация Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Элементарные частицы - лектоны
Элементарные частицы - лектоны Нанокомпозиты: термодинамическое описание и размерные эффекты
Нанокомпозиты: термодинамическое описание и размерные эффекты Характеристики излучения лазеров
Характеристики излучения лазеров Термомеханический эффект
Термомеханический эффект Расчеты по химической формуле и уравнению реакции. Газовые законы. Объемная доля газа в смеси
Расчеты по химической формуле и уравнению реакции. Газовые законы. Объемная доля газа в смеси Направления альтернативной энергетики
Направления альтернативной энергетики Маятники и их виды
Маятники и их виды