Содержание
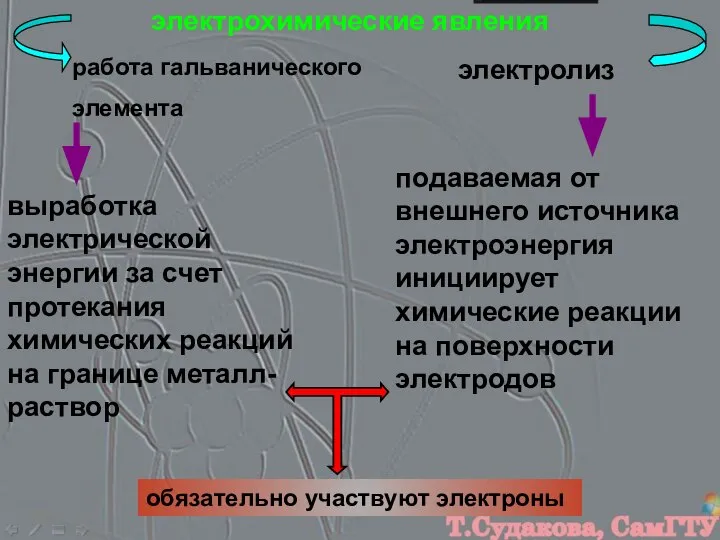
- 2. электрохимические явления работа гальванического элемента электролиз выработка электрической энергии за счет протекания химических реакций на границе
- 3. «электричество» - от греческого «electron», т.е. янтарь – вещество, которое при трении электризуется электрохимия берет начало
- 4. Гальванический элемент (ГЭ) – устройство, преобразующее энергию химических реакций в электрическую апельсиновая батарейка электроды ЭЛЕКТРОД -
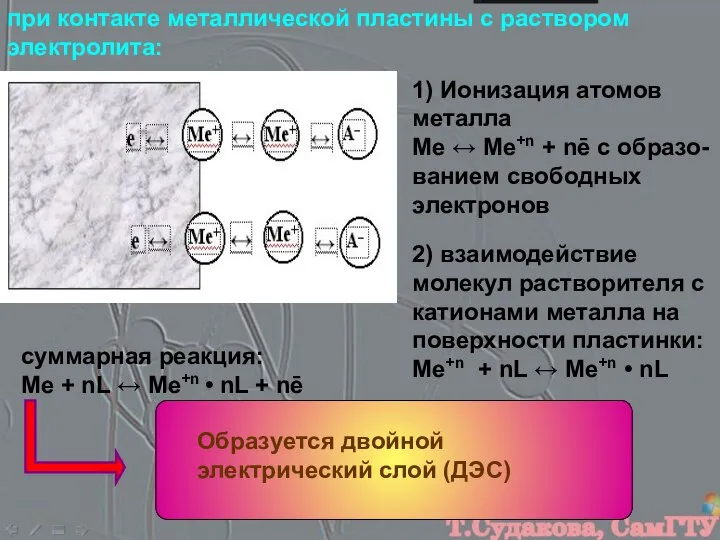
- 5. 2) взаимодействие молекул растворителя с катионами металла на поверхности пластинки: Ме+n + nL ↔ Ме+n •
- 6. ДЭС обуславливает возникновение электродного потенциала – разности электростатических потенциалов между электродом и находящимся с ним в
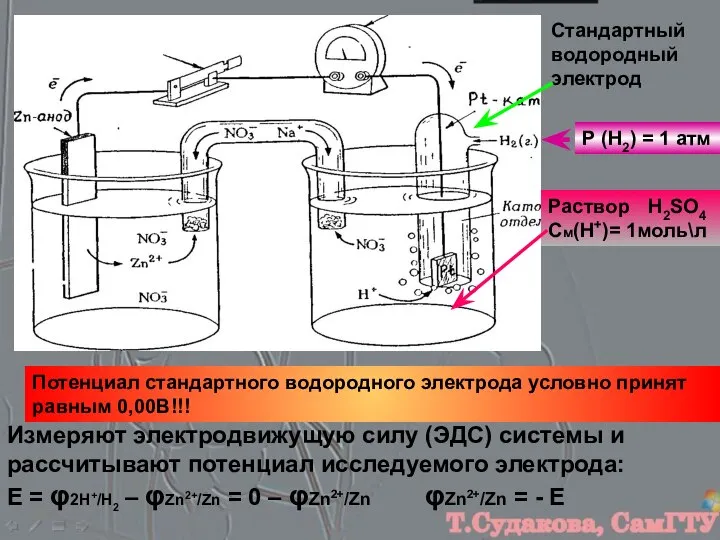
- 7. Стандартный водородный электрод Р (Н2) = 1 атм Раствор H2SO4 См(Н+)= 1моль\л Потенциал стандартного водородного электрода
- 8. Стандартные условия: 298К, концентрация окисленной формы 1 моль\л
- 9. уравнение Нернста: φ=φ0+(RT/nF)•lnKp=φ0+(RT/nF)• ln([Ox]/[Red]) где φ – потенциал электрода в нестандартных условиях; φ0- стандартный электродный потенциал;
- 10. Для происходящей на поверхности металла обратимой реакции Ме Ме+n + nē Кр = [Ме+n]/[Ме], но [Ме]=const,
- 11. Классификация электродов: 1) Электрод «металл/катион металла» I рода – пластина металла в растворе электролита, например, Cu/Cu2+,
- 12. 3) Окислительно-восстановительный электрод, например, Pt/Fe2+,Fe3+, электродная реакция Fe2+ ↔ Fe3+ + ē [Fe3+] φ = φ0
- 13. Гальванические элементы принято записывать схемами: Ме1 | Ме1+х || Ме2 +y | Ме2 (А) Zn |
- 14. Гальванический элемент. Химические источники тока. Устройство, служащее для непосредственного преобразования энергии химической реакции в электрическую энергию,
- 15. ТИПЫ ГЭ (ХИТ) 1) первичные ГЭ – это элементы, в которых происходит необратимая ОВР и дальнейшее
- 16. 2) вторичные ГЭ – аккумуляторы- элементы, работа которых основана на обратимой ОВР и процессы зарядки и
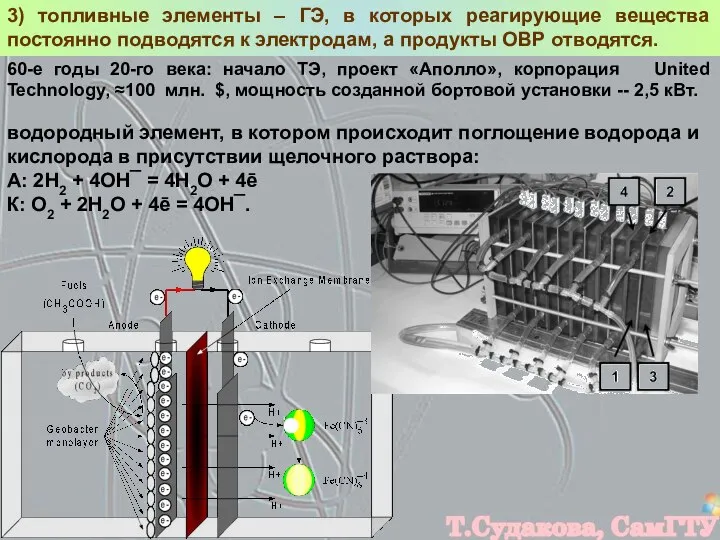
- 17. 3) топливные элементы – ГЭ, в которых реагирующие вещества постоянно подводятся к электродам, а продукты ОВР
- 18. ЭЛЕКТРОЛИЗ Потенциал разложения – это минимальная необходимая разность потенциалов, при которой начинается электролиз данного вещества. φ0разл.
- 19. Примеси сырья SiO2 и Fe2O3 необходимо удалять, иначе они будут подвергаться электролизу вместе с Al2O3 Условие
- 20. Правила разрядки частиц на электродах при электролизе: 1) на катоде в первую очередь восстанавливается вещество с
- 21. электролиз раствора NaCl на инертных электродах: 1) диссоциация NaCl = Na+ + Cl─ 2) движение ионов
- 22. Количественные соотношения при электролизе были установлены М. Фарадеем и сформулированы им в виде законов электролиза: Количество
- 24. Скачать презентацию




![уравнение Нернста: φ=φ0+(RT/nF)•lnKp=φ0+(RT/nF)• ln([Ox]/[Red]) где φ – потенциал электрода в нестандартных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/664817/slide-8.jpg)












 Движение тела, брошенного вертикально вверх
Движение тела, брошенного вертикально вверх Атомна енергетика
Атомна енергетика  Аттестационная работа. Образовательная программа кружка «Юный физик» 5 класс
Аттестационная работа. Образовательная программа кружка «Юный физик» 5 класс Аттестация 1. Электродинамика
Аттестация 1. Электродинамика Презентация по физике "Ртутный термометр" - скачать
Презентация по физике "Ртутный термометр" - скачать  Силы в природе, законы Ньютона. Решение задач
Силы в природе, законы Ньютона. Решение задач Звуки. Звуковые волны выполнила: ученица 9 класса МКОУ «Бабежская СОШ»« Павлючкова Юлия руководитель: учитель физики Тетенькина
Звуки. Звуковые волны выполнила: ученица 9 класса МКОУ «Бабежская СОШ»« Павлючкова Юлия руководитель: учитель физики Тетенькина  Техническое обслуживание и диагностирование неисправностей сельскохозяйственных машин и механизмов;
Техническое обслуживание и диагностирование неисправностей сельскохозяйственных машин и механизмов; Diodo shockley
Diodo shockley Пространственная система сил. Кинематика точки
Пространственная система сил. Кинематика точки Керамические нанокомпозиты
Керамические нанокомпозиты Электрическое поле. Действие электрического поля на электрические заряды
Электрическое поле. Действие электрического поля на электрические заряды Презентация по физике "Основное уравнение МКТ" - скачать
Презентация по физике "Основное уравнение МКТ" - скачать  Дослідження режимів роботи рентгенівських апаратів
Дослідження режимів роботи рентгенівських апаратів Преломление света
Преломление света Метапредметный подход на уроках физики
Метапредметный подход на уроках физики Аттестационная работа. Технология исследовательской деятельности в преподавании физики в рамках реализации ФГОС
Аттестационная работа. Технология исследовательской деятельности в преподавании физики в рамках реализации ФГОС Тести по КЕ
Тести по КЕ Сложение взаимно перпендикулярных колебаний
Сложение взаимно перпендикулярных колебаний Силы, стабилизирующие пространственную структуру макромолекул. Вязкость растворов макромолекул
Силы, стабилизирующие пространственную структуру макромолекул. Вязкость растворов макромолекул ВЫПОЛНИЛА УЧЕНИЦА 8«Б» КЛАССА СРЕДНЕЙ ШКОЛЫ №13 Елагина М.В. НАУЧНЫЙ РУКОВОДИТЕЛЬ СИЛКИНА С.В. Презентация по проекту «Энергосбер
ВЫПОЛНИЛА УЧЕНИЦА 8«Б» КЛАССА СРЕДНЕЙ ШКОЛЫ №13 Елагина М.В. НАУЧНЫЙ РУКОВОДИТЕЛЬ СИЛКИНА С.В. Презентация по проекту «Энергосбер Источники электропитания под рукой. Батарейка из картофеля
Источники электропитания под рукой. Батарейка из картофеля Ядерный реактор
Ядерный реактор Презентация по физике "Колебательные движения" - скачать
Презентация по физике "Колебательные движения" - скачать  Пособие по безработице в зарубежных странах
Пособие по безработице в зарубежных странах Строение атома и атомного ядра
Строение атома и атомного ядра Презентация по физике "ОПТИКА" - скачать
Презентация по физике "ОПТИКА" - скачать  Рубка металла
Рубка металла