Содержание
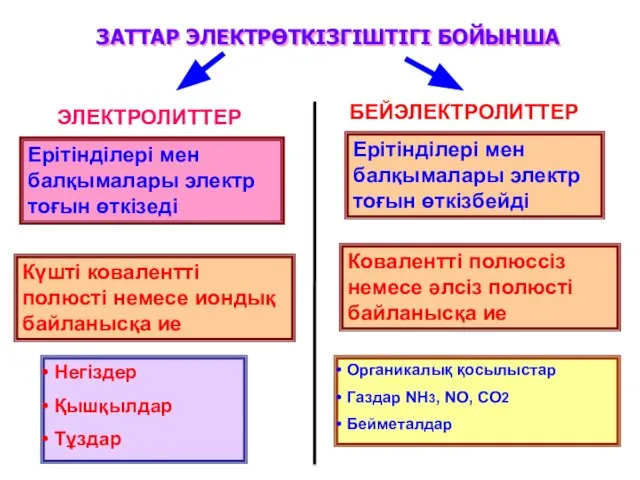
- 2. Ерітінділері мен балқымалары электр тоғын өткізеді ЗАТТАР ЭЛЕКТРӨТКІЗГІШТІГІ БОЙЫНША ЭЛЕКТРОЛИТТЕР БЕЙЭЛЕКТРОЛИТТЕР Ерітінділері мен балқымалары электр тоғын
- 3. Қышқылдар диссоциалағанда Н+ катонын түзеді Негіздер диссоциалағанда ОН- анионын түзеді Амфолиттер диссоциалағанда Н+ және ОН- иондарын
- 4. Электролиттер дегеніміз балқымалары мен ерітінділері электр тоғын өткізетін, иондық электроөткізгіштікке ие болатын заттар. Электролиттердің қасиеттерін электролиттік
- 5. Тұздар, қышқылдар, негіздер ерігенде және балқығанда иондарға ыдырайды. Ерітінділер мен балқымалардың ток өткізгіштігі осы иондардың концентрациясына
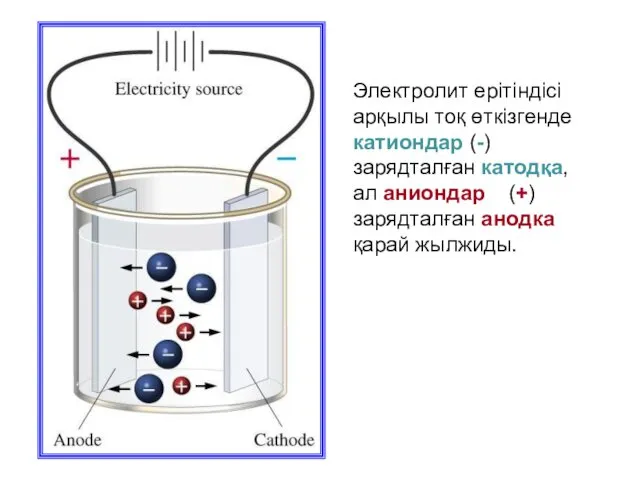
- 6. Электролит ерітіндісі арқылы тоқ өткізгенде катиондар (-) зарядталған катодқа, ал аниондар (+) зарядталған анодка қарай жылжиды.
- 7. Электролиттік диссоциация теориясының қағидалары: 1) Заттар суда ерігенде оң жөне теріс иондарға ыдырайды. 2) Диссоциация полярлы
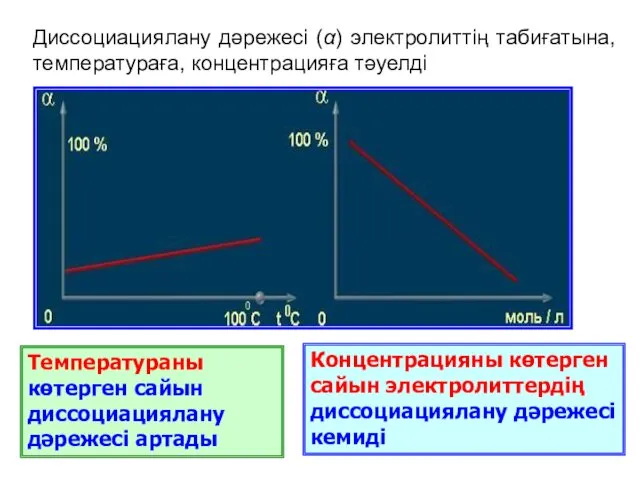
- 8. Диссоциациялану үдерісін сандық жағынан да сипаттауға болады. Диссоциацияланудың қаншалықты толық жүретіндігін диссоциациялану дәрежесі (α) көрсетеді, α-ны
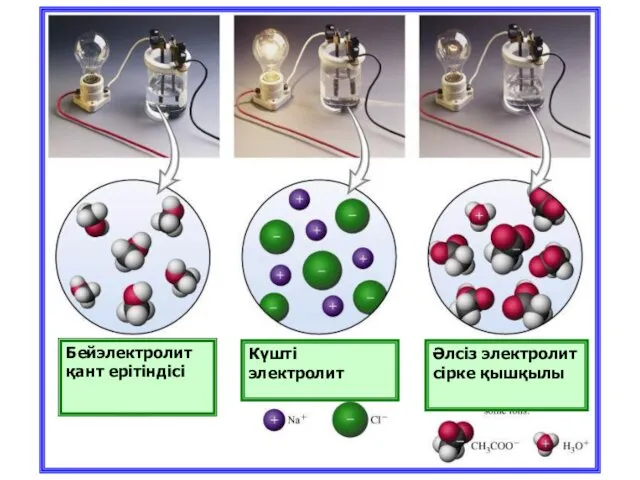
- 9. Бейэлектролит қант ерітіндісі Күшті электролит Әлсіз электролит сірке қышқылы
- 10. Температураны көтерген сайын диссоциациялану дәрежесі артады Концентрацияны көтерген сайын электролиттердің диссоциациялану дәрежесі кемиді Диссоциациялану дәрежесі (α)
- 11. Диссоциация процесі қайтымды болғандықтан, оған әрекеттесуші массалар заңы бойынша тепе-теңдік жағдайы тән болады. Ол жағдай тепе-теңдік
- 12. Диссоциациялану константасы Кдисс әлсіз электролиттің иондарға ыдырау қабілеттілігін көрсетеді, оның мәні тек әлсіз электролиттер үшін тұрақты
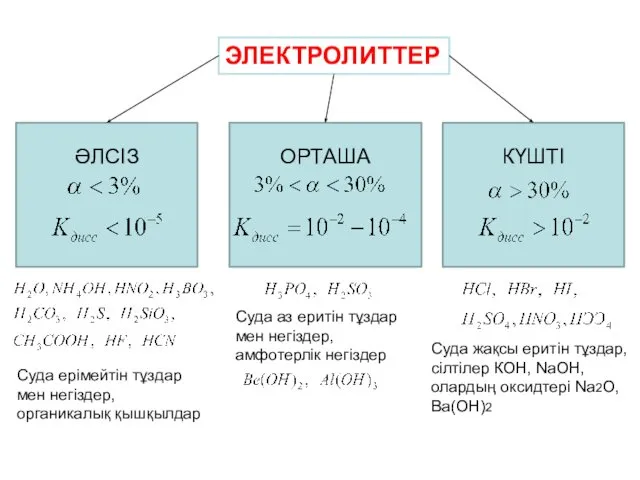
- 13. ЭЛЕКТРОЛИТТЕР ӘЛСІЗ ОРТАША КҮШТІ Суда ерімейтін тұздар мен негіздер, органикалық қышқылдар Суда аз еритін тұздар мен
- 14. Оствальдтің сұйылту заңы Электролиттердің диссоциациялану дәрежесі мен константасының арасында математикалық тәуелділік бар және ол Оствальдтің сұйылту
- 15. Күшті электролиттер теориясы (Дебай, Хюккель) бойынша күшті электролиттер ерітіндіде толық диссоциацияланғандықтан иондар концентрациясы жоғары болады. Әр
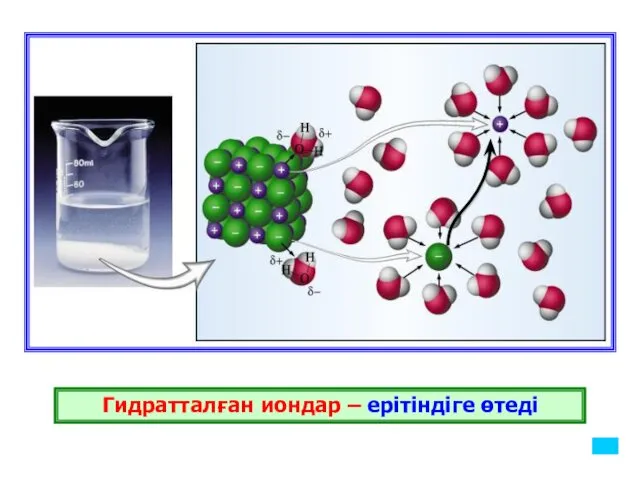
- 16. Гидратталған иондар – ерітіндіге өтеді
- 17. Активтілік коэффиценті ƒ ерітіндінің иондық күшіне байланысты. Ерітіндінің иондық күші ондағы барлық иондардың мольдік концентрациясы мен
- 18. Электролит ерітінділерінің электр тоғын өткізу қабілеті ондағы иондардың қозғалғыштығына байланысты болады. Заттың электр тоғын өткізу мүмкіндігі
- 19. Ерітінділердің кедергісі (R) кондуктометриялық ұяшық арқылы өлшенеді, ондағы электродтар бір қалыпты орнатылған, яғни: мұндағы Кс –
- 20. Меншікті электрөткізгіштік (χ) ерітіндінің концентрациясына тәуелсіз шама, сондықтан есептеулерде оның орнына эквиваленттік электрөткізгіштік шамасы алынады: Эквиваленттік
- 22. Скачать презентацию













 Газовые законы (10 класс) - Презентация по физике_
Газовые законы (10 класс) - Презентация по физике_ Импульс материальной точки. Другая формулировка второго закона Ньютона
Импульс материальной точки. Другая формулировка второго закона Ньютона Теплопроводность через плоскую и цилиндрическую стенки при граничных условиях третьего рода (теплопередача)
Теплопроводность через плоскую и цилиндрическую стенки при граничных условиях третьего рода (теплопередача) Явление тяготения. Сила тяжести
Явление тяготения. Сила тяжести Оптика. Световые явления. (Урок 29 -30)
Оптика. Световые явления. (Урок 29 -30) “Жарық техникасы және жарық көздері” пәні бойынша оқу-әдістемелік кешенін жасақтау
“Жарық техникасы және жарық көздері” пәні бойынша оқу-әдістемелік кешенін жасақтау Парогенераторы АЭС. Характеристики и типы ПГ АЭС. (Тема 2)
Парогенераторы АЭС. Характеристики и типы ПГ АЭС. (Тема 2) Определение содержания агрессивных ионов в атмосфере при проведении коррозионных испытаний
Определение содержания агрессивных ионов в атмосфере при проведении коррозионных испытаний Волны Эллиотта
Волны Эллиотта Теплолічильник. (Задача 2)
Теплолічильник. (Задача 2) Гидростатика
Гидростатика Крокова напруга
Крокова напруга Физика для малышей
Физика для малышей Температура как мера средней кинетической энергии
Температура как мера средней кинетической энергии Электрооборудование автомобилей. Катушки зажигания. (Урок 6)
Электрооборудование автомобилей. Катушки зажигания. (Урок 6) მაგნიტური ლევიტაცია
მაგნიტური ლევიტაცია Закон Кулона
Закон Кулона Электродинамика. Электростатика
Электродинамика. Электростатика Insulators and Conductors in electric field. Capacitance, Dielectrics. Current, resistance. Electromotive Force
Insulators and Conductors in electric field. Capacitance, Dielectrics. Current, resistance. Electromotive Force Алгоритм компьютерной обработки параметров динамической неуравновешенности ротора
Алгоритм компьютерной обработки параметров динамической неуравновешенности ротора Миражи
Миражи Стробоскопический эффект и оптические иллюзии
Стробоскопический эффект и оптические иллюзии Вольтамперометрия. Электрохимические методы
Вольтамперометрия. Электрохимические методы Лазер (англ. Laser, акроним от англ. Light amplification by stimulated emission of radiation)
Лазер (англ. Laser, акроним от англ. Light amplification by stimulated emission of radiation) Колокол дремавший… (колокол как источник звуковых волн)
Колокол дремавший… (колокол как источник звуковых волн) УРОК ФИЗИКИ В 10 КЛАССЕ Свободное падение
УРОК ФИЗИКИ В 10 КЛАССЕ Свободное падение  Оптические методы количественного анализа
Оптические методы количественного анализа Фотоиндуцированные реакции спиновых центров в нанокристаллическом диоксиде титана, легированном углеродом и азотом
Фотоиндуцированные реакции спиновых центров в нанокристаллическом диоксиде титана, легированном углеродом и азотом