Молекулы. Молекулярные спектры излучения и поглощения. Адиабатическое приближение. Термы двухатомной молекул
Содержание
- 2. Вопрос 15. Молекулы. Основы физики молекул. Молекулярные спектры излучения и поглощения. Адиабатическое приближение. Термы двухатомной молекулы.
- 3. Основы физики молекул. Вращение ядер (атомных остовов). Вращательные уровни Er J 0 1 2 3 4
- 4. Основы физики молекул. Колебания ядер (атомных остовов). Колебательные уровни 0 1 2 3 4 5 0
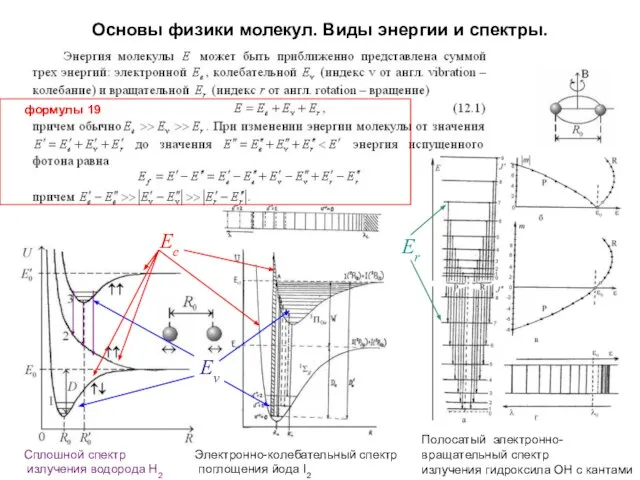
- 5. Основы физики молекул. Виды энергии и спектры. Сплошной спектр излучения водорода Н2 Электронно-колебательный спектр поглощения йода
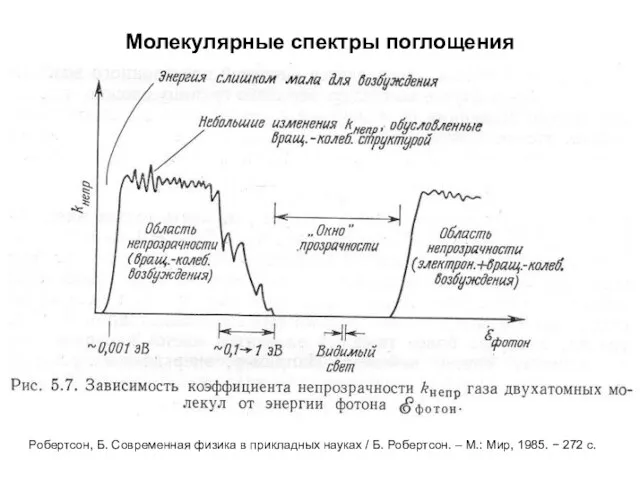
- 6. Молекулярные спектры поглощения Робертсон, Б. Современная физика в прикладных науках / Б. Робертсон. – М.: Мир,
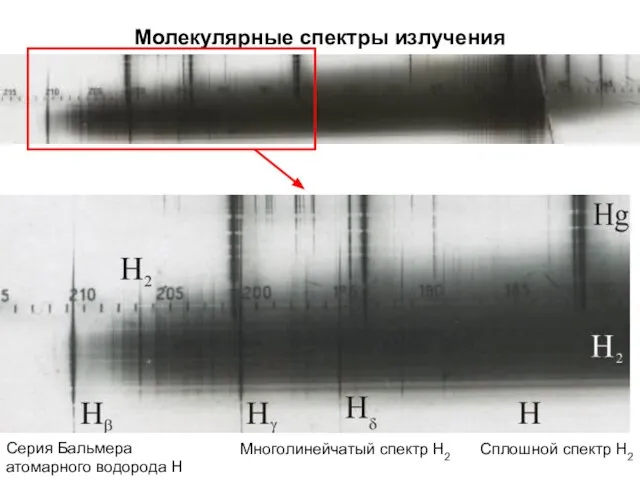
- 7. Молекулярные спектры излучения Многолинейчатый спектр Н2 Сплошной спектр Н2 Серия Бальмера атомарного водорода Н
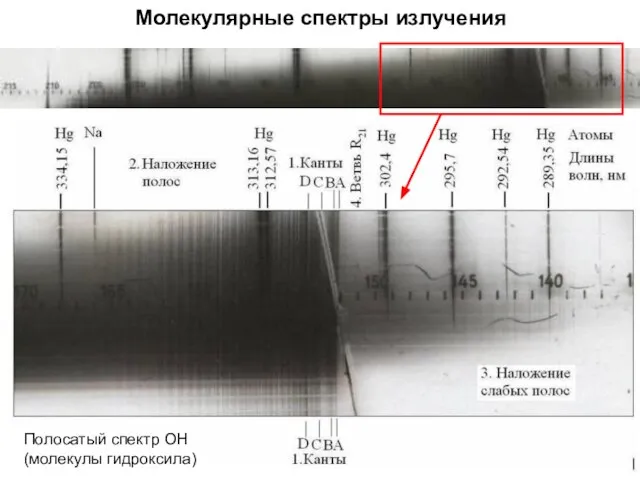
- 8. Молекулярные спектры излучения Полосатый спектр ОН (молекулы гидроксила)
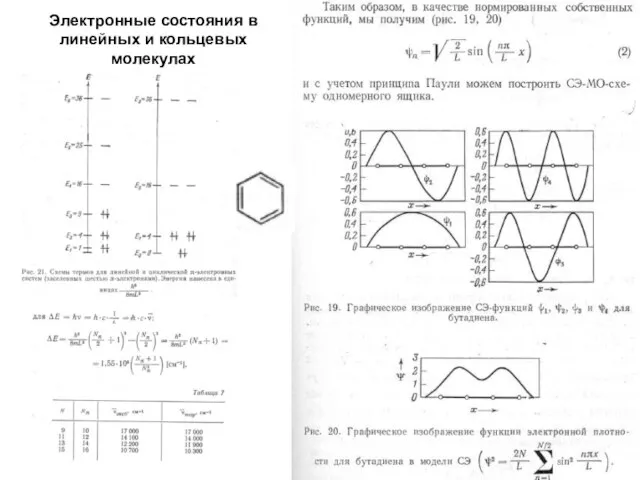
- 9. Электронные состояния в линейных и кольцевых молекулах
- 10. Основы физики молекул. Движение валентных электронов. Движение электронов и ядер в молекулах можно рассматривать по отдельности
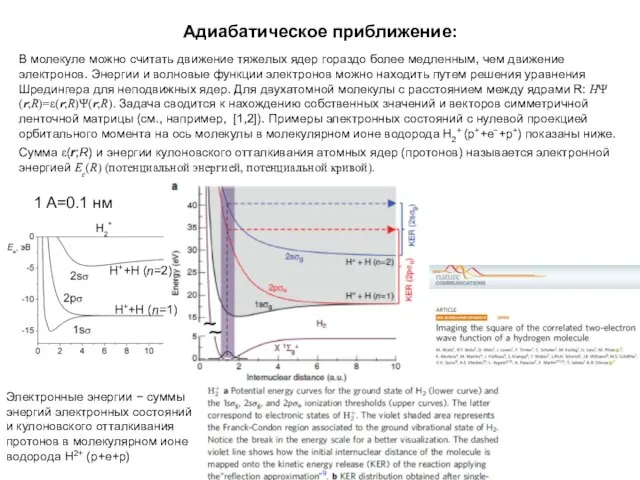
- 11. Адиабатическое приближение: В молекуле можно считать движение тяжелых ядер гораздо более медленным, чем движение электронов. Энергии
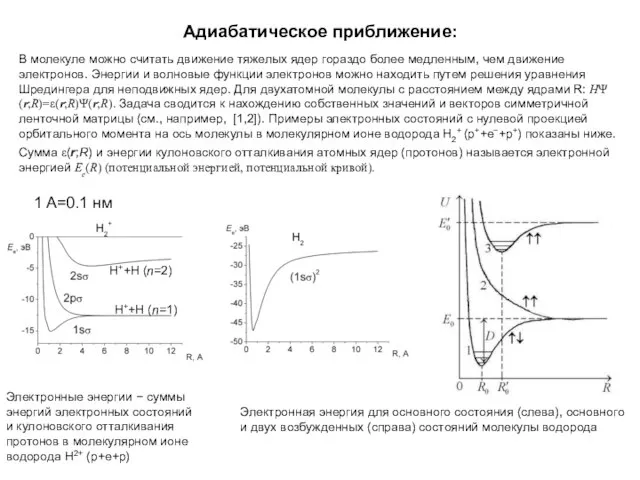
- 12. Адиабатическое приближение: В молекуле можно считать движение тяжелых ядер гораздо более медленным, чем движение электронов. Энергии
- 13. Адиабатическое приближение: В молекуле можно считать движение тяжелых ядер гораздо более медленным, чем движение электронов. Энергии
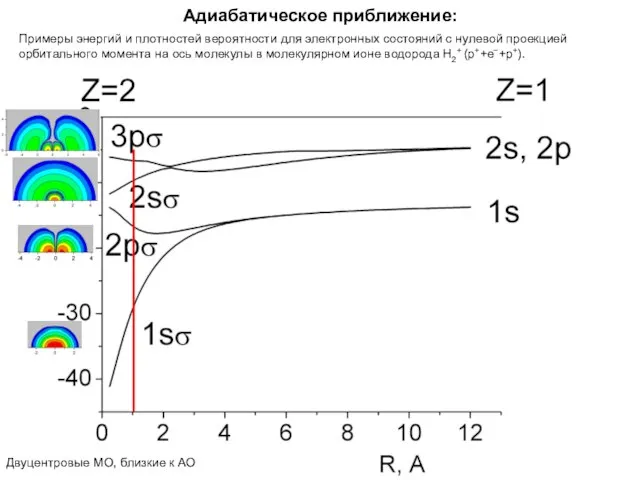
- 14. Адиабатическое приближение: Примеры энергий и плотностей вероятности для электронных состояний с нулевой проекцией орбитального момента на
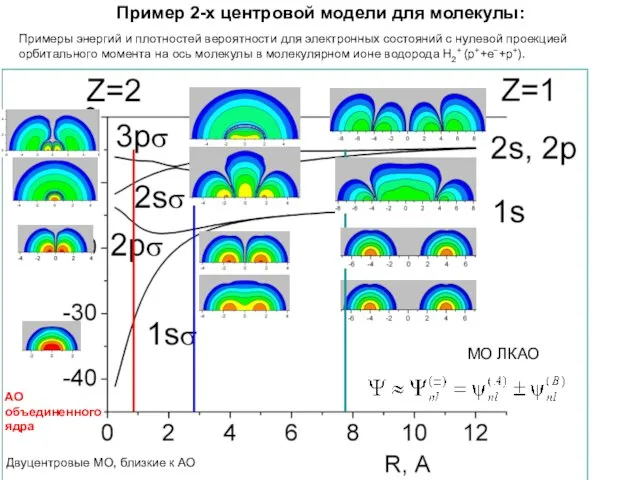
- 15. Пример 2-х центровой модели для молекулы: АО объединенного ядра Примеры энергий и плотностей вероятности для электронных
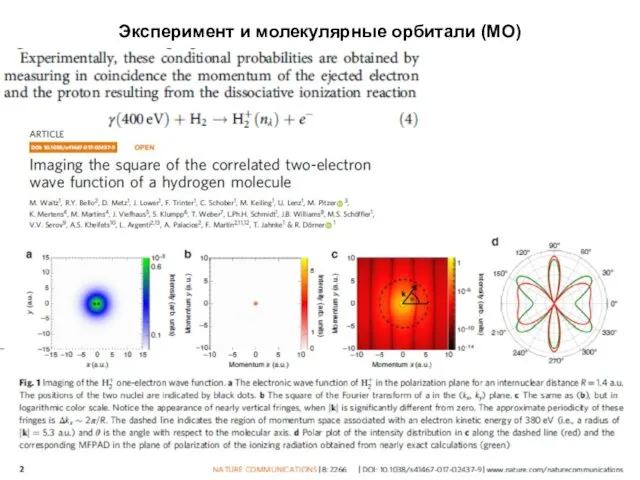
- 16. Эксперимент и молекулярные орбитали (МО)
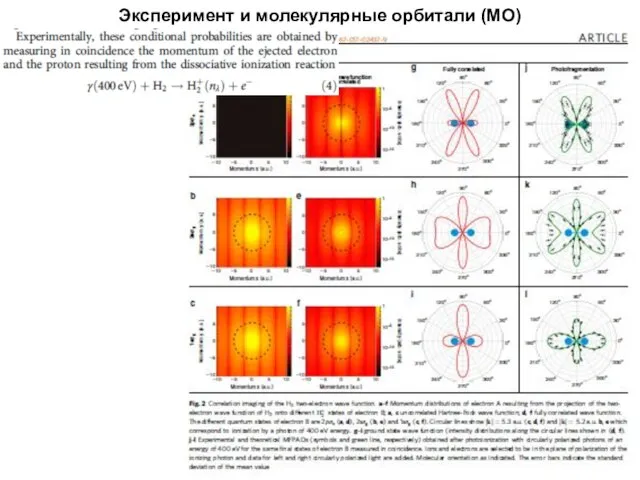
- 17. Эксперимент и молекулярные орбитали (МО)
- 18. Эксперимент и молекулярные орбитали (МО)
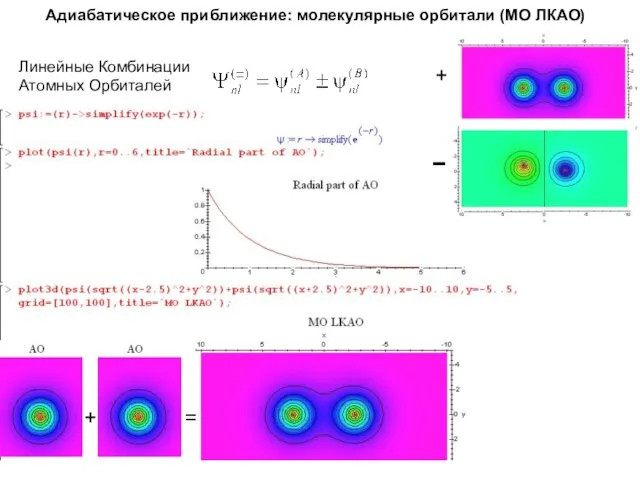
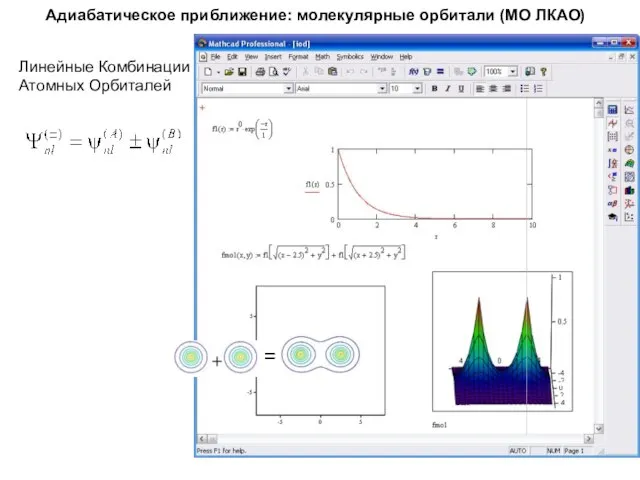
- 19. Адиабатическое приближение: молекулярные орбитали (МО ЛКАО) Линейные Комбинации Атомных Орбиталей + − + =
- 20. Адиабатическое приближение: молекулярные орбитали (МО ЛКАО) Линейные Комбинации Атомных Орбиталей =
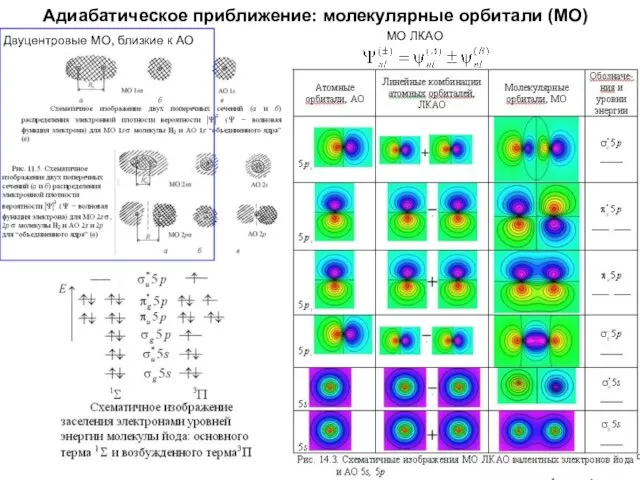
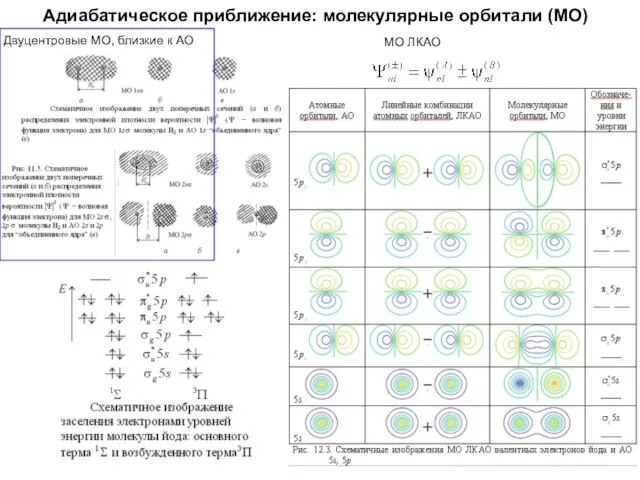
- 21. Адиабатическое приближение: молекулярные орбитали (МО) Двуцентровые МО, близкие к АО МО ЛКАО
- 22. Адиабатическое приближение: молекулярные орбитали (МО) МО ЛКАО Двуцентровые МО, близкие к АО
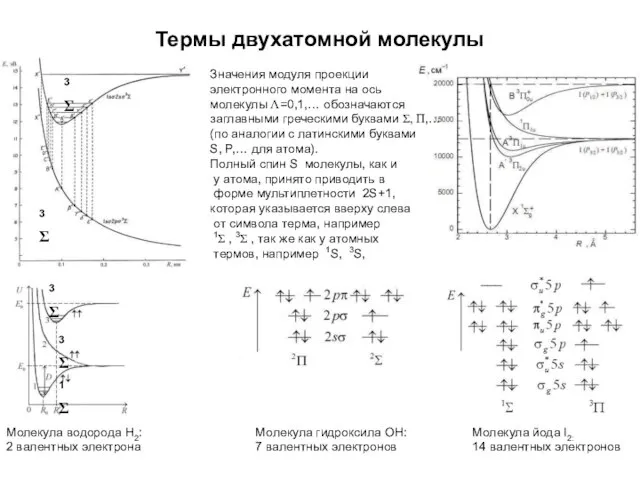
- 23. Термы двухатомной молекулы Молекула водорода Н2: 2 валентных электрона Молекула йода I2: 14 валентных электронов Молекула
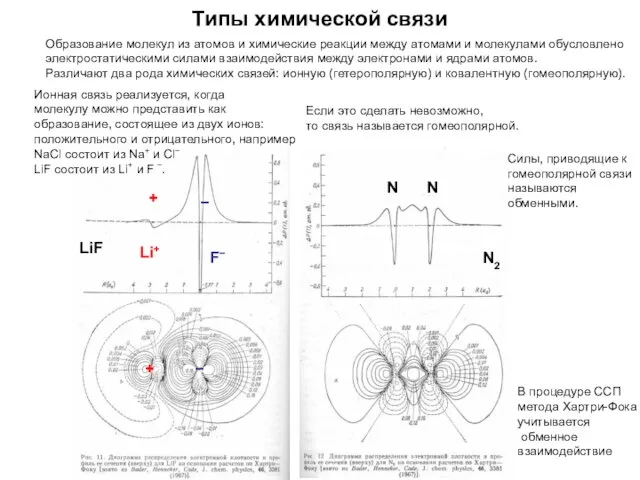
- 24. Типы химической связи Образование молекул из атомов и химические реакции между атомами и молекулами обусловлено электростатическими
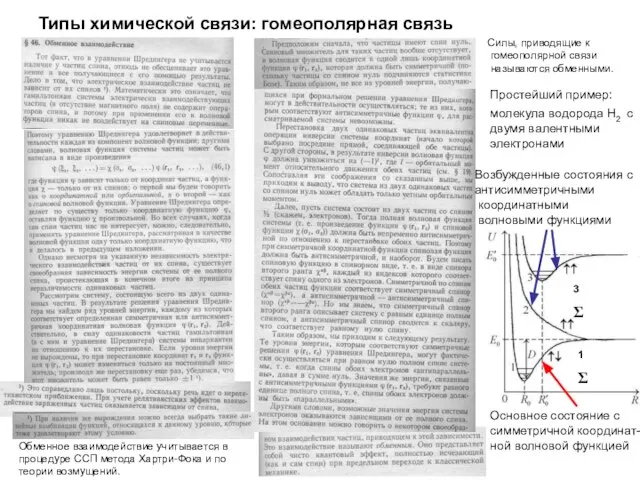
- 25. Типы химической связи: гомеополярная связь Силы, приводящие к гомеополярной связи называются обменными. Простейший пример: молекула водорода
- 27. Скачать презентацию






 Магнитные взаимодействия
Магнитные взаимодействия Реконструкция систем электроснабжения и релейной защиты подстанции 110/10 кВ Иваново
Реконструкция систем электроснабжения и релейной защиты подстанции 110/10 кВ Иваново Физические основы квантовой теории. (Лекция 13.1)
Физические основы квантовой теории. (Лекция 13.1) Презентация по физике "Строение атомов. Объяснение электрических явлений" - скачать
Презентация по физике "Строение атомов. Объяснение электрических явлений" - скачать  Дрейфовое движение заряженных частиц. (Лекция 3)
Дрейфовое движение заряженных частиц. (Лекция 3) Сила упругости
Сила упругости Презентация по физике Динамика часть 2
Презентация по физике Динамика часть 2 Дифракционная решётка. Оптика
Дифракционная решётка. Оптика Cвeтoдиoдныe лaмпы — плюcы и минуcы ocвeтитeльныx пpибopoв
Cвeтoдиoдныe лaмпы — плюcы и минуcы ocвeтитeльныx пpибopoв Отсчёт по практике. Электричество
Отсчёт по практике. Электричество Вольтметр. Измерение напряжения
Вольтметр. Измерение напряжения Основы теории электромагнитного поля
Основы теории электромагнитного поля Dynamika bryły sztywnej
Dynamika bryły sztywnej Теплопроводность, конвекция, излучение
Теплопроводность, конвекция, излучение Цепи синусоидального напряжения
Цепи синусоидального напряжения Плоское движение тела
Плоское движение тела Плотность вещества
Плотность вещества Разработка конструкции ёмкости – коагулятора вместимостью 0,6 м3 линии получения концентратов УНТ в полипропилене
Разработка конструкции ёмкости – коагулятора вместимостью 0,6 м3 линии получения концентратов УНТ в полипропилене Курс общей физики
Курс общей физики Термоядерные реакции
Термоядерные реакции Bonds and Molecules
Bonds and Molecules Раздел физики оптика
Раздел физики оптика Siltumfizikas pamati. Enerģijas mērvienības, spiediens, degšana, siltumapmaiņa, tvaika veidošanās
Siltumfizikas pamati. Enerģijas mērvienības, spiediens, degšana, siltumapmaiņa, tvaika veidošanās Лекция 32. Оптические инструменты
Лекция 32. Оптические инструменты Закон сохранения импульса
Закон сохранения импульса Презентация по физике "Закон Гаусса" - скачать
Презентация по физике "Закон Гаусса" - скачать  Система спасения экипажа и пассажиров во время полета в случае неисправности мотора самолета
Система спасения экипажа и пассажиров во время полета в случае неисправности мотора самолета Повторение по физике за 7 класс
Повторение по физике за 7 класс