Идеальный газ – теоретическая модель газа, в которой пренебрегают размерами
и взаимодействием частиц газа, а учитывают лишь их упругие столкновения.
Размеры молекул малы по сравнению с расстояниями между ними.
Силы взаимодействия проявляются только в момент соударений.
Молекулы распределены по всему объему равномерно.
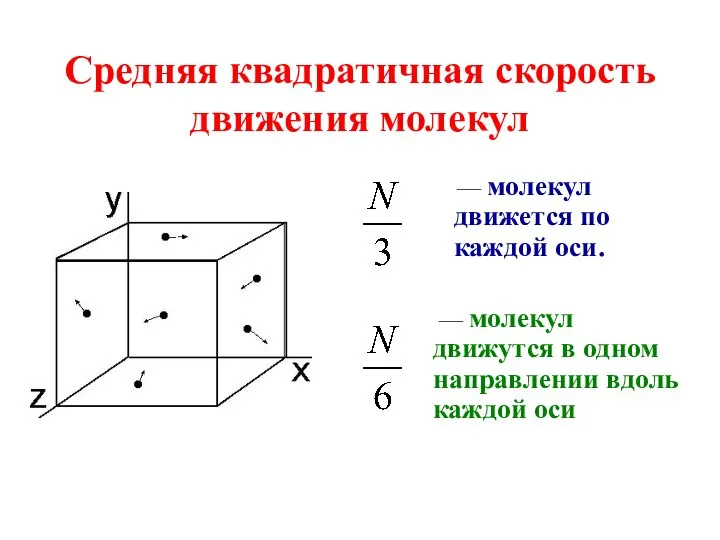
Молекулы газа движутся хаотично, то есть в любом направлении движется одинаковое число молекул
Скорости молекул могут принимать любые значения.
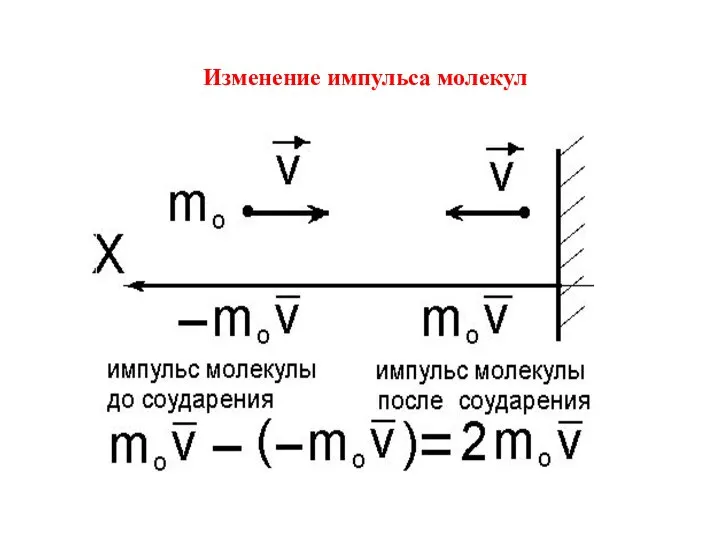
Соударения абсолютно упругие.
Число молекул очень велико.
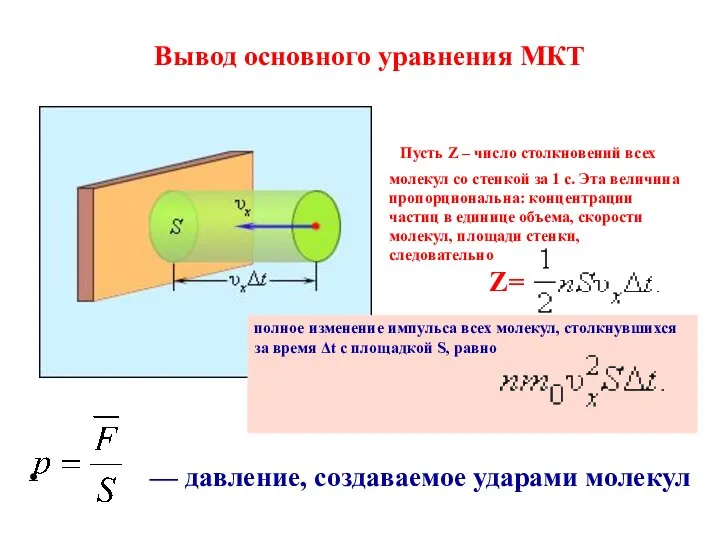
Для отдельно взятой молекулы справедливы законы Ньютона.










 Квантовая модель атома водорода. (Лекция 6)
Квантовая модель атома водорода. (Лекция 6) Рентгеновская дифрактометрия
Рентгеновская дифрактометрия Молекулярная физика и основы термодинамики. Основные газовые законы
Молекулярная физика и основы термодинамики. Основные газовые законы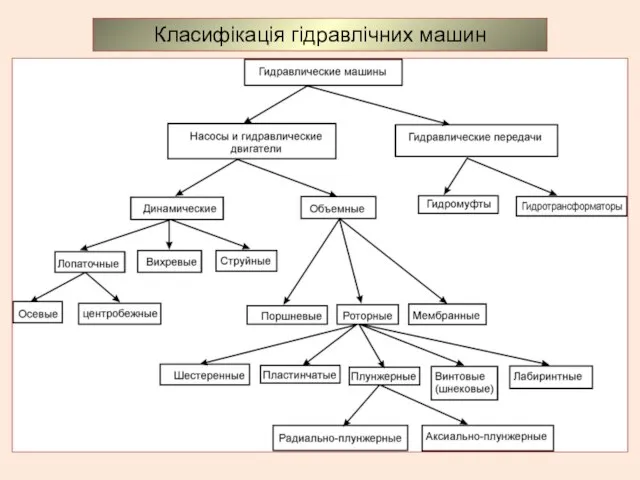 Класифікація гідравлічних машин. Насоси
Класифікація гідравлічних машин. Насоси Алюминий, его свойства и применение
Алюминий, его свойства и применение Вторая жизнь солнечным батареям
Вторая жизнь солнечным батареям Оборудование и технология получения наноматериалов из газовой фазы
Оборудование и технология получения наноматериалов из газовой фазы Характеристики излучения лазеров
Характеристики излучения лазеров Nikola Tesla
Nikola Tesla Бипризма Френеля
Бипризма Френеля Теплопроводность. Коэффициент теплопроводности
Теплопроводность. Коэффициент теплопроводности Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Что изучает физика. Некоторые физические термины, наблюдения и опыты Физика 7 класс
Что изучает физика. Некоторые физические термины, наблюдения и опыты Физика 7 класс Магнитное поле
Магнитное поле Волновая оптика. Интерференция волн от двух точечных источников
Волновая оптика. Интерференция волн от двух точечных источников Акустика помещений
Акустика помещений Равноускоренное движение
Равноускоренное движение Презентация Силы трения
Презентация Силы трения  Аккумулятор (лат. accumulator — жинақтауыш) - химиялық реакция энергиясын электр энергиясына айналдыратын аспап; ол электржәне
Аккумулятор (лат. accumulator — жинақтауыш) - химиялық реакция энергиясын электр энергиясына айналдыратын аспап; ол электржәне Силы в природе
Силы в природе Теорiя великого вибуху
Теорiя великого вибуху Движение заряженных частиц в постоянных электрическом и магнитном полях
Движение заряженных частиц в постоянных электрическом и магнитном полях Телескоп
Телескоп Брейн - ринг. Физика
Брейн - ринг. Физика Строение атомов, магнетизм микрочастиц, молекулярные спектры
Строение атомов, магнетизм микрочастиц, молекулярные спектры Виды трубопроводов
Виды трубопроводов Конденсация на вертикальной трубе
Конденсация на вертикальной трубе Презентация по физике "Электрический ток в жидкостях" - скачать
Презентация по физике "Электрический ток в жидкостях" - скачать