Содержание
- 2. 10.2 Уравнение состояния идеального газа Идеальным газом называется газ, в котором можно пренебречь взаимодействием между молекулами.
- 3. Из них следует, что в общем виде связь между P, V, T может быть записана как
- 4. Закон Авогадро Авогадро нашел, что моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.
- 5. Запишем уравнение состояния идеального газа (10.2.1) при нормальных условиях для 1 - го моля газа где
- 6. Получим уравнение состояния для произвольного объема газа V массой m. Если М – масса одного моля
- 7. Опытным путем найдено, что в 1-м моле вещества содержится число частиц, равное числу Авогадро Из пропорции
- 8. Величина называется постоянной Больцмана. Введем концентрацию молекул Тогда уравнение Клайперона-Менделеева примет вид
- 9. 10.7 Барометрическая формула Найдем закон изменения давления газа с высотой за счет влияния силы тяжести. Считаем
- 10. Из уравнения состояния идеального газа выразим плотность Тогда Разделяем переменные и интегрируем полученное дифференциальное уравнение
- 11. В результате находим Пусть h1 - высота на уровне моря, а Р1 – давление на уровне
- 12. 10.8 Распределение Больцмана Согласно уравнению состояния идеального газа P = nkT давление пропорционально концентрации молекул газа
- 13. 11. Основы термодинамики 11.1 Первое начало термодинамики При термодинамическом описании свойств макросистем используют закономерности, наблюдающиеся в
- 14. Внутренняя энергия макросистемы U состоит из двух частей: 1) кинетической энергии хаотического движения молекул в системе
- 15. Разобьем макросистему на достаточно большие части. Поскольку межмолекулярные силы короткодействующие, то потенциальной энергией взаимодействия между частями
- 16. Внутренняя энергия U обладает еще одним свойством – она является функцией состояния. Это значит, что величина
- 17. Из закона сохранения энергии следует, что изменение внутренней энергии системы ΔU при ее переходе из начального
- 18. Если ΔU > 0, то совершенная системой работа меньше полученного количества теплоты, то есть Q >
- 19. Пусть макросистема совершает процесс, в ходе которого она периодически возвращается в исходное состояние, тогда ее внутренняя
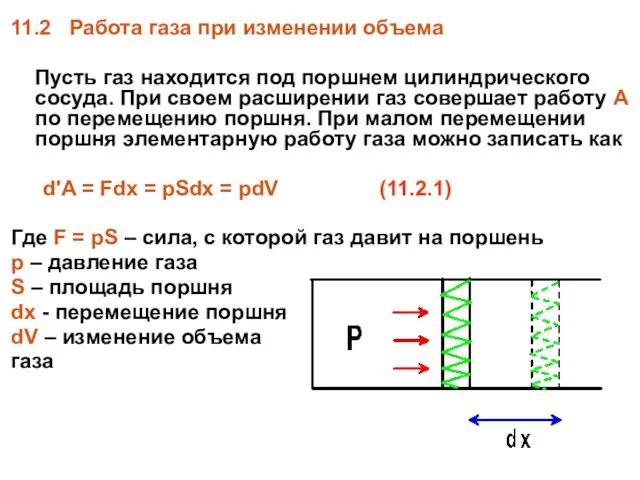
- 20. 11.2 Работа газа при изменении объема Пусть газ находится под поршнем цилиндрического сосуда. При своем расширении
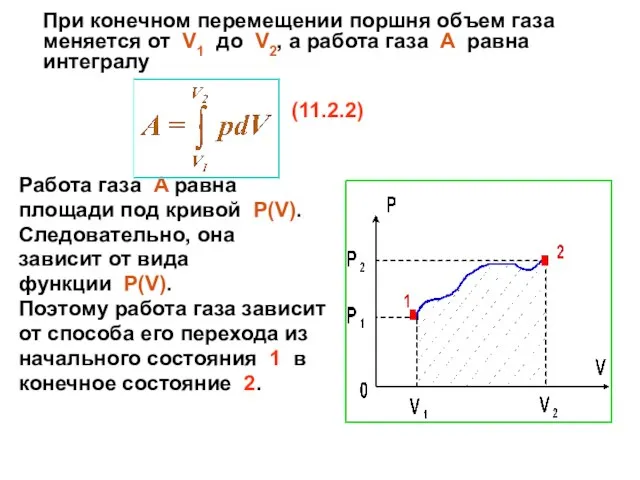
- 21. При конечном перемещении поршня объем газа меняется от V1 до V2, а работа газа A равна
- 22. 11.3 Теплоемкость идеального газа Теплоемкость равна количеству теплоты, которое нужно передать телу, чтобы повысить его температуру
- 23. Молярная теплоемкость – количество теплоты, необходимое для нагревания 1 моля вещества на 1° К (11.3.3) где
- 24. Теплоемкость зависит от условий измерения. Различают молярную теплоемкость при постоянном объеме cV и постоянном давлении cP
- 25. Введем отношение Величина γ называется постоянной адиабаты.
- 26. 11.4 Число степеней свободы Числом степеней свободы механической системы называется число независимых величин, с помощью которых
- 27. У системы из N невзаимодействующих материальных точек имеется 3N степеней свободы. Если между 2-мя точками имеется
- 28. У системы из N упруго связанных точек имеется 3N степеней свободы, из которых: 3 степени –
- 29. Теперь рассмотрим молекулы. При определении числа степеней свободы молекулы входящие в нее атомы надо рассматривать как
- 30. Если два атома в двухатомной молекуле связаны не жестко, а упруго, то расстояние между атомами может
- 31. среднее значение кинетической энергии поступательного движения молекулы идеального газа равно Так как все 3 поступательные степени
- 32. Например, на 1 вращательную степень свободы тоже приходится энергия, равная . У молекулы, испытывающей колебания, имеется
- 33. В идеальном газе молекулы не взаимодействуют друг с другом, поэтому его внутренняя энергия равна сумме энергий
- 34. Учтем, что для идеального газа сР = сV + R , поэтому (11.4.6) Следовательно, обе молярные
- 35. 11.9 Цикл Карно Рассмотрим прямой обратимый процесс, состоящий из двух изотерм и двух адиабат. Такой цикл
- 36. Следовательно, КПД в цикле Карно зависит только от температур нагревателя Т1 и холодильника T2 , но
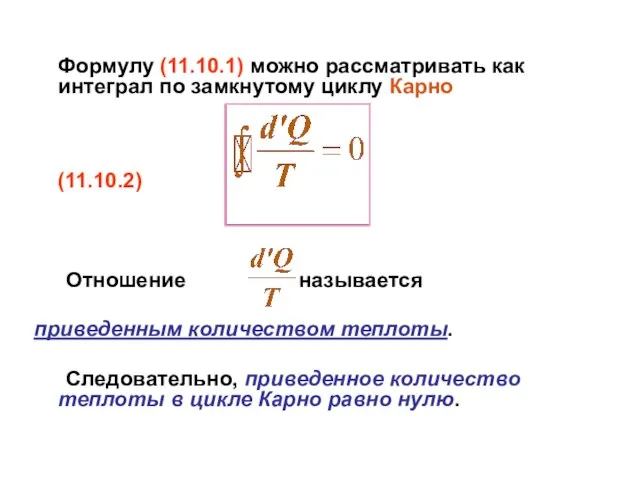
- 37. 11.10 Энтропия. 2-е начало термодинамики Рассмотрим соотношение (11.9.2), полученное для цикла Карно где Т1 – температура
- 38. Формулу (11.10.1) можно рассматривать как интеграл по замкнутому циклу Карно (11.10.2) Отношение называется приведенным количеством теплоты.
- 39. Обозначим его как (11.10.3) где функция S называется энтропией. Понятие энтропии ввел Клаузиус в 1865 г.
- 40. Если процесс не замкнутый, то при переходе из начального состояния 1 в конечное состояние 2 энтропия
- 41. Для изолированной (замкнутой) системы, не обменивающейся теплом с окружающими телами Если при этом процесс, совершаемый замкнутой
- 42. Если же изолированная система совершает необратимый процесс, то ее энтропия всегда возрастает Объединяя результаты для обратимого
- 43. Все реальные процессы необратимы, поэтому они протекают так, что энтропия замкнутой системы возрастает. Второе начало термодинамики
- 45. Скачать презентацию







































 Биофизика мембран. Функции мембран. Транспорт веществ через мембраны. Потенциалы покоя и действия
Биофизика мембран. Функции мембран. Транспорт веществ через мембраны. Потенциалы покоя и действия ПРЕЗЕНТАЦИЮ ПО ФИЗИКЕ на тему: « СОЗДАНИЕ ВЕЧНОГО ДВИГАТЕЛЯ» Подготовила Ученица 10 класс МОУ СОШ п. Гаврилово Басс Людмила
ПРЕЗЕНТАЦИЮ ПО ФИЗИКЕ на тему: « СОЗДАНИЕ ВЕЧНОГО ДВИГАТЕЛЯ» Подготовила Ученица 10 класс МОУ СОШ п. Гаврилово Басс Людмила Строительство ВОЛС на участке
Строительство ВОЛС на участке Презентация по физике "Трансформаторы" - скачать бесплатно
Презентация по физике "Трансформаторы" - скачать бесплатно Момент силы. Правило момента
Момент силы. Правило момента Модель Бабы Яги с резиномоторным двигателем
Модель Бабы Яги с резиномоторным двигателем Движение - в самом общем виде- изменение вообще
Движение - в самом общем виде- изменение вообще Динамика. Задачи
Динамика. Задачи История фотоаппарата
История фотоаппарата Левитация проводящего кольца в переменном магнитном поле
Левитация проводящего кольца в переменном магнитном поле Тема 7. Вибрация. Акустические величины. Электромагнитные поля курс лекций по учебной дисциплине «Основы безопасности труда» д
Тема 7. Вибрация. Акустические величины. Электромагнитные поля курс лекций по учебной дисциплине «Основы безопасности труда» д РПД и РУПД Чтение графиков движения
РПД и РУПД Чтение графиков движения Аттестационная работа. Образовательная программа (элективный курс) для 9 класса Основы кинематики и динамики
Аттестационная работа. Образовательная программа (элективный курс) для 9 класса Основы кинематики и динамики Потенциал электростатического поля. Разность потенциалов
Потенциал электростатического поля. Разность потенциалов Распространение мощного лазерного излучения в атмосфере
Распространение мощного лазерного излучения в атмосфере Формула пути
Формула пути Индикаторы. Промышленные регуляторы
Индикаторы. Промышленные регуляторы Упругие и квазиупругие силы. Закон Гука. Гармонические колебания: частота, период, амплитуда и фаза колебаний
Упругие и квазиупругие силы. Закон Гука. Гармонические колебания: частота, период, амплитуда и фаза колебаний Системы впрыска топлива Motronic 1.1 - 1.3; 1.7; 3.1
Системы впрыска топлива Motronic 1.1 - 1.3; 1.7; 3.1 Методы измерения длительности люминесценции
Методы измерения длительности люминесценции 15 минут про структуру атома
15 минут про структуру атома Электрический ток. (Лекция 8)
Электрический ток. (Лекция 8) Энергия электрического поля
Энергия электрического поля Основы молекулярно-кинетической теории. Лекция 7
Основы молекулярно-кинетической теории. Лекция 7 МОУ «Основная общеобразовательная школа №9» Электромагнитное излучение Рентгеновские излучения Выполнил : ученик 8 класса Ники
МОУ «Основная общеобразовательная школа №9» Электромагнитное излучение Рентгеновские излучения Выполнил : ученик 8 класса Ники Тема урока: «Построение изображений в линзах» Цель урока: сформировать практические умения применять знания о свойствах линз для
Тема урока: «Построение изображений в линзах» Цель урока: сформировать практические умения применять знания о свойствах линз для  Эффект Доплера
Эффект Доплера Комплексные методы анализа ГХ-МС и ВЭЖХ-МС
Комплексные методы анализа ГХ-МС и ВЭЖХ-МС