Содержание
- 2. Основы молекулярно-кинетической теории идеального газа. Термодинамическая (макроскопическая) система. Статистическая физика и термодинамика. Масса и размеры молекул.
- 3. 1. Термодинамическая (макроскопическая) система. Термодинамическая система - совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как
- 4. 2. Статистическая физика и термодинамика. Масса и размеры молекул. Молекулярная физика и термодинамика — разделы физики,
- 5. Статистический, и термодинамический методы. Статистический (основа молекулярной физики) - метод исследования систем, состоящих из большого числа
- 6. 3. Физический смысл термодинамической температуры. Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и
- 7. Шкала Фаренгейта Была предложена в 1709 году немецким учёным Габриэлем Фаренгейтом. По этой шкале за ноль
- 8. Шкала Реомюра Предложена в 1731 году французским учёным Рене де Реомюром. За нижнюю реперную точку была
- 9. Шкала Цельсия Предложена в 1742 году шведским астрономом Андерсом Цельсием. За ноль принималась температура смеси воды
- 10. Шкала Кельвина Предложена в 1848 году английским ученым Уильямом Томсоном (он же лорд Кельвин) как более
- 11. Шкала Ранкина Была предложена шотландским инженером и физиком Уильямом Ранкином. Ноль ее совпадает с нолем термодинамической
- 12. Диаграмма перевода температур
- 13. Температура некоторых объектов
- 14. 4. Законы идеального газа (основные газовые законы). Основные положения молекулярно-кинетической теории: 1. Все вещества состоят из
- 15. Атом - наименьшая часть химического элемента, являющаяся носителем его свойств. Молекула - наименьшая устойчивая частица вещества,
- 16. Постоянная (число) Авогадро NA = 6,02 • 1023 моль-1 - число атомов (молекул или других структурных
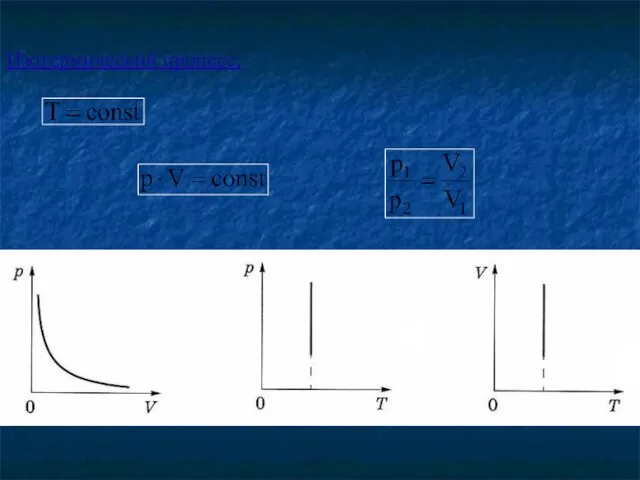
- 17. Закон Бойля-Мариотта для изотермического процесса - для данной массы газа при постоянной температуре произведение давления газа
- 18. Изотермический процесс:
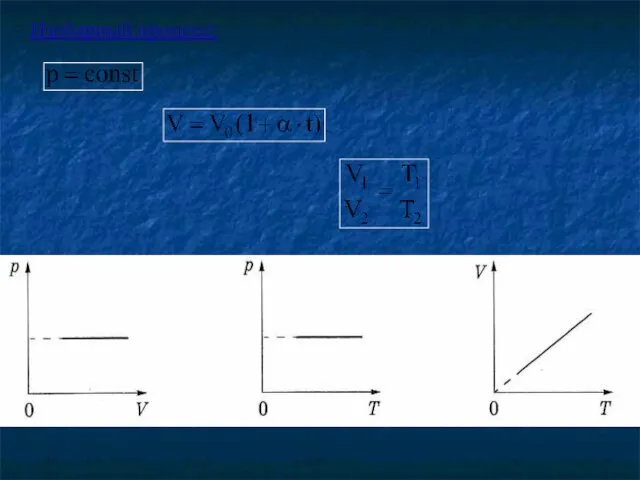
- 19. Закон Гей-Люссака для изобарного процесса - при постоянном давлении, объем данной массы газа изменяется линейно с
- 20. Изобарный процесс:
- 21. Закон Шарля (закон Гей-Люссака для изохорного процесса) - при постоянном объеме, давление данной массы газа изменяется
- 22. Изохорный процесс:
- 23. Закон Авогадро - моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. Закон Дальтона
- 24. 5. Уравнение состояния идеального газа. Уравнение состояния идеального газа (уравнение Клапейрона): Уравнение Клапейрона-Менделеева (уравнение состояния) для
- 26. Скачать презентацию





















 Основы термодинамики необратимых процессов
Основы термодинамики необратимых процессов Опыт со стаканом Описание опыта. Налейте в стакан воды, закройте листом бумаги и, поддерживая лист рукой, переверните стакан вв
Опыт со стаканом Описание опыта. Налейте в стакан воды, закройте листом бумаги и, поддерживая лист рукой, переверните стакан вв Тепломассообмен. Теплопроводность через плоские и цилиндрические стенки
Тепломассообмен. Теплопроводность через плоские и цилиндрические стенки Основные положения молекулярно – кинетической теории
Основные положения молекулярно – кинетической теории Струм в газах та вакуумі
Струм в газах та вакуумі Виды телескопов
Виды телескопов Электромагнитное поле
Электромагнитное поле Модельный ряд двигателей ЗМЗ
Модельный ряд двигателей ЗМЗ Презентация по физике на тему: «Свойства звуковой волны». Выполнена ученицей 9-1 класса Зайцевой Верой.
Презентация по физике на тему: «Свойства звуковой волны». Выполнена ученицей 9-1 класса Зайцевой Верой. Тепловые двигатели и их применение. (10 класс)
Тепловые двигатели и их применение. (10 класс) Структурная схема машин. Механические передачи
Структурная схема машин. Механические передачи Теплота парообразования. Сжижение газов. Влажность воздуха
Теплота парообразования. Сжижение газов. Влажность воздуха Векторные функции скалярного аргумента
Векторные функции скалярного аргумента Энергетические характеристики электрического поля
Энергетические характеристики электрического поля Оценка навигационных параметров множественных источников широкополосного радиоизлучения
Оценка навигационных параметров множественных источников широкополосного радиоизлучения Качественные задачи по физике
Качественные задачи по физике Тема4-2 Деформационные барометры
Тема4-2 Деформационные барометры Физико-химическое явление - электролиз
Физико-химическое явление - электролиз Технологическое использование конденсированных ВВ. Использование взрыва в военных и мирных целях. (Раздел 3.9)
Технологическое использование конденсированных ВВ. Использование взрыва в военных и мирных целях. (Раздел 3.9) Физико-химическое явление электролиз
Физико-химическое явление электролиз Ножницы как рычаг
Ножницы как рычаг РАБОТА И МОЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ТОКА
РАБОТА И МОЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ТОКА  Взаимодействие токов. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции
Взаимодействие токов. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции Свободное падение тел. Движение с ускорением свободного падения
Свободное падение тел. Движение с ускорением свободного падения Физика. Карта курса
Физика. Карта курса Радиоактивность. Модели атомов. Опыт Резерфорда. Радиоактивные превращения ядер
Радиоактивность. Модели атомов. Опыт Резерфорда. Радиоактивные превращения ядер Интерференция света Разработана: учителем физики Глушак Г. Н., ГБОУ СОШ №306
Интерференция света Разработана: учителем физики Глушак Г. Н., ГБОУ СОШ №306 Атом, атомное ядро, атомная энергия
Атом, атомное ядро, атомная энергия