Содержание
- 2. Атом ( с греческого «неделимый») Обыкновенно мы говорим о сладком и горьком, о теплом и холодном,
- 3. Моле́кула (новолатинское molecula, уменьшительное от лат. moles — масса) Пьер Гассенди (1592 — 1655) не только
- 4. М.В.Ломоносов (1711 - 1765) "Наиболее удачно, - говорит профессор Меньшуткин, - разработаны Ломоносовым два основных вопроса
- 5. Амедео Авогадро ( 1776-1856) «одинаковые объёмы различных газов, при одинаковых температурах и давлениях, содержат одинаковое число
- 6. Людвиг Больцман ( 1844-1906) "Тепловая смерть - блеф. Никакого конца света не предвидится. Вселенная существовала и
- 7. Все тела состоят из отдельных частиц, между которыми есть промежутки…
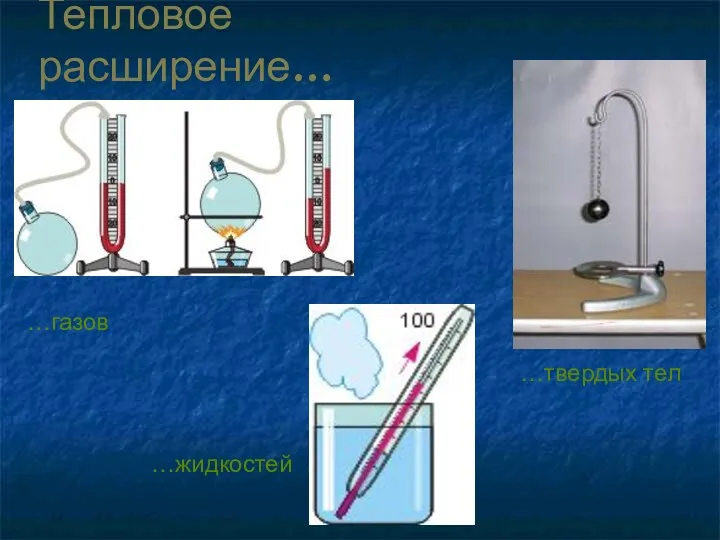
- 8. Тепловое расширение… …газов …твердых тел …жидкостей
- 9. Между молекулами есть промежутки
- 10. Испарение жидкости
- 11. Диаметр молекул воды составляет приблизительно
- 14. Если молекулу увеличить до размера яблока…. …то яблоко вырастет до размера Земного шара
- 15. Электронный микроскоп – заглянем в глубины вещества
- 16. Так выглядят атомы под микроскопом золото платина никель углерод Разные атомы
- 17. Масса Масса молекулы Относительная молекулярная масса Молярная масса Масса вещества
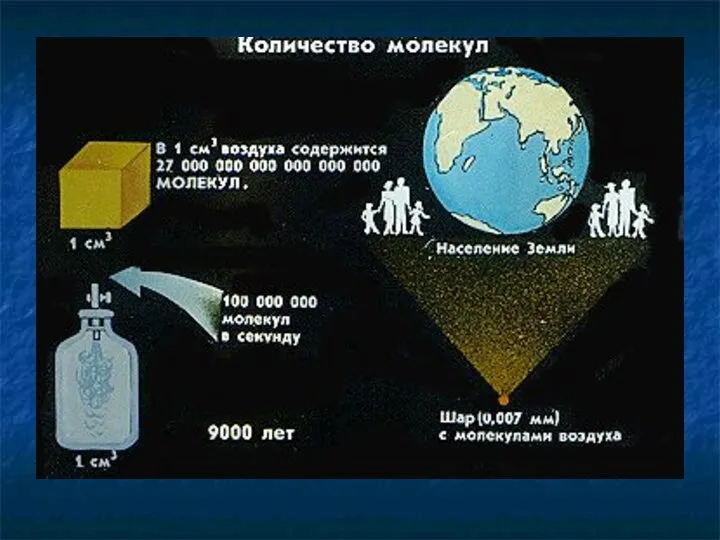
- 18. Количество молекул Количество молекул Число Авогадро Концентрация
- 20. Количество вещества Относительная величина, которая показывает, во сколько раз число молекул в данном теле отличается от
- 21. Количество молекул Количество молекул Число Авогадро – количество молекул в одном моле любого вещества. Универсальная физическая
- 22. Масса Масса молекулы Относительная молекулярная масса – величина, которая показывает во сколько раз масса молекулы данного
- 23. Создание веществ с заранее известными свойствами
- 24. Молекулы движутся непрерывно и хаотично.
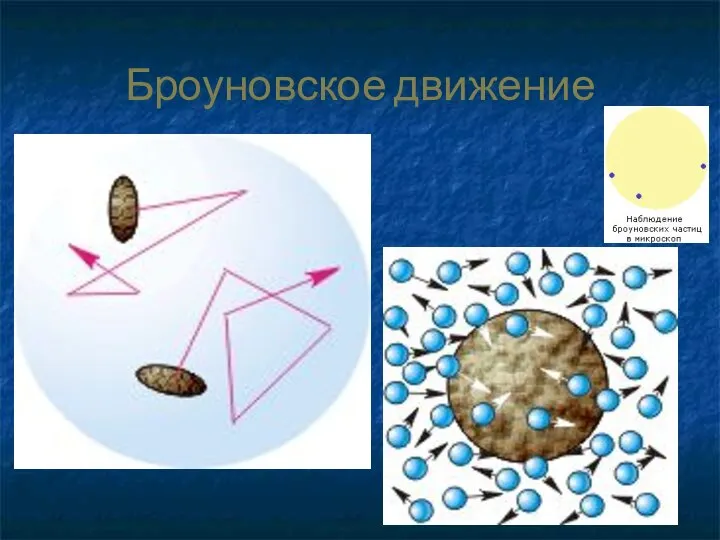
- 27. Броуновское движение
- 28. Однажды я поместил каплю воды на стеклышко микроскопа и насыпал в нее немного цветочной пыльцы. Я
- 29. Молекулы взаимодействуют друг с другом: притягиваются и отталкиваются
- 38. Скачать презентацию
































 Отношение сигнал-шум на выходе приёмника ЧМ сигнала
Отношение сигнал-шум на выходе приёмника ЧМ сигнала Открытие радиоактивности. Радиоактивные превращения СОСТАВИЛА УЧИТЕЛЬ ФИЗИКИ МБОУ МСОШ: МУХИНА ВАЛЕНТИНА ВЛАДИМИРОВНА ФИЗИКА
Открытие радиоактивности. Радиоактивные превращения СОСТАВИЛА УЧИТЕЛЬ ФИЗИКИ МБОУ МСОШ: МУХИНА ВАЛЕНТИНА ВЛАДИМИРОВНА ФИЗИКА  Лекция № 3 Принцип корпускулярно-волнового дуализма Л. де Бройля и его экспериментальное подтверждение
Лекция № 3 Принцип корпускулярно-волнового дуализма Л. де Бройля и его экспериментальное подтверждение Арматура и ее свойства. Робот для вязки арматуры (9 класс)
Арматура и ее свойства. Робот для вязки арматуры (9 класс) Шкала электромагнитных излучений
Шкала электромагнитных излучений Ценностные и правовые регулятивы развития новых технологий и направлений науки. Тема 5
Ценностные и правовые регулятивы развития новых технологий и направлений науки. Тема 5 Показатели качества регулирования. Точность регулирования
Показатели качества регулирования. Точность регулирования Общие физические модели
Общие физические модели Основные законы для расчета цепей постоянного тока
Основные законы для расчета цепей постоянного тока Волновые свойства света
Волновые свойства света Испарение, влажность
Испарение, влажность Голограмма – чудо современной оптики
Голограмма – чудо современной оптики Торговое оборудование. Холодильные машины и оборудование. Способы получения холода
Торговое оборудование. Холодильные машины и оборудование. Способы получения холода Механические колебания
Механические колебания Заболевания молочных желёз. Взгляд гинеколога
Заболевания молочных желёз. Взгляд гинеколога Исследовательская работа. Создание радуги в домашних условиях
Исследовательская работа. Создание радуги в домашних условиях Механическое движение. Плотность вещества. Решение задач, 7 класс
Механическое движение. Плотность вещества. Решение задач, 7 класс Ресурсный центр по учебному предмету физика
Ресурсный центр по учебному предмету физика Экспериментальная проверка закона Джоуля-Ленца
Экспериментальная проверка закона Джоуля-Ленца Истечение газов и паров
Истечение газов и паров Аэродинамические расчеты
Аэродинамические расчеты Температура и термометры
Температура и термометры харчування під час радіоактивної небезпеки Підготувала учениця 302 групи Авіакосмічного ліцею ім.І.Сікорського НАУ Гріднєва А
харчування під час радіоактивної небезпеки Підготувала учениця 302 групи Авіакосмічного ліцею ім.І.Сікорського НАУ Гріднєва А Антеннаның негізгі параметрлері мен сипаттамалары
Антеннаның негізгі параметрлері мен сипаттамалары Механические колебания. Волны
Механические колебания. Волны Элементы кинетической теории газов. (Лекция 2)
Элементы кинетической теории газов. (Лекция 2) Генератор переменного тока
Генератор переменного тока Специальная теория относительности
Специальная теория относительности