Содержание
- 2. Основы молекулярно-кинетической теории Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах
- 3. В основе МКТ строения вещества лежат три положения: Вещество состоит из частиц – молекул, атомов и
- 4. Первое положение МКТ Молекула – наименьшая устойчивая частица данного вещества. Молекула обладает основными химическими свойствами вещества.
- 5. Второе положение МКТ Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении
- 6. Третье положение МКТ Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются
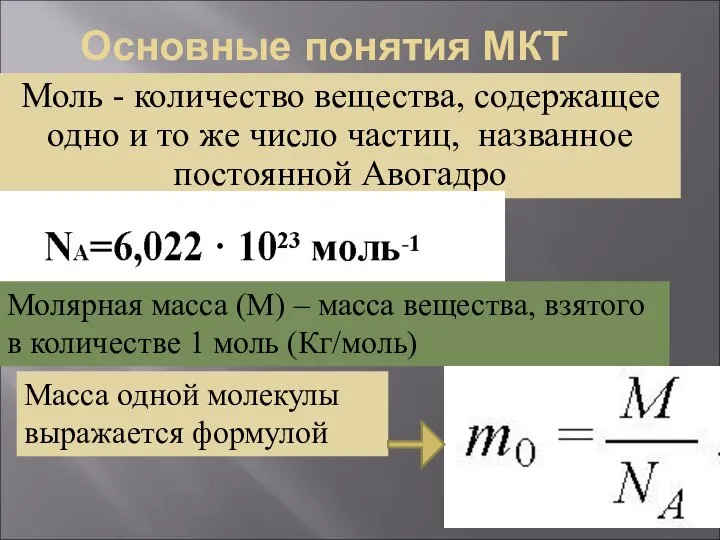
- 7. Основные понятия МКТ Моль - количество вещества, содержащее одно и то же число частиц, названное постоянной
- 8. Основные понятия МКТ Количеством вещества ν называется отношение числа молекул N к числу Авогадро NA :
- 9. Явления переноса В термодинамических системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит
- 10. Явления переноса 1.Теплопроводность – это процесс переноса тепловой энергии, обусловленный хаотическим движением молекул Перенос энергии в
- 11. λ –теплопроводность (лямбда) (коэффициент теплопроводности ) (48.1) отражает свойство вещества проводить тепловую энергию. Чем больше значение
- 12. Тепловое сопротивление и изоляция тепловое сопротивление, способность тела (его поверхности или какого-либо слоя) препятствовать распространению теплового
- 13. Явления переноса 2.Диффузия – это обусловленное тепловым движением молекул проникновение одних веществ в объём, занятый другими
- 14. Коэффициент диффузии ( jm — плотность потока массы D —коэффициент диффузии dρ/dx — градиент плотности Коэффициент
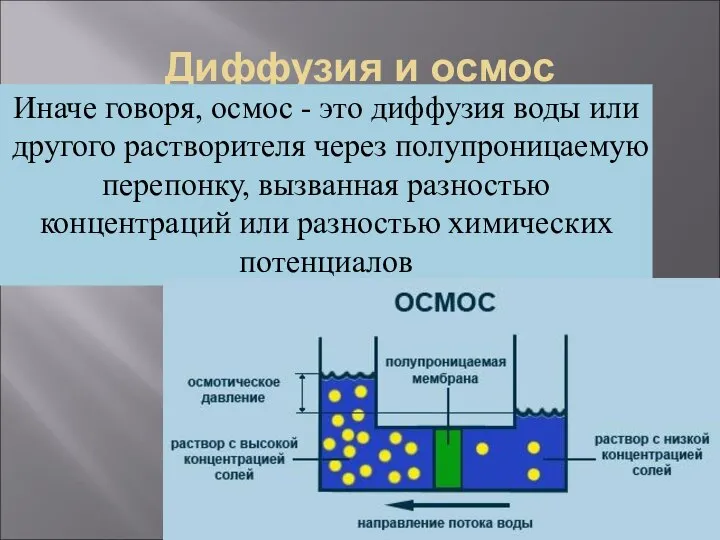
- 15. Диффузия и осмос В том случае, если диффундирующие вещества встречают на своем пути мембрану, движение замедляется,
- 16. Диффузия и осмос Иначе говоря, осмос - это диффузия воды или другого растворителя через полупроницаемую перепонку,
- 19. Явления переноса 3.Внутреннее трение (вязкость) возникает вследствие переноса импульса молекул между слоями сила внутреннего трения между
- 20. Вязкость жидкости В реальной жидкости вследствие взаимного притяжения и движения молекул место внутреннее трение
- 21. Вязкость жидкости Оно проявляется как сила сопротивления при помешивании жидкости, вызывает замедление движущихся в ней тел
- 22. Вязкость жидкости Сила внутреннего трения Fв возникающая в плоскости соприкосновения двух, скользящих относительно друг друга, слоев
- 23. Коэффициент вязкости η есть величина, численно равная силе трения, возникающей между двумя слоями текущей жидкости, соприкасающимися
- 24. Вязкость жидкостей измеряют путем наблюдения за их течением в тонких трубках. В основе измерений лежит закон
- 26. Измерение коэффициента вязкости исследуемой жидкости вискозиметром Оствальда осуществляется путем сравнения с известным коэффициентом вязкости другой жидкости,
- 27. Идеальным газом называется газ, в котором молекулы движутся свободно и взаимодействуют между собой и со стенками
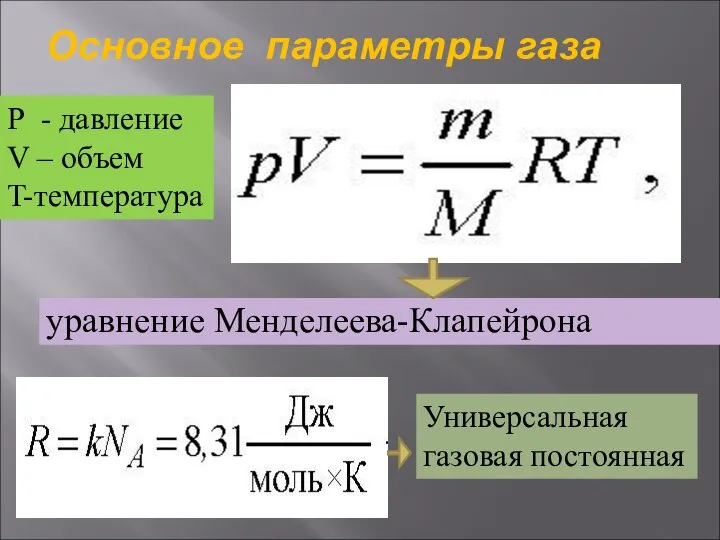
- 28. Основное параметры газа уравнение Менделеева-Клапейрона Р - давление V – объем T-температура Универсальная газовая постоянная
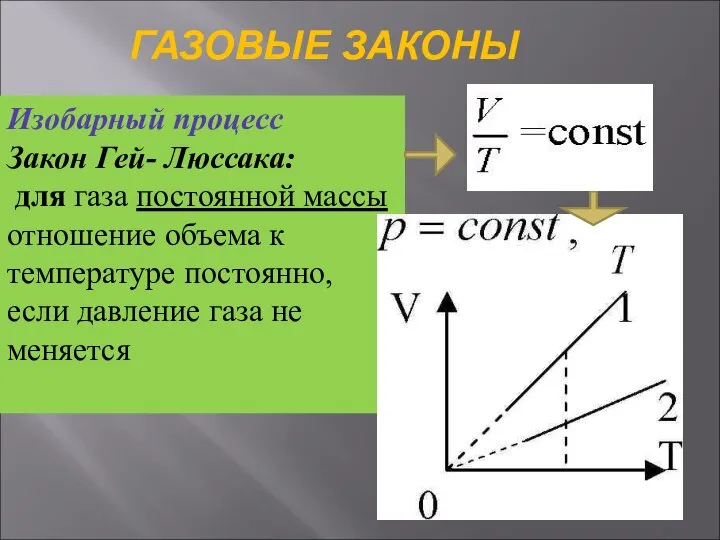
- 29. ГАЗОВЫЕ ЗАКОНЫ Изобарный процесс Закон Гей- Люссака: для газа постоянной массы отношение объема к температуре постоянно,
- 30. ГАЗОВЫЕ ЗАКОНЫ Изохорный процесс Закон Шарля: для газа постоянной массы отношение давления к температуре постоянно, если
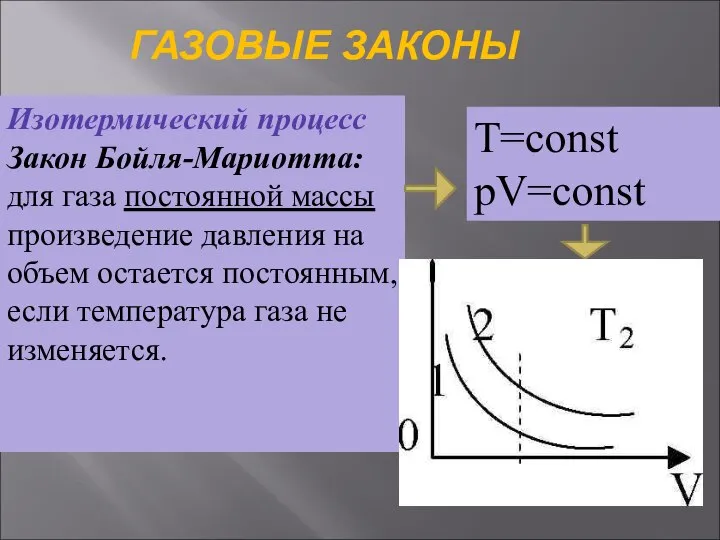
- 31. ГАЗОВЫЕ ЗАКОНЫ Изотермический процесс Закон Бойля-Мариотта: для газа постоянной массы произведение давления на объем остается постоянным,
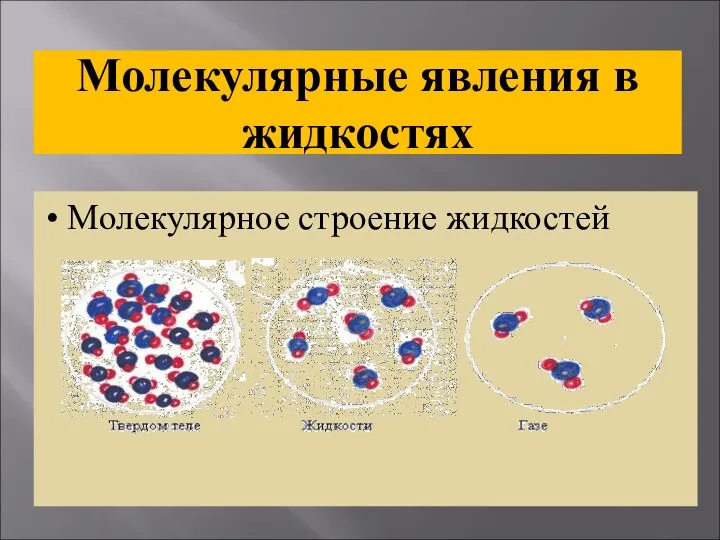
- 32. Молекулярные явления в жидкостях Молекулярное строение жидкостей
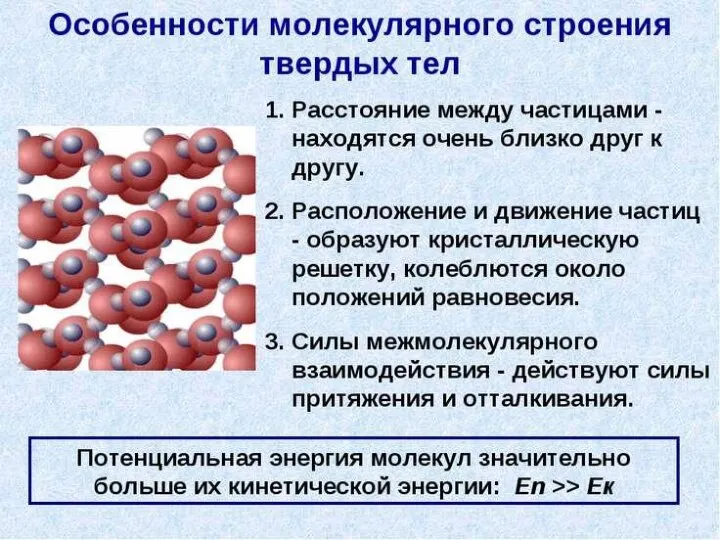
- 33. Молекулярное строение жидкостей Молекулы жидкости расположены близко друг к другу притяжение между ними не так велико
- 35. Поверхностное натяжение
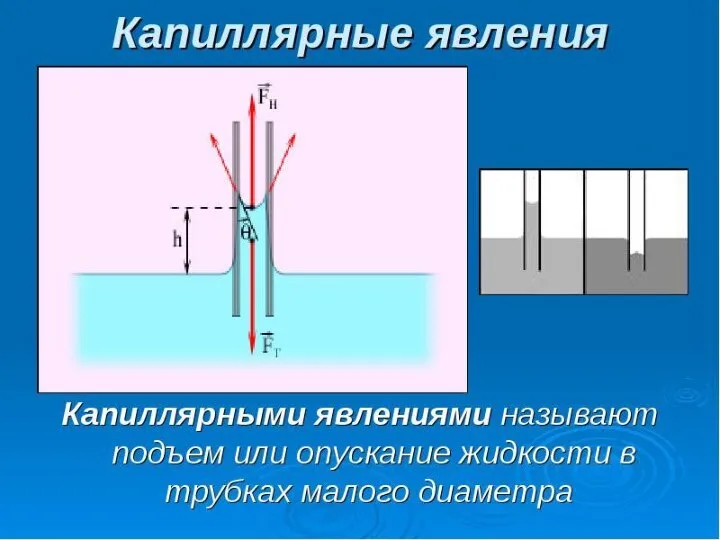
- 37. Капиллярные явления
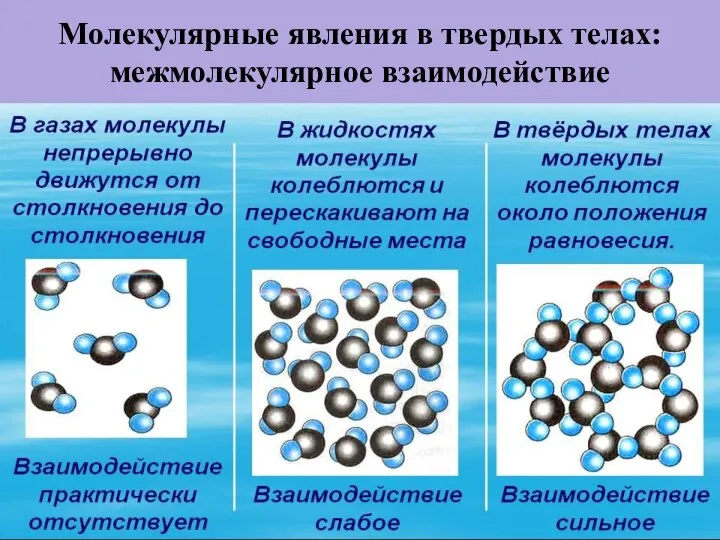
- 39. Молекулярные явления в твердых телах: межмолекулярное взаимодействие
- 42. Механические свойства твердых тел
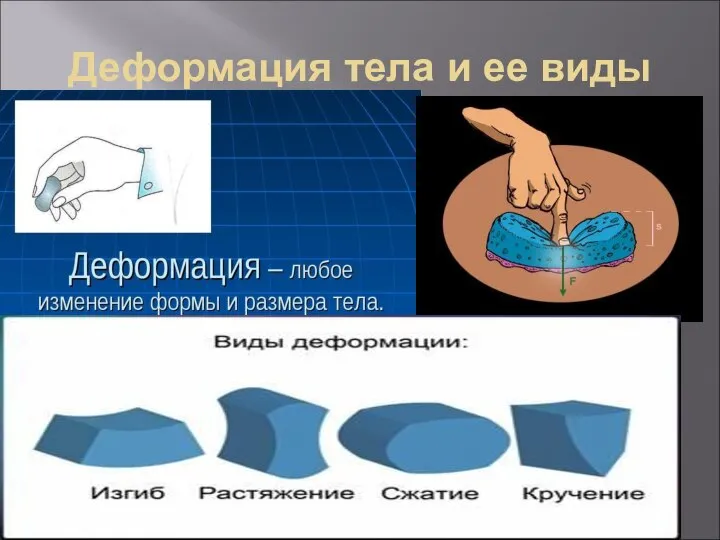
- 43. Деформация тела и ее виды
- 44. Термодинамика рассматривает общие закономерности превращения энергии в форме тепла и работы между телами
- 49. Вечный двигатель первого рода -устройство, способное бесконечно совершать работу-устройство, способное бесконечно совершать работу без затрат топлива
- 52. Энтропия замкнутой системы, т.е. системы, которая не обменивается с окружением ни энергией ни веществом, постоянно возрастает
- 55. Применение второго закона к биологическим системам в его классической формулировке приводит, как кажется на первый взгляд,
- 56. Илья Романович Пригожин (25 января(25 января 1917(25 января 1917, Москва(25 января 1917, Москва — 28 мая(25
- 58. Что такое синергетика Древнее понятие «синергия» означает объединение человеческой и божественной энергии. Сегодня «синергетика» трактуется как
- 59. Сущность второго закона термодинамики Замкнутая (или изолированная) система (где отсутствуют обменные процессы со средой) развивается в
- 60. законы физики, справедливы только для замкнутых систем!!! Систем вероятностного типа способны обмениваться со средой энергией, веществом
- 61. Нестабильный период системы Нестабильность (кризис) возникает тогда, когда система утрачивает свою продуктивность и возникает необходимость изменения
- 62. Нестабильный период В этом случае система находится в состоянии кризиса – нестабильности. Её поведение рождает множество
- 63. Основные положения синергетики синергетическая система может находиться в разные моменты времени в состоянии адаптационного (стабильного) или
- 64. Основные положения синергетики однако, ими можно эффективно управлять при помощи слабых резонансных воздействий, которые влияют на
- 65. Основные положения синергетики Неустойчивость - путь к выживанию, самообновлению, развитию и согласованию всех ее составных частей
- 67. Скачать презентацию






















































 Банк формул по физике
Банк формул по физике Агрегатні стани речовини. Фізичні властивості тіл у різних агрегатних станах. Кристалічні та аморфні тіла
Агрегатні стани речовини. Фізичні властивості тіл у різних агрегатних станах. Кристалічні та аморфні тіла УРОК ФИЗИКИ ПО ТЕМЕ «МАГНИТНОЕ ПОЛЕ ТОКА»
УРОК ФИЗИКИ ПО ТЕМЕ «МАГНИТНОЕ ПОЛЕ ТОКА» Постановка задачи оптимизации
Постановка задачи оптимизации Понятие бионика
Понятие бионика Прямолинейное равноускоренное движение. Ускорение
Прямолинейное равноускоренное движение. Ускорение Funnel and ball
Funnel and ball Биофизическое воздействие переменного электрического поля
Биофизическое воздействие переменного электрического поля Основы строительной физики
Основы строительной физики Фрагмент презентации «Интерференция света» физика 11 класс Включает этапы: Подготовка к усвоению нового материала Изучение
Фрагмент презентации «Интерференция света» физика 11 класс Включает этапы: Подготовка к усвоению нового материала Изучение  Біртекті емес электр µрісіндегі газдыќ күшейту
Біртекті емес электр µрісіндегі газдыќ күшейту Взаимодействие излучения с атомными системами
Взаимодействие излучения с атомными системами Энергия ветра и возможности ее использования
Энергия ветра и возможности ее использования Спектроскопические методы
Спектроскопические методы Отчёт по учебной практике на тему: Устройство и принцип действия системы охлаждения Лада Калина
Отчёт по учебной практике на тему: Устройство и принцип действия системы охлаждения Лада Калина Интерференция света и волн. Задачи
Интерференция света и волн. Задачи Поисково-исследовательский метод используемый на уроках физики
Поисково-исследовательский метод используемый на уроках физики Ультразвук. Источники ультразвука
Ультразвук. Источники ультразвука Корпускулярные свойства рентгеновского излучения
Корпускулярные свойства рентгеновского излучения Напряженность электрического поля. Принцип суперпозиции электрических полей
Напряженность электрического поля. Принцип суперпозиции электрических полей Занимательная физика. Задачи
Занимательная физика. Задачи Звук как физическое явление
Звук как физическое явление Кинематика твердого тела. Плоское движение
Кинематика твердого тела. Плоское движение Лекция №3. Принцип Гюйгенса в виде формулы Кирхгофа. Зоны Френеля. Определение зон Френеля
Лекция №3. Принцип Гюйгенса в виде формулы Кирхгофа. Зоны Френеля. Определение зон Френеля Физические велечины. Задания
Физические велечины. Задания Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения Применение ядерной энергии
Применение ядерной энергии Что за знаки перед нами?
Что за знаки перед нами?