Содержание
- 2. Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних
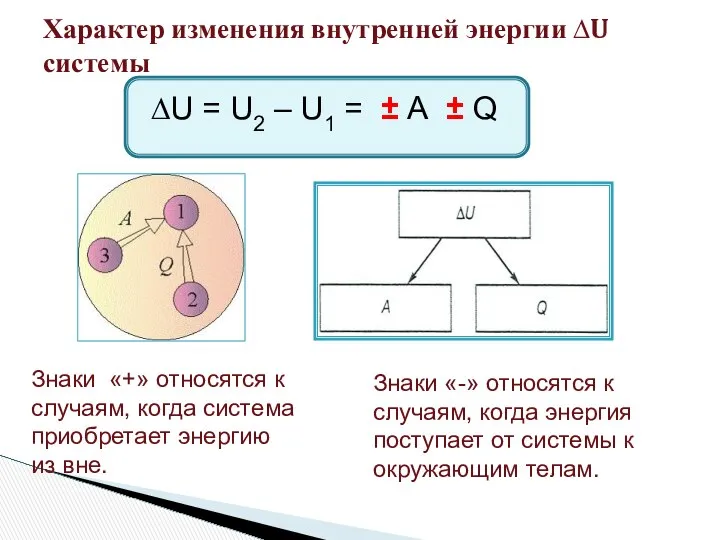
- 3. Характер изменения внутренней энергии ∆U системы ∆U = U2 – U1 = ± А ± Q
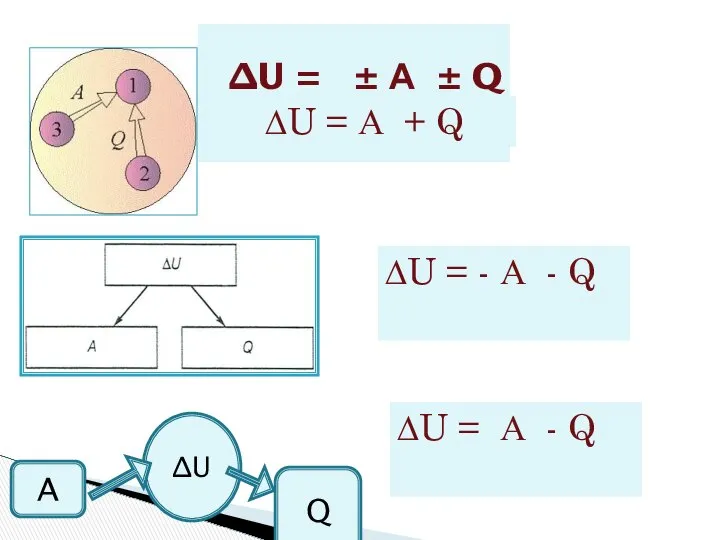
- 4. ∆U = ± А ± Q ∆U = А + Q ∆U = - А -
- 5. Внутренняя энергия Внутренняя энергия ΔU, основное понятие термодинамики, зависит от температуры и объема. Внутренняя энергия идеального
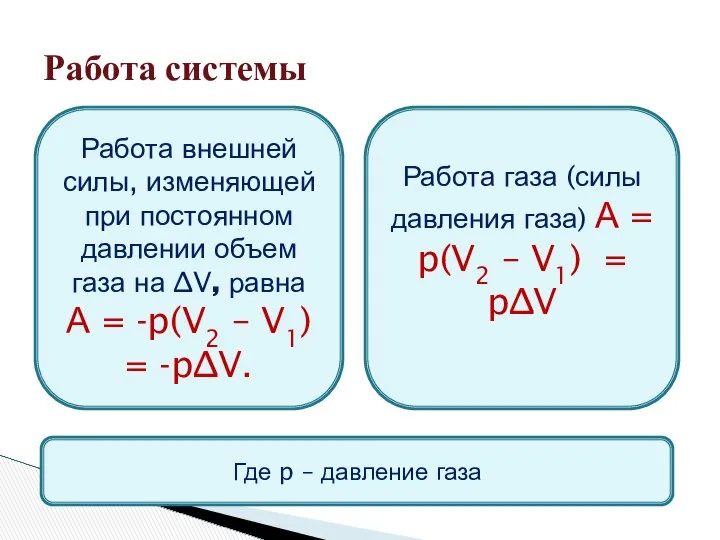
- 6. Работа системы Работа внешней силы, изменяющей при постоянном давлении объем газа на ∆V, равна А =
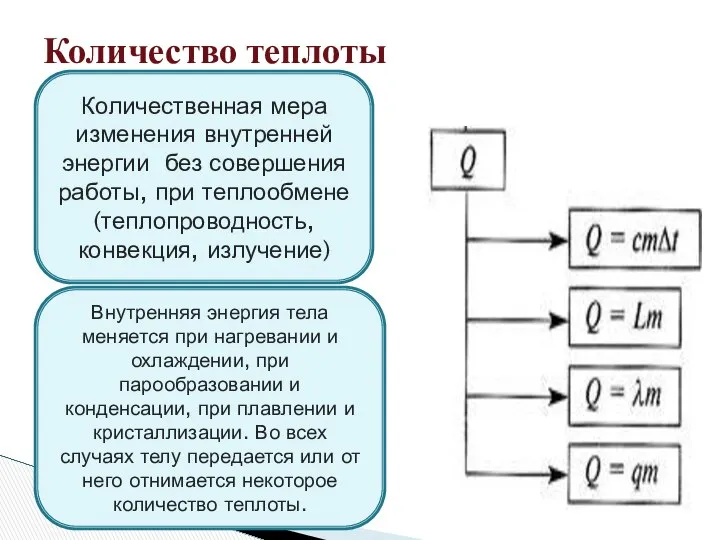
- 7. Количество теплоты Количественная мера изменения внутренней энергии без совершения работы, при теплообмене (теплопроводность, конвекция, излучение) Внутренняя
- 8. Первичное закрепление темы «Первый закон термодинамики»
- 9. №1.Газ в сосуде сжали, совершив работу 25 Дж. Внутренняя энергия газа при этом увеличилась на 30
- 10. Вопрос №1 Над телом совершена работа A внешними силами и телу передано количество теплоты Q. Чему
- 11. Вопрос №2 Газ получил количество теплоты 200 Дж, и при этом его внутренняя энергия увеличилась на
- 12. Вопрос №3 Какая физическая величина вычисляется по формуле ? Количество теплоты в идеальном газе Давление идеального
- 13. Вопрос №4 Выберите правильную формулировку первого закона термодинамики. А. Количество теплоты, преданное телу, равно сумме изменения
- 15. Скачать презентацию








 Квантовая модель атома водорода. (Лекция 6)
Квантовая модель атома водорода. (Лекция 6) Рентгеновская дифрактометрия
Рентгеновская дифрактометрия Молекулярная физика и основы термодинамики. Основные газовые законы
Молекулярная физика и основы термодинамики. Основные газовые законы Класифікація гідравлічних машин. Насоси
Класифікація гідравлічних машин. Насоси Алюминий, его свойства и применение
Алюминий, его свойства и применение Вторая жизнь солнечным батареям
Вторая жизнь солнечным батареям Оборудование и технология получения наноматериалов из газовой фазы
Оборудование и технология получения наноматериалов из газовой фазы Характеристики излучения лазеров
Характеристики излучения лазеров Nikola Tesla
Nikola Tesla Бипризма Френеля
Бипризма Френеля Теплопроводность. Коэффициент теплопроводности
Теплопроводность. Коэффициент теплопроводности Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Что изучает физика. Некоторые физические термины, наблюдения и опыты Физика 7 класс
Что изучает физика. Некоторые физические термины, наблюдения и опыты Физика 7 класс Магнитное поле
Магнитное поле Волновая оптика. Интерференция волн от двух точечных источников
Волновая оптика. Интерференция волн от двух точечных источников Акустика помещений
Акустика помещений Равноускоренное движение
Равноускоренное движение Презентация Силы трения
Презентация Силы трения  Аккумулятор (лат. accumulator — жинақтауыш) - химиялық реакция энергиясын электр энергиясына айналдыратын аспап; ол электржәне
Аккумулятор (лат. accumulator — жинақтауыш) - химиялық реакция энергиясын электр энергиясына айналдыратын аспап; ол электржәне Силы в природе
Силы в природе Теорiя великого вибуху
Теорiя великого вибуху Движение заряженных частиц в постоянных электрическом и магнитном полях
Движение заряженных частиц в постоянных электрическом и магнитном полях Телескоп
Телескоп Брейн - ринг. Физика
Брейн - ринг. Физика Строение атомов, магнетизм микрочастиц, молекулярные спектры
Строение атомов, магнетизм микрочастиц, молекулярные спектры Виды трубопроводов
Виды трубопроводов Конденсация на вертикальной трубе
Конденсация на вертикальной трубе Презентация по физике "Электрический ток в жидкостях" - скачать
Презентация по физике "Электрический ток в жидкостях" - скачать