Содержание
- 2. Уравнения состояния идеального газа Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие,
- 3. С помощью модели идеального газа можно исследовать процессы, в которых масса газа и один из трех
- 4. Изотермический процесс. Закон Бойля - Мариотта . Для поддержания температуры газа постоянной необходимо, чтобы он мог
- 5. Роберт Бойль (1627 – 1691) — физик, химик и богослов, седьмой сын Ричарда Бойля, графа Коркского,
- 6. Изобарный процесс.Закон Гей-Люссака . Закон Гей-Люссака -закон зависимости объёма газа от абсолютной температуры при постоянном давлении
- 7. Жозе́ф Луи́ Гей-Люсса́к (1778 – 1850) — французский химик и физик, член Французской Академии наук (1806).
- 8. Изохорный процесс.Закон Шарля. Формулировка закона Шарля следующая: Давление газа фиксированной массы и фиксированного объёма прямо пропорционально
- 9. Жак Александр Сезар Шарль (1746 —1823) — французский изобретатель и учёный. Известен как изобретатель наполняемого водородом,
- 10. Изображение газовых законов в различных координатах
- 11. Другие виды процессов в идеальном газе Адиабатический процесс (изоэнтропийный). Термодинамический процесс, происходящий без теплообмена с окружающей
- 12. Клапейрон Бенуа Поль Эмиль (1799–1864) – французский физик и инженер. Физические исследования посвящены теплоте, пластичности и
- 13. Другие газовые законы. Закон Авогадро: При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных
- 14. Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки
- 15. Основное уравнение МКТ Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость,
- 16. Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой
- 17. Пусть в единице объема сосуда содержатся n молекул; тогда число молекул в объеме цилиндра равно nSυxΔt.
- 18. При выводе этого соотношения предполагалось, что все n молекул, содержащихся в единице объема газа, имеют одинаковые
- 19. Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из основных положений молекулярно-кинетической
- 20. Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные
- 21. Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного
- 22. Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить: Средняя кинетическая энергия
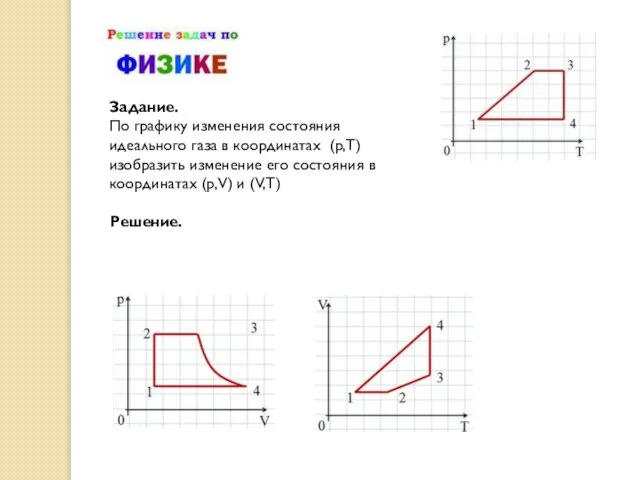
- 23. Задание. По графику изменения состояния идеального газа в координатах (p,T) изобразить изменение его состояния в координатах
- 24. Задание Углекислый газ объемом 1 л при нормальных условиях имеет массу 1,977 г. Какой реальный объем
- 26. Скачать презентацию
Уравнения состояния идеального газа
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические)
Уравнения состояния идеального газа
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические)
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией.
Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель идеального газа широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
С помощью модели идеального газа можно исследовать процессы, в которых масса
С помощью модели идеального газа можно исследовать процессы, в которых масса
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» - равный). Правда, в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объема. Лишь в лабораторных условиях удается поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо. Изопроцесс - это идеализированная модель реального процесса, которая только приближенно отражает действительность.
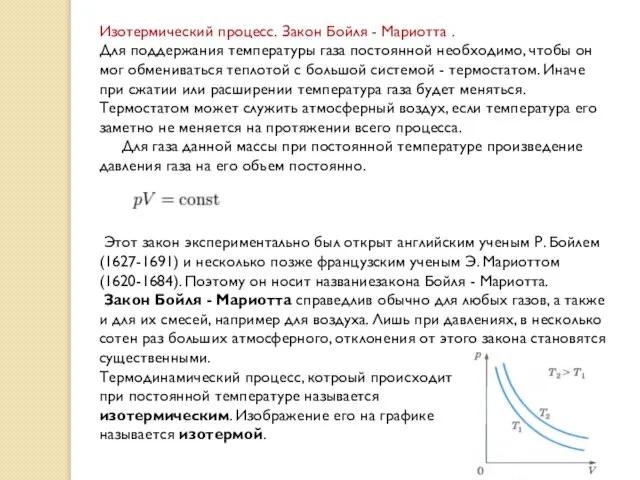
Изотермический процесс. Закон Бойля - Мариотта .
Для поддержания температуры газа постоянной
Изотермический процесс. Закон Бойля - Мариотта .
Для поддержания температуры газа постоянной
Этот закон экспериментально был открыт английским ученым Р. Бойлем (1627-1691) и несколько позже французским ученым Э. Мариоттом (1620-1684). Поэтому он носит названиезакона Бойля - Мариотта. Закон Бойля - Мариотта справедлив обычно для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Термодинамический процесс, котроый происходит
при постоянной температуре называется
изотермическим. Изображение его на графике
называется изотермой.
Роберт Бойль (1627 – 1691) — физик, химик и богослов, седьмой сын
Роберт Бойль (1627 – 1691) — физик, химик и богослов, седьмой сын
Участвовал в основании Общества наук, которое потом в 1668 г. переместилось в Лондон, а впоследствии под названием Лондонского королевского общества получило большую известность.
Эдм Мариотт (1620—1684) был настоятелем монастыря Сен-Мар-Тэнсубон в Дижоне (Франция). Одним из первых в 1666 г. он вошел в состав только что сформированной в том же году Французской Академии наук. Его эксперименты с воздухом привели к открытию ныне широко известного закона Бойля—Мариотта.
Изобарный процесс.Закон Гей-Люссака .
Закон Гей-Люссака -закон зависимости объёма газа от абсолютной температуры
Изобарный процесс.Закон Гей-Люссака .
Закон Гей-Люссака -закон зависимости объёма газа от абсолютной температуры
Закон Гей-Люссака утверждает, что при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре.
Однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века.
Графически эта зависимость в координатах V-T
изображается в виде прямой, выходящей из точки Т=0.
Эту прямую называют изобарой.
Процесс изменения состояния термодинамической
системы при постоянном давлении называют
изобарным (от греческого слова «барос» - вес ).
Жозе́ф Луи́ Гей-Люсса́к (1778 – 1850) — французский химик и физик, член
Жозе́ф Луи́ Гей-Люсса́к (1778 – 1850) — французский химик и физик, член
Большинство современников отмечают чрезвычайную честность Гей-Люссака как человека и как учёного. Он был суров и требователен и к себе самому, и к своим сослуживцам, и к научным оппонентам, невзирая на заслуги и регалии последних. Он всегда считал своей обязанностью признавать и публиковать собственные ошибки и заблуждения, если таковые обнаруживались.
Другой характерной чертой Гей-Люссака было личное бесстрашие, которое проявлялось как при проведении опасных научных экспериментов, так и в защите своих близких и коллег от политических репрессий и цензуры.
Например в 1804 году Гей-Люссак предпринял подъём на воздушном шаре с целью определить зависимость магнитного поля Земли и температуры атмосферы от высоты подъёма.
Изохорный процесс.Закон Шарля.
Формулировка закона Шарля следующая:
Давление газа фиксированной массы и фиксированного
Изохорный процесс.Закон Шарля.
Формулировка закона Шарля следующая:
Давление газа фиксированной массы и фиксированного
Закон давления, описанный выше, должен быть на самом деле приписан Гильому Амонтону, который в конце XVII века (точнее между 1700 и 1702 годом) обнаружил, что давление фиксированной массы газа, поддерживаемого при постоянном объёме, пропорционально его температуре. Амонтон обнаружил это при постройке «воздушного термометра».
Графически эта зависимость в координатах P-T
изображается в виде прямой, выходящей из
точки Т=0. Эту прямую называют изохорой.
Разным объемам соответствуют разные изохоры.
Процесс изменения состояния термодинамической
системы при постоянном объеме называют
изохорным (от греческого слова
«хорема»-вместимость).
Жак Александр Сезар Шарль (1746 —1823) — французский изобретатель и учёный. Известен как
Жак Александр Сезар Шарль (1746 —1823) — французский изобретатель и учёный. Известен как
Амонтон Гийом (1663 - 1705) — французский механик и физик, член Французской академии наук, один из пионеров трибологии.
С рождения Гильом был практически глух, поэтому никогда не посещал университетов и математику, физику, геодезию, прикладную и небесную механику, а также архитектуру и рисование Амонтон Гильом изучал самостоятельно.
Известен, разработчик закона Амонтона — Кулона.
Также Амонтон известен, как изобретатель: в 1677 году он создаёт гигрометр, в 1702 году им был создан барометр с U-образной трубкой.
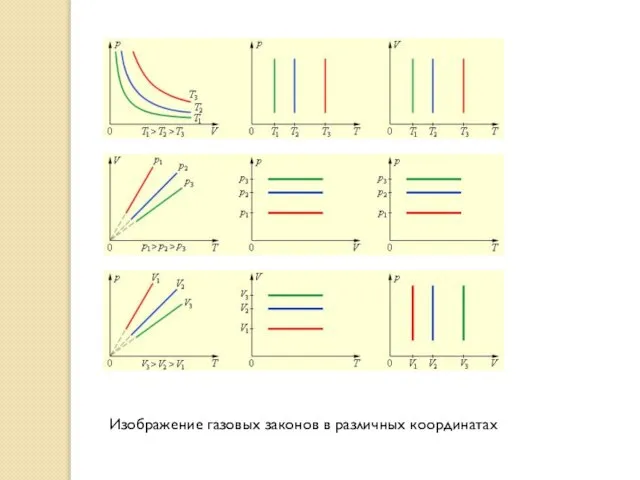
Изображение газовых законов в различных координатах
Изображение газовых законов в различных координатах
Другие виды процессов в идеальном газе
Адиабатический процесс (изоэнтропийный). Термодинамический процесс, происходящий
Другие виды процессов в идеальном газе
Адиабатический процесс (изоэнтропийный). Термодинамический процесс, происходящий
Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
Объединённый газовый закон (закон Менделеева-Клапейрона).
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака.
Клапейрон Бенуа Поль Эмиль (1799–1864) – французский физик и инженер. Физические
Клапейрон Бенуа Поль Эмиль (1799–1864) – французский физик и инженер. Физические
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную r, значение которой необходимо было измерять для каждого газа:
Дми́трий Ива́нович Менделе́ев (1834- 1907) — русский учёный-энциклопедист: химик , физикохимик, физик, метролог, экономист, технолог, геолог, метеоролог, педагог, воздухоплаватель, приборостроитель. Профессор Санкт-Петербургского университета.
Менделеев обнаружил, что r прямо пропорциональна количеству вещества, коэффициент пропорциональности R он назвал универсальной газовой постоянной:
R = 8,314 Дж / (К * моль)
Другие газовые законы.
Закон Авогадро: При одинаковых давлениях и одинаковых температурах, в
Другие газовые законы.
Закон Авогадро: При одинаковых давлениях и одинаковых температурах, в
Моль любого вещества в газообразном состоянии при одинаковых температурах и давлениях занимает один и тот же объем. Как показали эксперименты, при нормальных условиях (р=1 атм(760 мм.рт.ст.), T=273K(Т=О С)) он равен 22,414 л.
Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
Для смеси двух газов:
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Началом становления МКТ послужила теория М. В. Ломоносова, который опытным путём опроверг теории о теплороде и флогистоне, подготовив тем самым, молекулярно-кинетическую теорию XIX века Рудольфа Клаузиуса, Людвига Больцмана и Джеймса Максвелла.
Флогисто́н (от греч. φλογιστός — горючий, воспламеняемый) — в истории химии — гипотетическая «сверхтонкая материя» — «огненная субстанция», якобы наполняющая все горючие вещества и высвобождающаяся из них при горении. Введён в начале XVIII века Иоганном Бехером и Георгом Шталем в 1703 году для объяснения процессов горения.
Теплоро́д — по распространённым в XVIII — начале XIX века воззрениям, невесомый флюид, присутствующий в каждом теле и являющийся причиной тепловых явлений. Введён в 1783 году Лавуазье.
Основное уравнение МКТ
Задача молекулярно-кинетической теории состоит в том, чтобы установить связь
Основное уравнение МКТ
Задача молекулярно-кинетической теории состоит в том, чтобы установить связь
В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
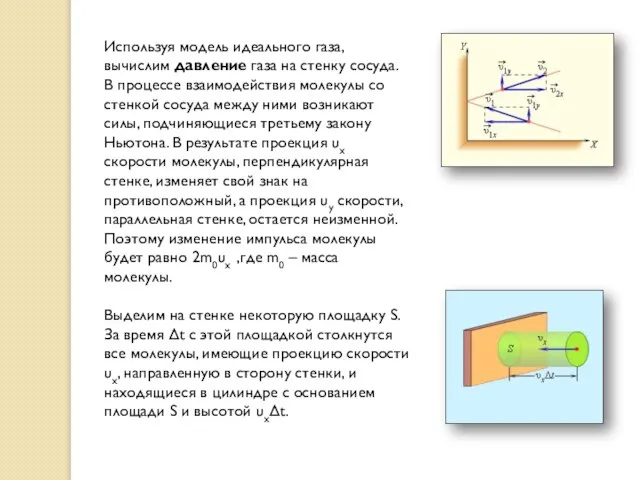
Используя модель идеального газа, вычислим давление газа на стенку сосуда. В
Используя модель идеального газа, вычислим давление газа на стенку сосуда. В
Выделим на стенке некоторую площадку S. За время Δt с этой площадкой столкнутся все молекулы, имеющие проекцию скорости υx, направленную в сторону стенки, и находящиеся в цилиндре с основанием площади S и высотой υxΔt.
Пусть в единице объема сосуда содержатся n молекул; тогда число молекул
Пусть в единице объема сосуда содержатся n молекул; тогда число молекул
½ nSυxΔt.
Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0υx , то полное изменение импульса всех молекул, столкнувшихся за время Δt с площадкой S, равно
2m0υx * ½ nSυxΔt = m0nSυx2Δt.
По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы FΔt, где F – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке S. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку S. Поэтому можно записать:
FΔt= nm0Sυx2Δt,
откуда
p=F/S= nm0υx2
При выводе этого соотношения предполагалось, что все n молекул, содержащихся в
При выводе этого соотношения предполагалось, что все n молекул, содержащихся в
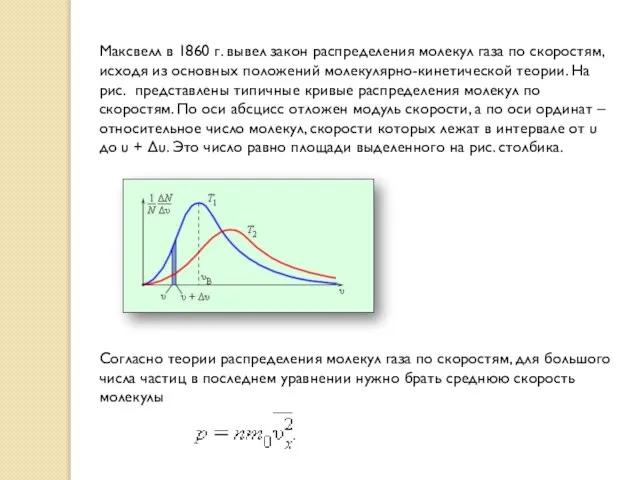
В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям. Распределение молекул газа по модулю скоростей называется распределением Максвелла.
Джеймс Клерк Ма́ксвелл (1831— 1879) — британский физик, математик и механик. Максвелл заложил основы современной классической электродинамики (уравнения Максвелла).
Один из основателей кинетической теории газов (установил распределение молекул газа по скоростям).
Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из
Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из
Согласно теории распределения молекул газа по скоростям, для большого числа частиц в последнем уравнении нужно брать среднюю скорость молекулы
Так как все направления для векторов скоростей молекул равновероятны, среднее значение
Так как все направления для векторов скоростей молекул равновероятны, среднее значение
Тогда формула для среднего давления газа на стенку сосуда запишется в виде
Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m0, концентрацией молекул n, средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию
Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию
Опыт показывает, что такой величиной является температура.
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Из газовых законов следует, что давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре: p ~ T.
или
p = nkT
где k = R/NA =1,38·10–23 Дж/К –постоянная Больцмана
Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
Средняя
Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
Средняя
Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул.
Следует обратить внимание на то, что средняя кинетическая энергия поступательного движения молекулы не зависит от ее массы. Броуновская частица, взвешенная в жидкости или газе, обладает такой же средней кинетической энергией, как и отдельная молекула, масса которой на много порядков меньше массы броуновской частицы.
Задание.
По графику изменения состояния идеального газа в координатах (p,T) изобразить изменение
Задание.
По графику изменения состояния идеального газа в координатах (p,T) изобразить изменение
Решение.
Задание
Углекислый газ объемом 1 л при нормальных условиях имеет массу 1,977
Задание
Углекислый газ объемом 1 л при нормальных условиях имеет массу 1,977
Решение. Молярная масса М (CO2) = 44 г/моль, тогда объем моля 44/1,977 = 22,12 (л). Эта величина меньше принятой для идеальных газов (22,4 л).
Уменьшение объема связано с возрастанием взаимо действия между молекулами СО2, т. е. отклонением от идеальности.


















 Резистор және реостат. Өткізгіштерді тізбектей және параллель жалғау
Резистор және реостат. Өткізгіштерді тізбектей және параллель жалғау Лампы накаливания
Лампы накаливания Строение атома. Урок №7
Строение атома. Урок №7 Нейтронно-физические эксперименты в физике ядерных реакторов
Нейтронно-физические эксперименты в физике ядерных реакторов Классификация средств измерений
Классификация средств измерений Презентация по физике "Элементарные частицы и их свойства" - скачать
Презентация по физике "Элементарные частицы и их свойства" - скачать  Силы в природе, законы Ньютона. Решение задач
Силы в природе, законы Ньютона. Решение задач Силы инерции
Силы инерции Нестандартные задачи по физике. Относительность движения
Нестандартные задачи по физике. Относительность движения Моточные изделия: катушка индуктивности
Моточные изделия: катушка индуктивности Техническое обслуживание дизельных двигателей
Техническое обслуживание дизельных двигателей Стационарные состояния электрона в идеальной решетке (задача Блоха)
Стационарные состояния электрона в идеальной решетке (задача Блоха) Презентация на тему: Шаровые молнии
Презентация на тему: Шаровые молнии Гидроэлектростанции (ГЭС)
Гидроэлектростанции (ГЭС)  харчування під час радіоактивної небезпеки Підготувала учениця 302 групи Авіакосмічного ліцею ім.І.Сікорського НАУ Гріднєва А
харчування під час радіоактивної небезпеки Підготувала учениця 302 групи Авіакосмічного ліцею ім.І.Сікорського НАУ Гріднєва А Давление газов. Закон Паскаля
Давление газов. Закон Паскаля Третий закон термодинамики
Третий закон термодинамики Системы сил в статике
Системы сил в статике Электротехника и электроника. Электрические цепи при импульсном воздействии. (Лекция 12)
Электротехника и электроника. Электрические цепи при импульсном воздействии. (Лекция 12) Проводники с током в магнитном поле. Теорема Гаусса для магнитного поля
Проводники с током в магнитном поле. Теорема Гаусса для магнитного поля Уравнения Максвелла
Уравнения Максвелла Презентация по теме «Механические волны
Презентация по теме «Механические волны Циклы
Циклы Проверочный расчет двигателя 6 L21\31
Проверочный расчет двигателя 6 L21\31 Петрофизика. Удельная поверхность и пористость горных пород
Петрофизика. Удельная поверхность и пористость горных пород Тест. Физика элементарных частиц
Тест. Физика элементарных частиц Оптика
Оптика Правила эксплуатации комбайна ACROS 530
Правила эксплуатации комбайна ACROS 530