Содержание
- 2. П Р И М Е Н Е Н И Е Р А С Т В О
- 3. В сельском хозяйстве для подкормки растений
- 4. В БЫТУ ДЛЯ КОНСЕРВАЦИИ ОВОЩЕЙ, ФРУКТОВ
- 5. Цель: приготовить раствор с заданной массовой долей растворённого вещества. Реактивы: кристаллическая поваренная соль - NaCl; вода
- 6. 3. Шпатель (ложка) 4. Стеклянная палочка 5.Мерный цилиндр
- 7. Правила работы с лабораторными весами 1. Уравновешивают весы. 2. На левую чашку весов помещают взвешиваемый предмет,
- 8. Правила измерения объёма жидкости с помощью измерительного цилиндра 1.Рассмотрите измерительный цилиндр. Обратите внимание на его деления
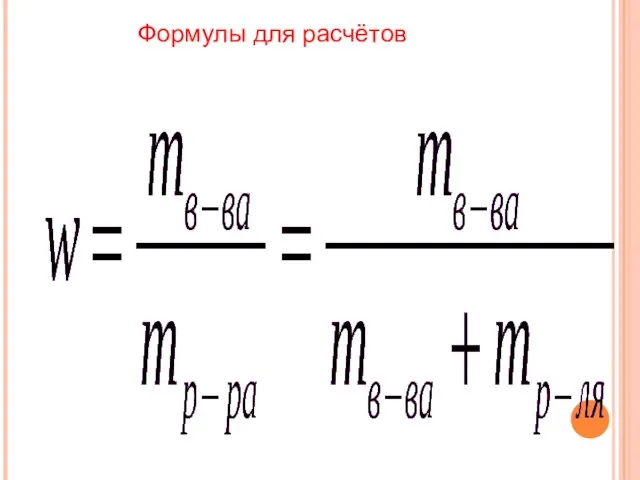
- 9. Формулы для расчётов
- 10. m(в-ва) = w(в-ва) • m(р-ра) m(H2O) = m(р-ра) – m(в-ва) V(H2O) = m(H2O) • p(H2O)
- 11. Практическую часть начнём с проверки знаний правил ТБ, которые важно помнить при выполнении работы. 1) Нельзя
- 12. Проведите мысленный эксперимент, решив следующую практическую задачу: В медицине используют так называемый физиологический раствор, представляющий собой
- 13. Ход работы 1.Рассчитайте массу твёрдого вещества, необходимого для приготовления раствора в соответствии с вашим вариантом задания.
- 14. Вариант 1. Глюкоза применяется в медицине как средство усиленного углеводного питания, как компонент различных кровезамещающих и
- 15. П Р О В Е Р К А Дано: m(р-ра)=10мл р(р-ра)=1.54г/мл w(в-ва)=40% -------------------------- m(в-ва) - ?
- 16. И Т О Г И У Р О К А ПРОДОЛЖИТЬ ФРАЗУ: Сегодня я узнал …
- 17. 1.Рассчитать объём воды и массу соли перманганата калия( марганцовки) дпя приготовления 200г 2% раствора. Где применяют
- 19. Скачать презентацию







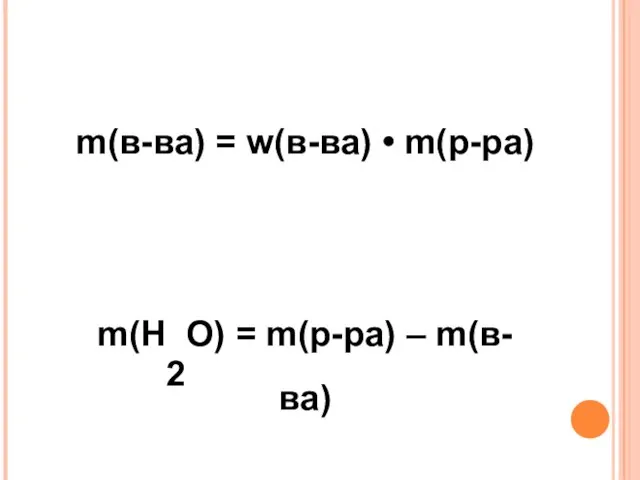







 Машины и механизмы
Машины и механизмы Действие магнитного поля на проводник с током. Электродвигатель
Действие магнитного поля на проводник с током. Электродвигатель Диффузия и ее роль в жизни человека Выполнила : Красильникова Маргарита ученица 8 класса МОУ «Гимназия № 1»
Диффузия и ее роль в жизни человека Выполнила : Красильникова Маргарита ученица 8 класса МОУ «Гимназия № 1»  Презентация по физике "Радиолокация" - скачать
Презентация по физике "Радиолокация" - скачать  Однофазная цепь с параллельным соединением электроприемников
Однофазная цепь с параллельным соединением электроприемников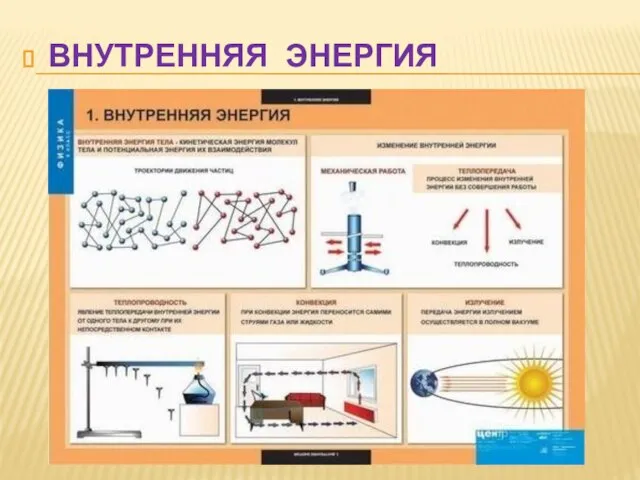 Внутренняя энергия
Внутренняя энергия Позитронно-эмиссионная томография
Позитронно-эмиссионная томография Взаимодействие тел. Второй закон Ньютона
Взаимодействие тел. Второй закон Ньютона Освещение жилого дома
Освещение жилого дома Разработка системы управления узлом подготовки реакционной смеси с применением САР соотношения расходов
Разработка системы управления узлом подготовки реакционной смеси с применением САР соотношения расходов Аттестационная работа. Элективный курс Решение олимпиадных задач по физике
Аттестационная работа. Элективный курс Решение олимпиадных задач по физике Передача электроэнергии
Передача электроэнергии Закон сохранения и превращения энергии в механических и тепловых процессах.
Закон сохранения и превращения энергии в механических и тепловых процессах. Микроскопия, виды и возможности современных микроскопов
Микроскопия, виды и возможности современных микроскопов Магнитное поле соленоида
Магнитное поле соленоида Электроснабжение многофункционального торгово-развлекательного центра в г. Сегежа
Электроснабжение многофункционального торгово-развлекательного центра в г. Сегежа Сопротивление воздуха
Сопротивление воздуха Переменный электрический ток. Вынужденные электромагнитные колебания
Переменный электрический ток. Вынужденные электромагнитные колебания Звук
Звук Измерение напряжения на различных участках электрической цепи. Лабораторная работа №5
Измерение напряжения на различных участках электрической цепи. Лабораторная работа №5 Работа силы тяжести
Работа силы тяжести Масс-спектрометрия
Масс-спектрометрия Кинетическая модель гетерогенных химических процессов. (Темы 5.3 - 5.4)
Кинетическая модель гетерогенных химических процессов. (Темы 5.3 - 5.4) Николя Леонар Сади Карно
Николя Леонар Сади Карно Презентация по физике "Электромагнитное взаимодействие частиц с веществом" - скачать
Презентация по физике "Электромагнитное взаимодействие частиц с веществом" - скачать  Магниторазведка
Магниторазведка Явление электромагнитной индукции. Теория Максвелла для электромагнитного поля. Лекция № 16
Явление электромагнитной индукции. Теория Максвелла для электромагнитного поля. Лекция № 16 Изменение изотопного состава. Выгорание топлива
Изменение изотопного состава. Выгорание топлива