Содержание
- 2. Лекция 22 Теории теплоемкости Эйнштейна и Дебая (без вывода). Вращательная и ядерная сумма по состояниям.
- 3. Средняя кинетическая энергия и средняя скорость молекул в идеальном газе. Найдите верные утверждения! 4. Средняя энергия
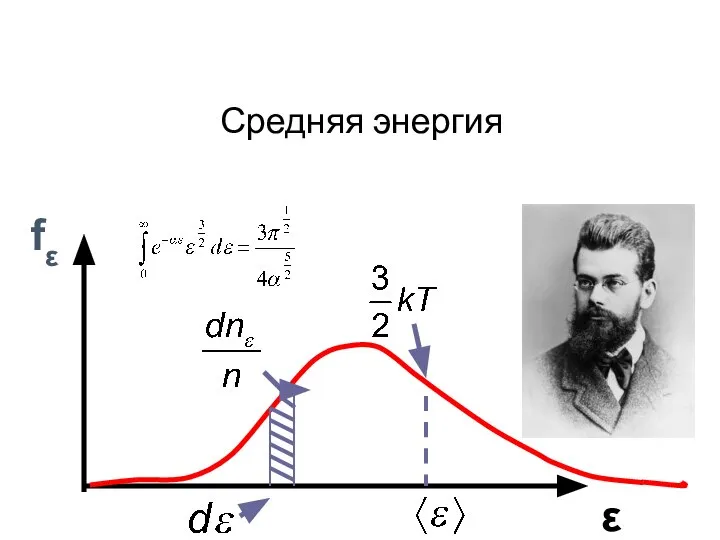
- 4. fε ε Средняя энергия
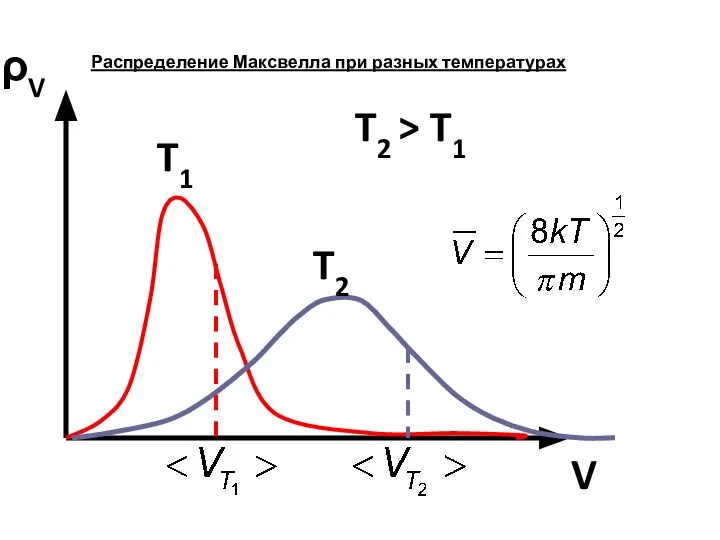
- 5. ρV V T1 T2 T2 > T1 Распределение Максвелла при разных температурах
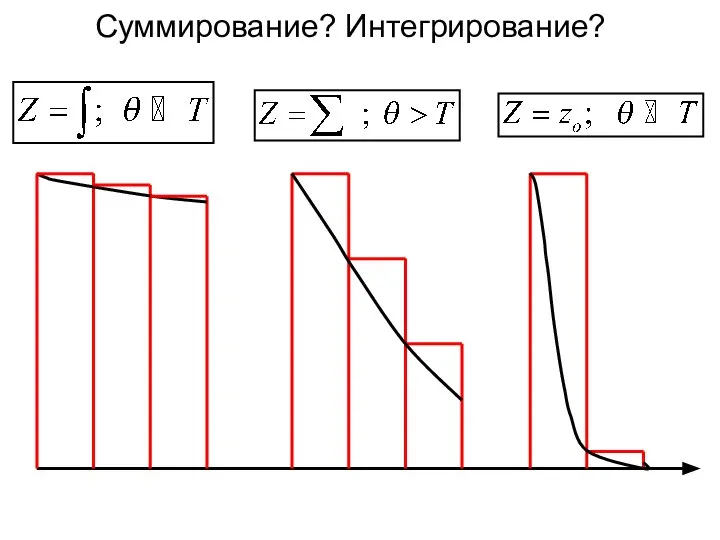
- 7. Для расчета суммы по состояниям Q существуют формулы (1) и (2) которой из них нужно пользоваться?
- 8. Суммирование? Интегрирование?
- 9. Чем мембранное равновесие отличается от фазового? Найдите верные утверждения! 2 балла
- 10. Какая из формул неверна для системы «идеальный газ»? 1 балла
- 11. Максимальная теплоемкость СV идеального газа СО равна: 1 балла
- 12. ВРАЩАТЕЛЬНАЯ ТЕПЛОЕМКОСТЬ ДВУХАТОМНОГО ИДЕАЛЬНОГО ГАЗА. НАЙДИТЕ ПРАВИЛЬНОЕ УТВЕРЖДЕНИЕ 1. РАВНА R 2. МОЖЕТ БЫТЬ БОЛЬШЕ R
- 13. Ниже приводятся несколько утверждений относительно правила фаз Гиббса. Выберите из них правильные. а) Правильного утверждения здесь
- 14. СТАТИСТИЧЕСКИЙ РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ ФУНКЦИЙ ИДЕАЛЬНОГО ГАЗА
- 15. Расчет термодинамических функций
- 16. Расчет термодинамических функций
- 17. Энтропия НСl, S0298K,эксп. = 186,6 {Дж/моль/град}
- 18. Молекулярные параметры, нужные для расчета Q Молекулярная масса, m Структура, момент инерции, I Частоты колебаний, ν
- 19. Учет изотопного распределения Молекула Cl2
- 20. Расчет константы равновесия
- 21. Расчет константы равновесия
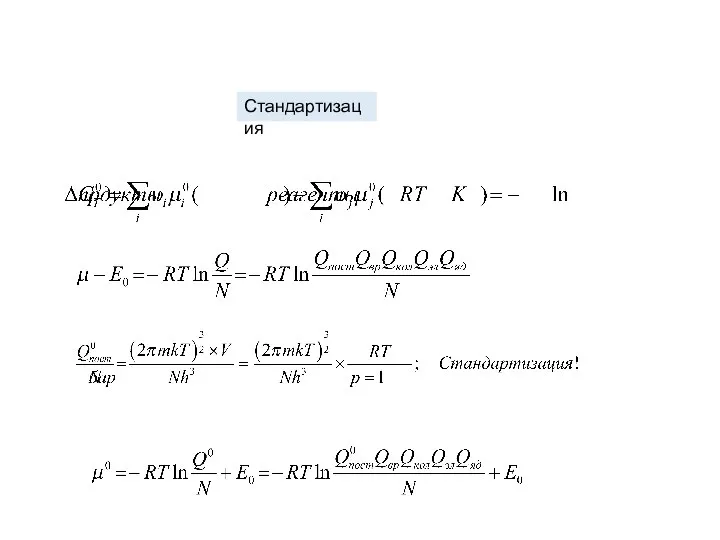
- 22. Стандартизация
- 25. Практические константы равновесия
- 26. Закон равнораспределения энергии по степеням свободы в идеальном газе
- 27. СРЕДНЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА РАВНОМЕРНА РАСПРЕДЕЛЕНА МЕЖДУ 6-ю СТЕПЕНЯМИ СВОБОДЫ. Колебательную и электронную энергию не рассматриваем
- 28. Расчет сумм по состоянию, Q.
- 29. Расчет поступательной и вращательной теплоемкости
- 30. ЗАКОН РАВНОРАСПРЕДЕЛЕНИЯ это : Низкая характеристическая температура, близко лежащие уровни энергии, возможность замены суммирования на интегрирование
- 31. ЗАКОН РАВНОРАСПРЕДЕЛЕНИЯ не РАСПРОСТРАНЯЕТСЯ на КОЛЕБАТЕЛЬНУЮ и ЭЛЕКТРОННУЮ ЭНЕРГИЮ
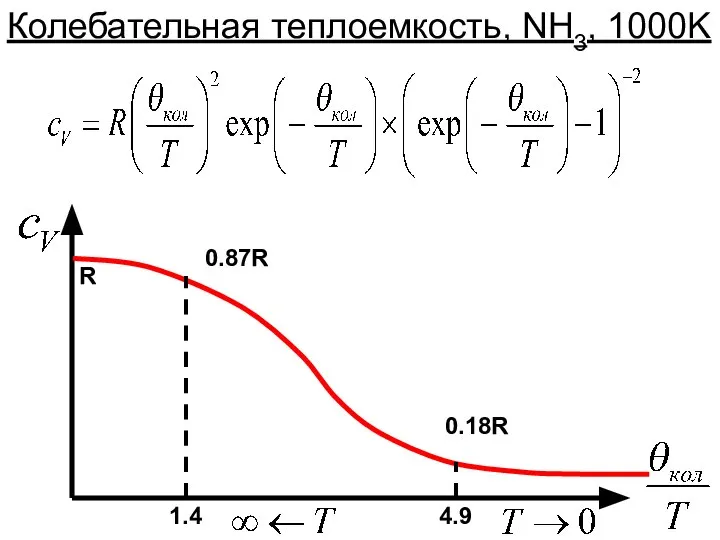
- 32. 1.4 4.9 0.87R 0.18R R Колебательная теплоемкость, NH3, 1000K
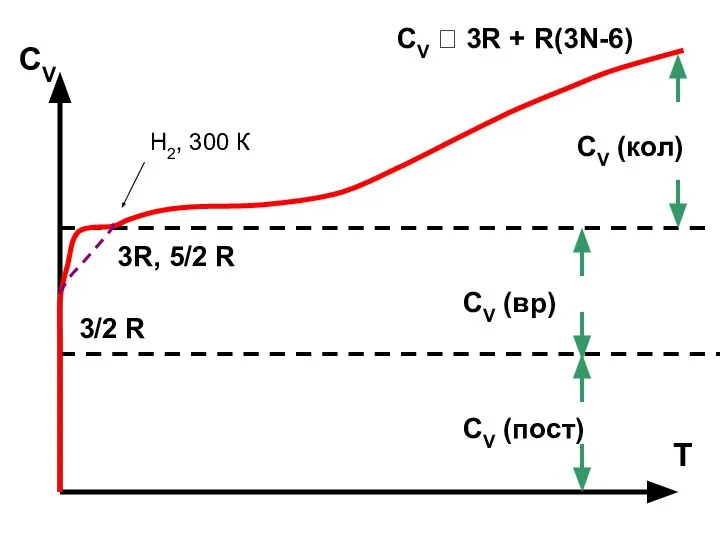
- 33. 3/2 R 3R, 5/2 R CV ? 3R + R(3N-6) CV (пост) CV (вр) CV (кол)
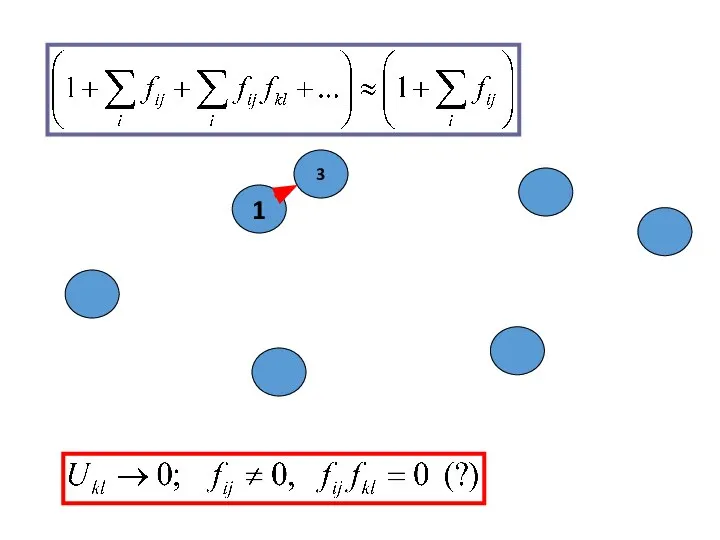
- 34. РАСЧЕТ КОНФИГУРАЦИОННОГО ИНТЕГРАЛА для РЕАЛЬНОГО ГАЗА
- 35. ЭНЕРГИЯ E и ИНТЕГРАЛ Z в ПРОСТРАНСТВЕ Ω :
- 36. Конфигурационный интеграл :
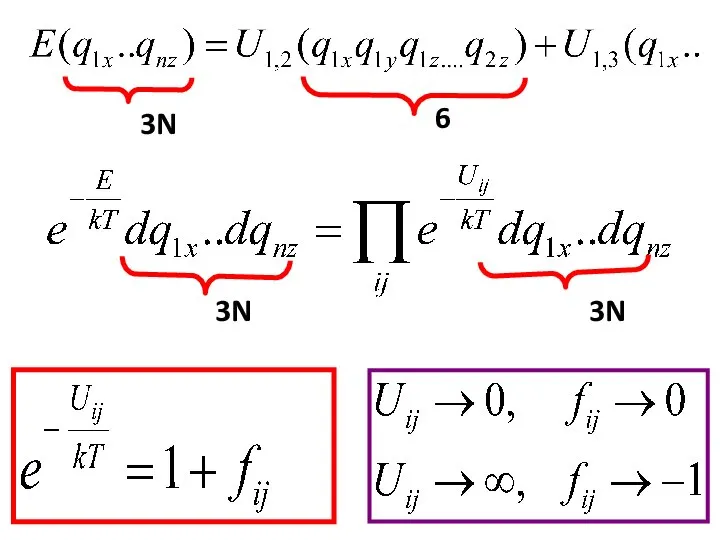
- 37. Как мы будем учитывать зависимость энергии от координат qi,j в фазовом пространстве?
- 38. Как мы учитывали зависимость энергии от координат qi,j в фазовом пространстве?
- 39. Как мы будем учитывать зависимость энергии от координат qi,j в фазовом пространстве?
- 40. 1. Упрощаем интеграл 2. Вводим потенциал взаимодействия между молекулами (атомы) 3. Считаем конфигурационный интеграл Zконф. 3N
- 41. Посчитаем давление: Для идеального газа: Для реального газа:
- 42. Упрощаем интеграл ….
- 43. 6 3N 3N 3N
- 45. 1 3
- 46. 3N 6 6 3
- 47. Ln (1+x) ≈ х, x«1
- 49. Вводим потенциал взаимодействия между молекулами (атомами) ….
- 51. Скачать презентацию

















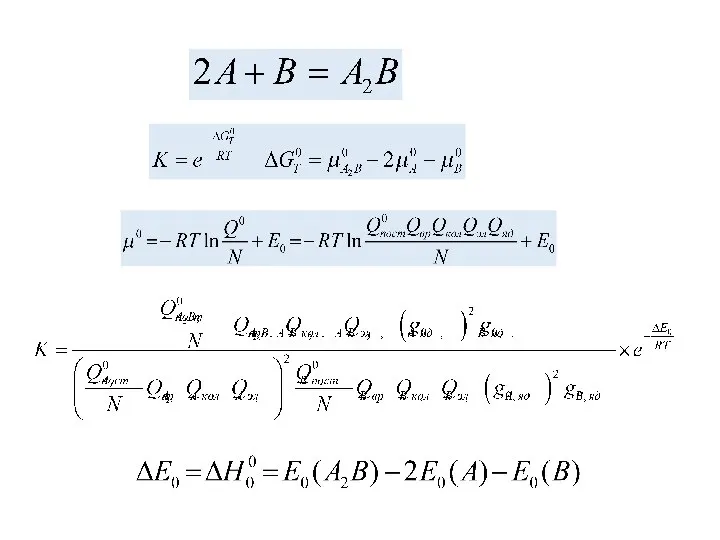


















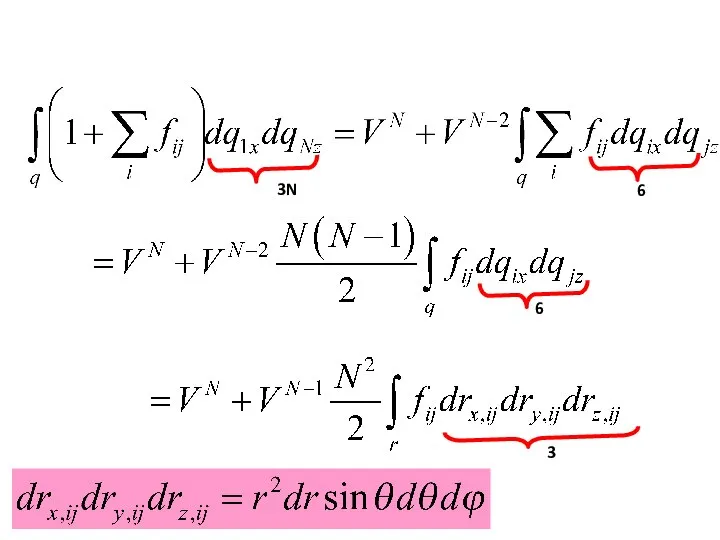
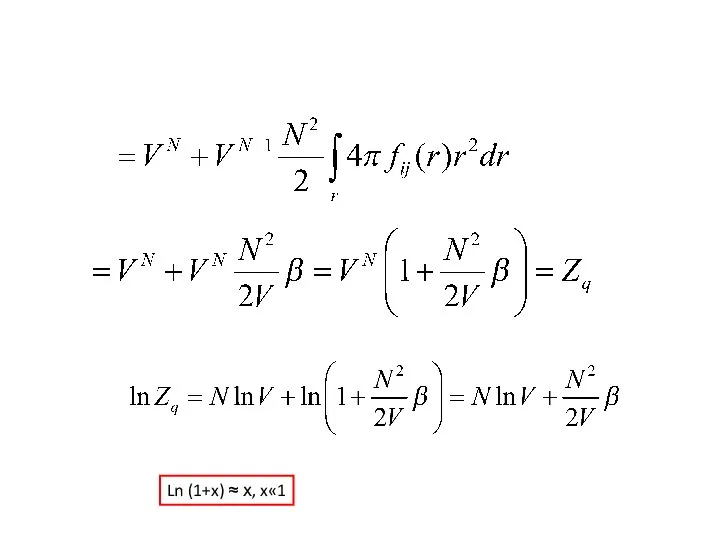


 Установка для приемо-сдаточных испытаний (УПСИ) индивидуального объекта
Установка для приемо-сдаточных испытаний (УПСИ) индивидуального объекта Закон Ома
Закон Ома Изучение минералов в скрещенных николях в проходящем свете
Изучение минералов в скрещенных николях в проходящем свете Эмилий Христианович Ленц
Эмилий Христианович Ленц Атомно-эмиссионный спектрометр с индуктивно связанной плазмой ICPE-9000
Атомно-эмиссионный спектрометр с индуктивно связанной плазмой ICPE-9000 Тепломассообмен. Задачи. Теплопроводность
Тепломассообмен. Задачи. Теплопроводность Определение гамма-излучения в Челябинском городском бору
Определение гамма-излучения в Челябинском городском бору Томас Эдисон та його винахід
Томас Эдисон та його винахід  Area, size and mass
Area, size and mass ТЕМА 8 МЕГАМИР И ЕГО СВОЙСТВА.
ТЕМА 8 МЕГАМИР И ЕГО СВОЙСТВА.  Система газ-твердое. Лекция 24
Система газ-твердое. Лекция 24 Физика - наука о природе
Физика - наука о природе Оптичні системи. Кут зору. Дисперсія, інтерференція, дифракція, поляризація світла
Оптичні системи. Кут зору. Дисперсія, інтерференція, дифракція, поляризація світла Закон Лоренца
Закон Лоренца Рычаги в быту
Рычаги в быту Законы Кирхгофа
Законы Кирхгофа Обслуживание тепловоза серии 2ТЭ116
Обслуживание тепловоза серии 2ТЭ116 Компас. Виды. История открытия
Компас. Виды. История открытия Максвелл Джеймс Клерк
Максвелл Джеймс Клерк Научно - исследовательская работа на тему: „Исследование расчета потерь мощности в линиях электропередач Нерюнгри - Алдан“
Научно - исследовательская работа на тему: „Исследование расчета потерь мощности в линиях электропередач Нерюнгри - Алдан“ *Физический брейн-ринг. Ребусы
*Физический брейн-ринг. Ребусы Кремний - как полупроводник
Кремний - как полупроводник Молекулярнокинетическая теория
Молекулярнокинетическая теория Радиотелескопы
Радиотелескопы Дифракция света
Дифракция света Относительность движения
Относительность движения Квантовая радиофизика. Лекция 5. Практическая ЯМР- спектроскопия
Квантовая радиофизика. Лекция 5. Практическая ЯМР- спектроскопия Принцип действия тепловых двигателей. КПД тепловых двигателей Цель урока: раскрыть физические принципы действия тепловых двигат
Принцип действия тепловых двигателей. КПД тепловых двигателей Цель урока: раскрыть физические принципы действия тепловых двигат