Синтез нанослоев неорганических соединений методами ионного и ионно-молекулярного наслаивания. (Лекция 11)
Содержание
- 2. Синтезы нанослоев методом ионного наслаивания (ИН) с участием растворов реагентов были независимо описаны на примере слоев
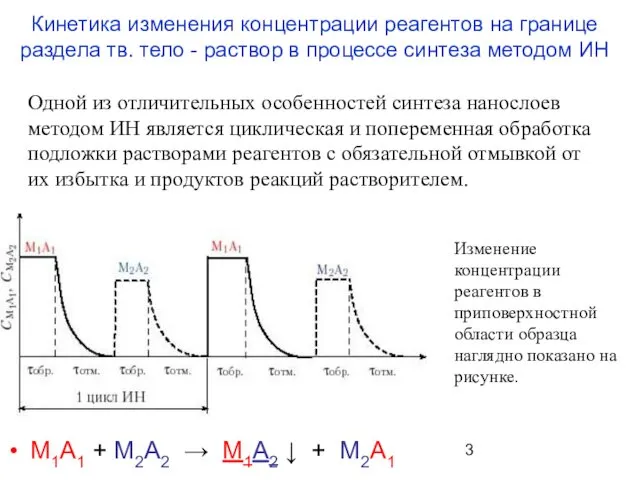
- 3. Кинетика изменения концентрации реагентов на границе раздела тв. тело - раствор в процессе синтеза методом ИН
- 4. Адсорбция ионов на поверхности подложки и синтез первого нанослоя Внутри-сферные компл Внешне-сферные компл При синтезе методом
- 5. Схемы реакций, протекающих на поверхности на каждой стадии обработки подложки в растворах при синтезе нанослоев методом
- 6. Выбор оптим. условий синтеза нанослоев методом ИН (I) (II) (III) (IV) Первые эксперименты показали, что для
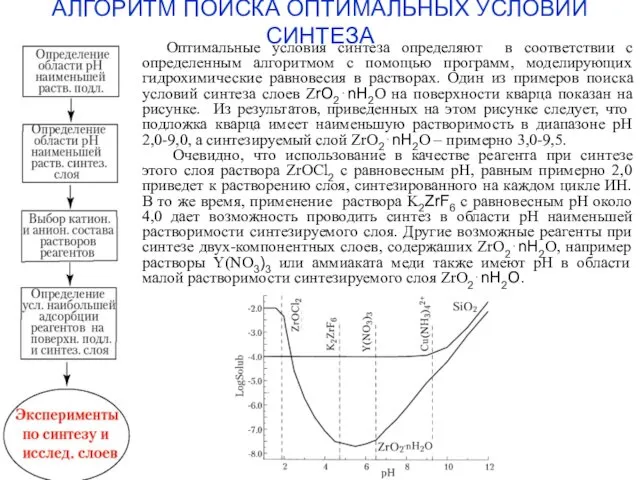
- 7. АЛГОРИТМ ПОИСКА ОПТИМАЛЬНЫХ УСЛОВИЙ СИНТЕЗА Оптимальные условия синтеза определяют в соответствии с определенным алгоритмом с помощью
- 8. Многообразные реакции синтеза методом ИН могут быть разделены на различные группы в соответствии с основными типами
- 9. Классификация реакций на поверхности в процессе синтеза методом ИН Реакции без изменения степени окисления адсорбированных ионов
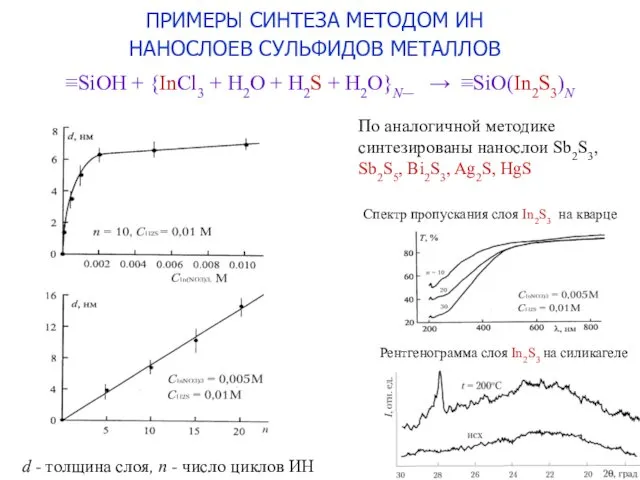
- 10. ≡SiOH + {InCl3 + H2O + H2S + H2O}N_ → ≡SiO(In2S3)N По аналогичной методике синтезированы нанослои
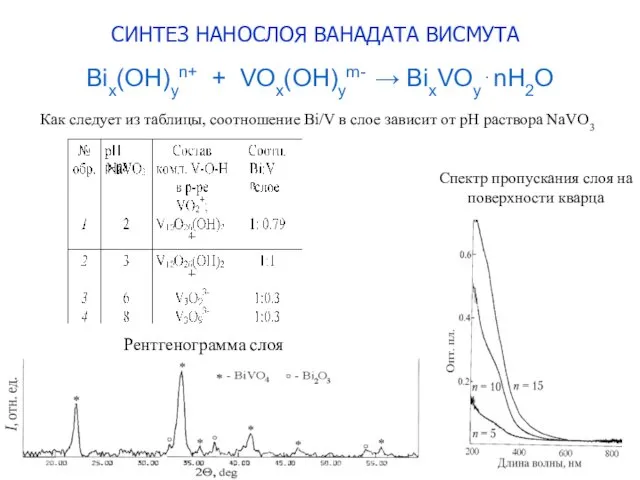
- 11. Bix(OH)yn+ + VOx(OH)ym- → BixVOy⋅nH2O Как следует из таблицы, соотношение Bi/V в слое зависит от рН
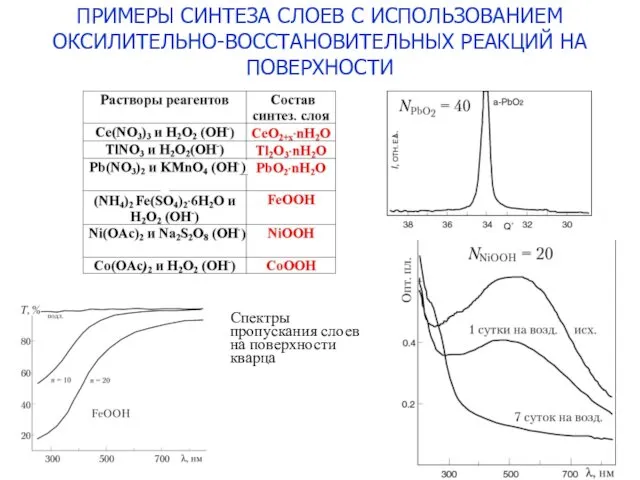
- 12. Cu2+ + H2O2 (OH-) → Cu(OH)x(OOH)2-x Синтез нанослоев труднораств. гидроксо-пероксидов металлов Данным способом синтезированы также слои
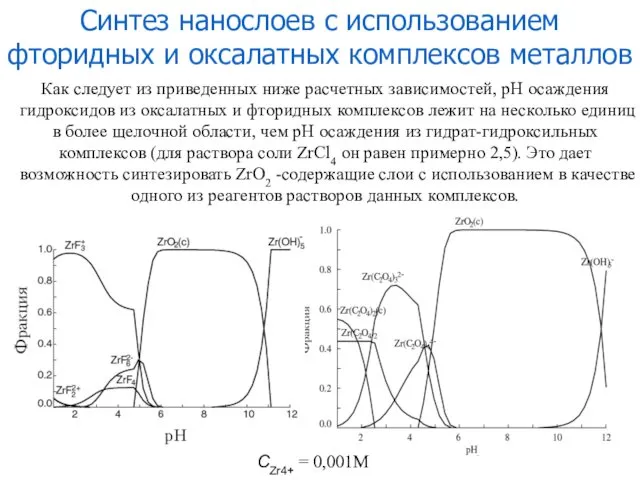
- 13. Синтез нанослоев с использованием фторидных и оксалатных комплексов металлов CZr4+ = 0,001М Как следует из приведенных
- 14. 1. ≡SiO- + [Zn(NH3)4]2+ ⇒ ≡SiO[Zn(NH3)4]+⋅ [Zn(NH3)4]2+изб 2. ≡SiO[Zn(NH3)4]+⋅[Zn(NH3)4]2+изб + промывка H2O ⇒ ≡SiOZnOH 3. ≡SiOZnOH+
- 15. NCu0,04Zr(OH)yF0,63 = 30 NZn0,08Zr(OH)yF0,32 = 30 По аналогии были синтезированы и Cu- Zr(OH)xFy-содержащие слои
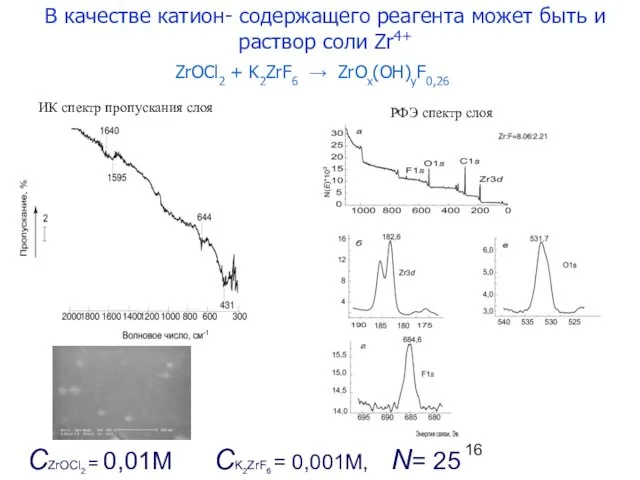
- 16. CK2ZrF6 = 0,001M, N= 25 CZrOCl2 = 0,01M ZrOCl2 + K2ZrF6 → ZrOx(OH)yF0,26 В качестве катион-
- 17. NZn0,13Zr(OH)x(C2O4)y = 25 NMg1,6Al(OH)x(CO3)y = 35 РЕАГЕНТЫ И СОСТАВ СЛОЕВ, СИНТЕЗИРОВАННЫХ С ИСПОЛЬЗОВАНИЕМ ОКСАЛАТНЫХ КОМПЛЕКСОВ МЕТАЛЛОВ
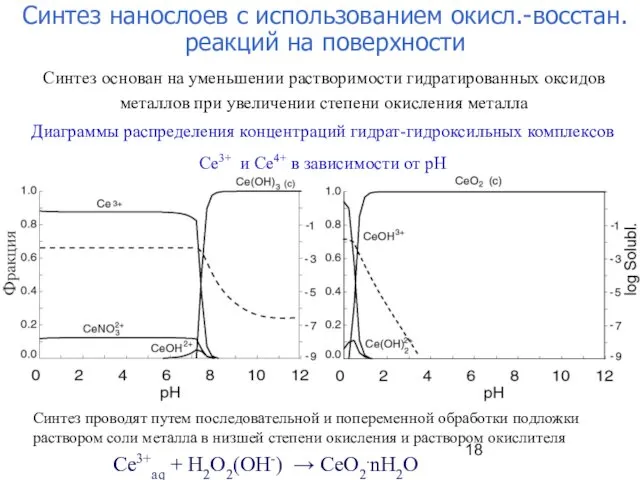
- 18. Диаграммы распределения концентраций гидрат-гидроксильных комплексов Ce3+ и Ce4+ в зависимости от рН Ce3+aq + H2O2(OH-) →
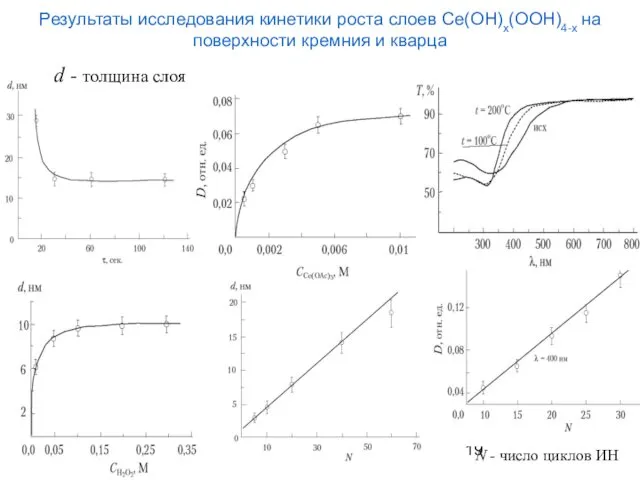
- 19. Результаты исследования кинетики роста слоев Ce(OH)x(OOH)4-x на поверхности кремния и кварца d - толщина слоя N
- 20. ПРИМЕРЫ СИНТЕЗА СЛОЕВ С ИСПОЛЬЗОВАНИЕМ ОКСИЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ НА ПОВЕРХНОСТИ Спектры пропускания слоев на поверхности кварца
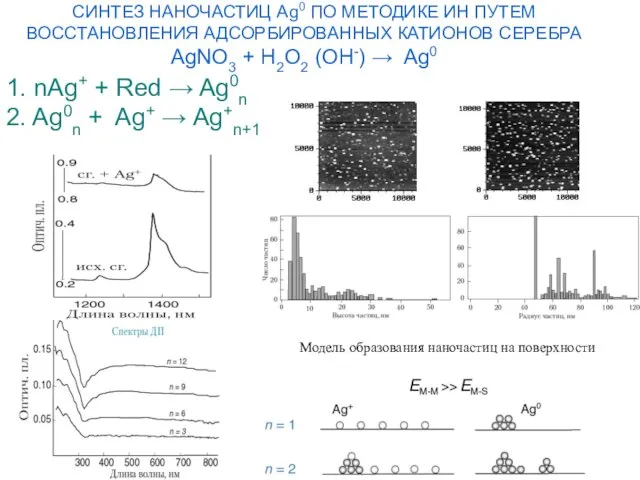
- 21. СИНТЕЗ НАНОЧАСТИЦ Ag0 ПО МЕТОДИКЕ ИН ПУТЕМ ВОССТАНОВЛЕНИЯ АДСОРБИРОВАННЫХ КАТИОНОВ СЕРЕБРА AgNO3 + H2O2 (OH-) →
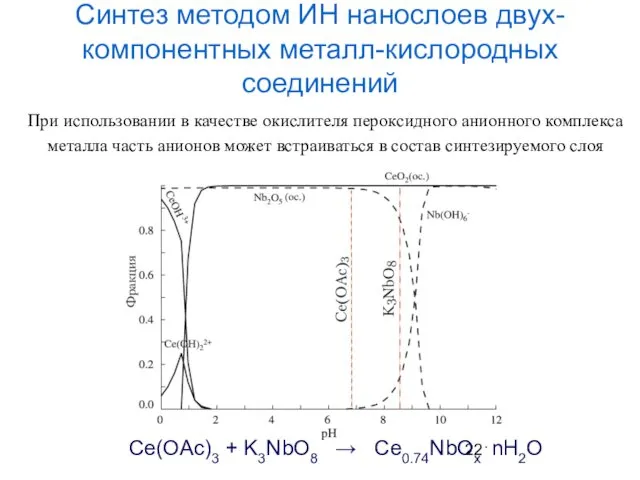
- 22. Синтез методом ИН нанослоев двух-компонентных металл-кислородных соединений Ce(OAc)3 + K3NbO8 → Ce0.74NbOx⋅nH2O При использовании в качестве
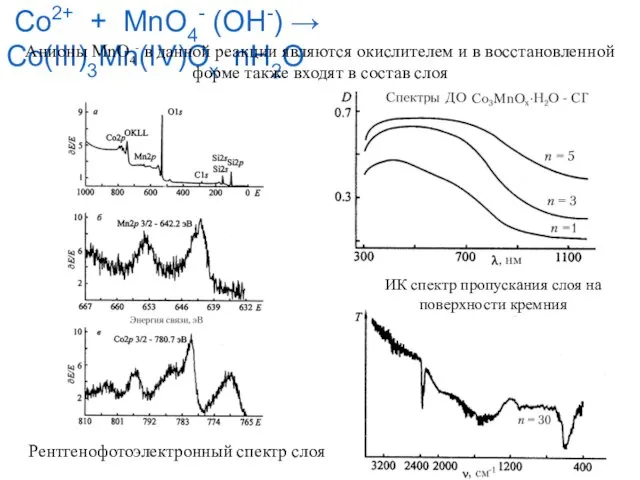
- 23. Co2+ + MnO4- (OH-) → Co(III)3Mn(IV)Ox⋅nH2O Анионы MnO4- в данной реакции являются окислителем и в восстановленной
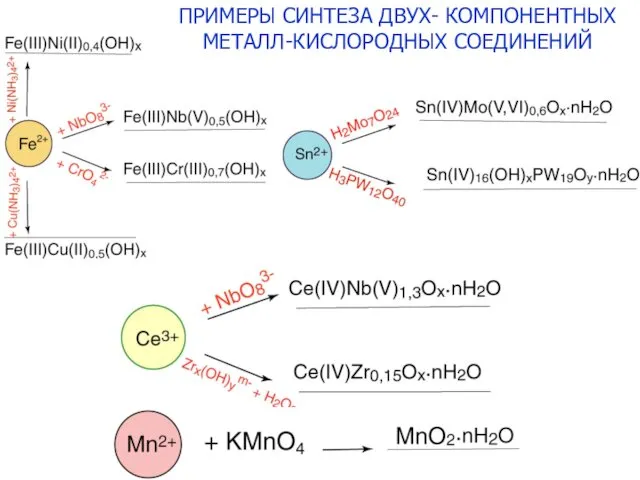
- 24. ПРИМЕРЫ СИНТЕЗА ДВУХ- КОМПОНЕНТНЫХ МЕТАЛЛ-КИСЛОРОДНЫХ СОЕДИНЕНИЙ
- 25. Синтез методом ИН гибридных слоев металла и оксида [SiO2]OH + (Mn2+ + Ag+)n → [SiO2](MnO2⋅xAg0)n n
- 26. ПРИМЕРЫ РЕАКЦИЙ ИМН 1. [Si](SiOa)MbOH+ n[HFгаз + удал. изб. + La(NO3)3 (р-р) + удал. изб.]n +
- 28. Скачать презентацию







![1. ≡SiO- + [Zn(NH3)4]2+ ⇒ ≡SiO[Zn(NH3)4]+⋅ [Zn(NH3)4]2+изб 2. ≡SiO[Zn(NH3)4]+⋅[Zn(NH3)4]2+изб + промывка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/484422/slide-13.jpg)


![Синтез методом ИН гибридных слоев металла и оксида [SiO2]OH + (Mn2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/484422/slide-24.jpg)
MbOH+ n[HFгаз + удал. изб. + La(NO3)3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/484422/slide-25.jpg)
 Способы изменения давления в природе и жизни человека (7 класс)
Способы изменения давления в природе и жизни человека (7 класс) Что изучает физика?
Что изучает физика? Звукові коливання 5 клас
Звукові коливання 5 клас Радиационный теплообмен. Основные понятия радиационного переноса теплоты. (Тема 3. Лекции 10,11)
Радиационный теплообмен. Основные понятия радиационного переноса теплоты. (Тема 3. Лекции 10,11) Лекция 1. Моделирование процессов и систем
Лекция 1. Моделирование процессов и систем Вес тела
Вес тела Трансформаторы и их виды
Трансформаторы и их виды МОУ Первомайская средняя общеобразовательная школа. Презентация урока по физике в 11 классе. Тема: «Основные понятия и величины
МОУ Первомайская средняя общеобразовательная школа. Презентация урока по физике в 11 классе. Тема: «Основные понятия и величины Монтаж, техническая эксплуатация и ремонт холодильного шкафа для продуктов двухдверного
Монтаж, техническая эксплуатация и ремонт холодильного шкафа для продуктов двухдверного Радиационные эффекты и уровни радиации
Радиационные эффекты и уровни радиации Основные понятия и законы теории электромагнитного поля и теории электрических цепей
Основные понятия и законы теории электромагнитного поля и теории электрических цепей Математическая модель процесса в химическом реакторе. (Лекция 2)
Математическая модель процесса в химическом реакторе. (Лекция 2) Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения Презентация по физике "Закон Ома" - скачать
Презентация по физике "Закон Ома" - скачать  Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях
Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях Сила упругости
Сила упругости Электрический ток в вакууме
Электрический ток в вакууме Разновидности уравнений материальных балансов ВТП. Материальные расчеты идеальных ВТП
Разновидности уравнений материальных балансов ВТП. Материальные расчеты идеальных ВТП Экспериментальные исследования воспламенения древесины под воздействием динамического потока лучистой энергии
Экспериментальные исследования воспламенения древесины под воздействием динамического потока лучистой энергии Основы физики лазеров
Основы физики лазеров Корпусирование микроэлектромеханических систем
Корпусирование микроэлектромеханических систем Игра по теме
Игра по теме Вiд фiзики до радiотехнiки. Зв`язок мiж електрикою та магнетизмом. Дослiди Ерстеда
Вiд фiзики до радiотехнiки. Зв`язок мiж електрикою та магнетизмом. Дослiди Ерстеда Измерение температуры
Измерение температуры Динамика. Основные понятия
Динамика. Основные понятия Презентация по физике "Воздухоплавание 7 класс" - скачать
Презентация по физике "Воздухоплавание 7 класс" - скачать  Контрольная работа по теме Законы постоянного тока
Контрольная работа по теме Законы постоянного тока Плавление и отвердевание кристаллических тел
Плавление и отвердевание кристаллических тел