Содержание
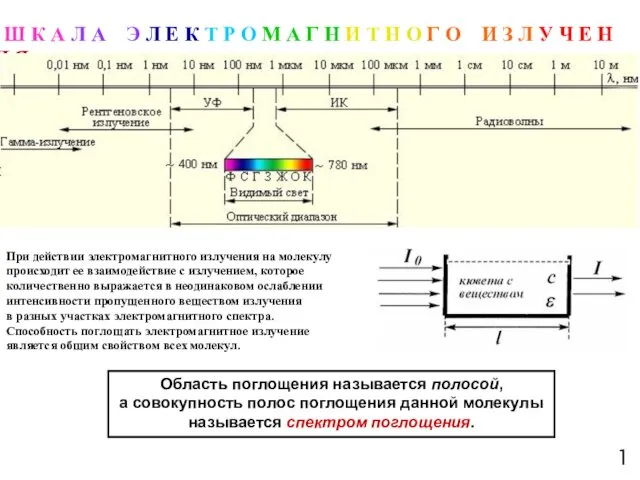
- 2. 1 Ш К А Л А Э Л Е К Т Р О М А Г
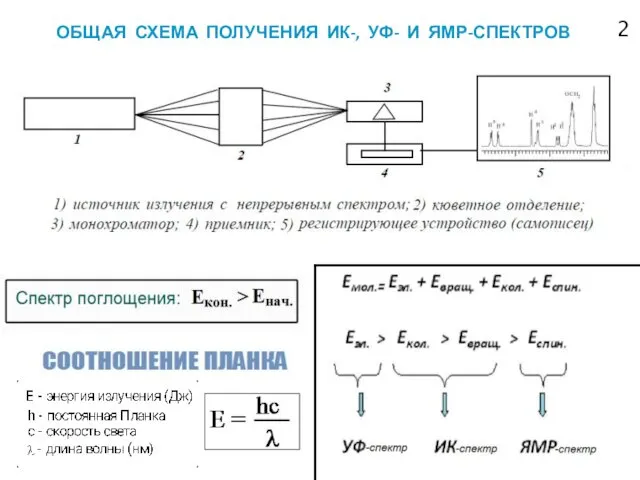
- 3. ОБЩАЯ СХЕМА ПОЛУЧЕНИЯ ИК-, УФ- И ЯМР-СПЕКТРОВ 2
- 4. ОБЛАСТИ ЭЛЕКТРОМАГНИТНОГО СПЕКТРА 3 ПОЛУЧАЕМАЯ ИЗ СПЕКТРОВ ИНФОРМАЦИЯ
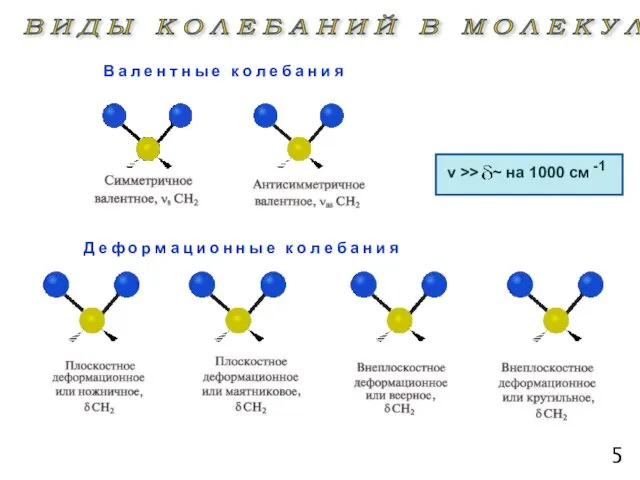
- 5. ИНФРАКРАСНАЯ
- 6. ν >> 5 -1 ~ на 1000 см В а л е н т н ы
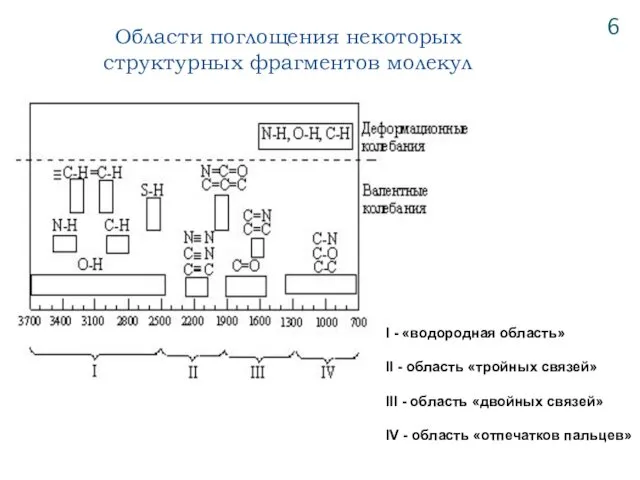
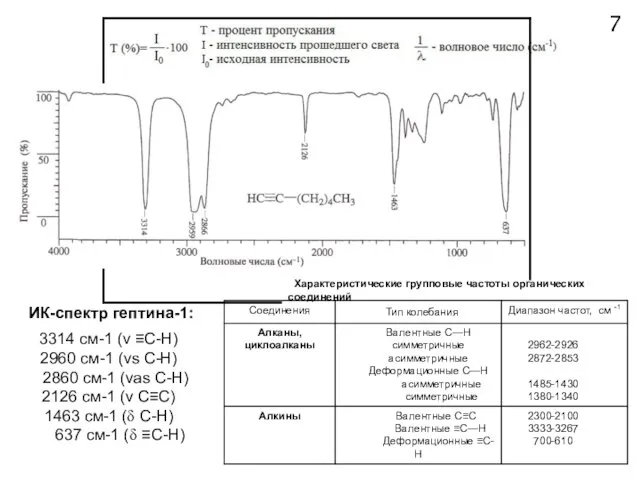
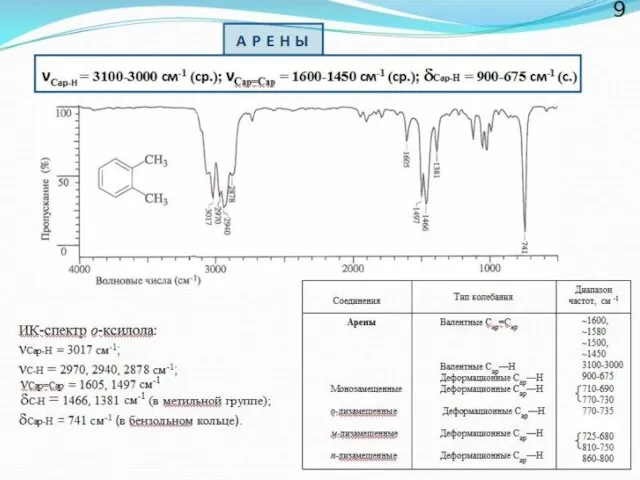
- 7. Области поглощения некоторых структурных фрагментов молекул 6 I - «водородная область» II - область «тройных связей»
- 8. ИК-спектр гептина-1: 7 Характеристические групповые частоты органических соединений 3314 см-1 (ν ≡С-Н) 2960 см-1 (νs С-Н)
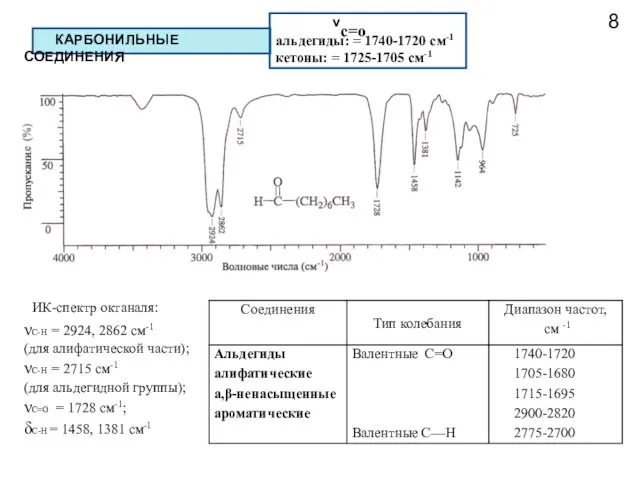
- 9. 8 КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ νс=о альдегиды: = 1740-1720 см-1 кетоны: = 1725-1705 см-1 νC-Н = 2924, 2862
- 11. Лекция №3. и видимой области _______________________________ ______________________________________ С п е к т р о с к
- 12. 11 Соотношение «цвета» излучения, поглощенного веществом и видимой окраски вещества Неокрашенные вещества поглощают излучение УФ области
- 13. 12 ТИПЫ МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Возможные типы электронных переходов Электроны в молекуле могут находиться на: АО (А)
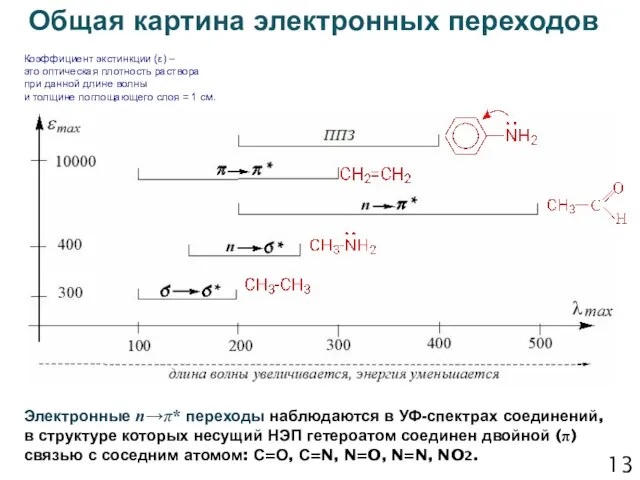
- 14. 13 Общая картина электронных переходов Коэффициент экстинкции (ε) – это оптическая плотность раствора при данной длине
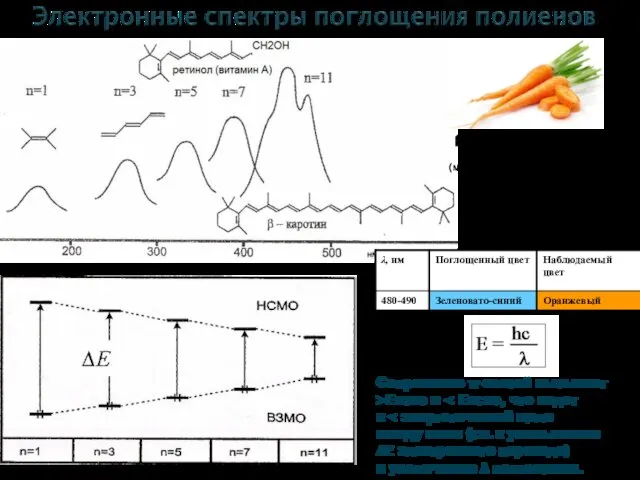
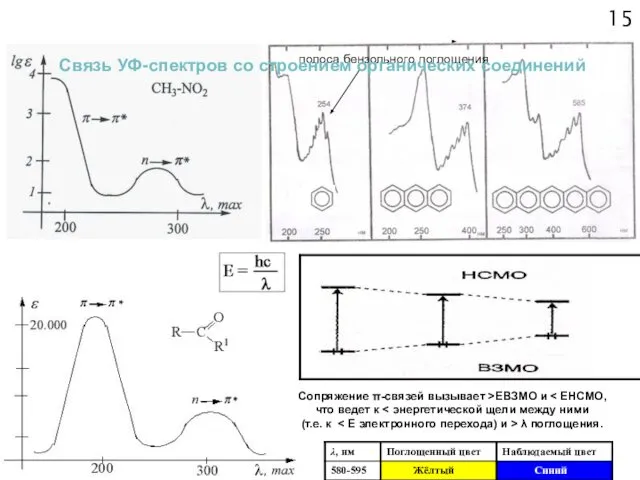
- 15. 14 Сопряжение π-связей вызывает >ЕВЗМО и к между ними (т.е. к уменьшению ∆Е электронного перехода) и
- 16. 15 Сопряжение π-связей вызывает >ЕВЗМО и что ведет к (т.е. к λ поглощения. полоса бензольного поглощения
- 17. СПЕКТРОСКОПИЯ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА _____________
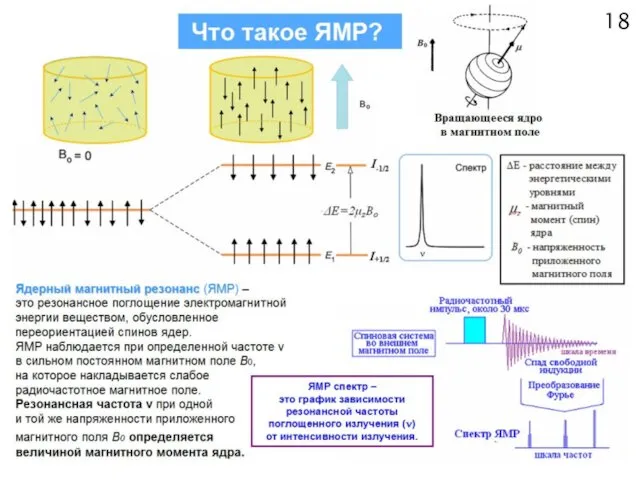
- 18. МАГНИТНЫЕ СВОЙСТВА ЯДЕР СПИНОВОЕ КВАНТОВОЕ ЧИСЛО ЯДРА I = 0, 1/2, 1, 3/2, 2… 9/2 ЯДРО
- 19. 18
- 20. Смещение резонансной частоты поглощения (ν) под влиянием электронного окружения называется химическим сдвигом δ (м.д). Химический сдвиг
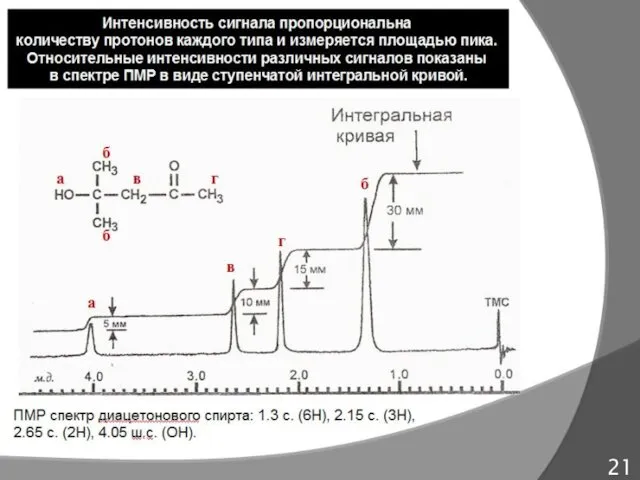
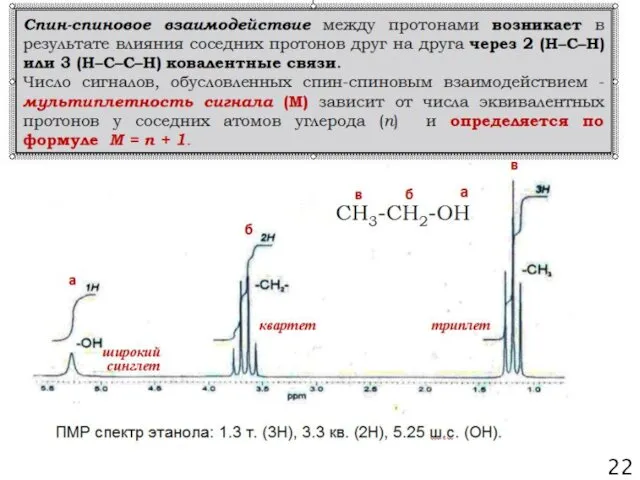
- 21. Характеристики сигналов в спектрах ПМР 20 синглет (с.) дублет (д.) триплет (т.) квадруплет (кв.) 1) химический
- 22. 21
- 23. 12 22
- 25. Скачать презентацию









 Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности
Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности Система ТО и ремонта, подготовка к ремонту
Система ТО и ремонта, подготовка к ремонту Машиноведение
Машиноведение Работа. Мощнось. Энергия
Работа. Мощнось. Энергия Расчёт стоимости электроэнергии, потребляемой бытовыми электроприборами
Расчёт стоимости электроэнергии, потребляемой бытовыми электроприборами Жылудың конвекциямен және сәулеленумен берілуі
Жылудың конвекциямен және сәулеленумен берілуі Искусственные спутники Земли
Искусственные спутники Земли Диффузия в домашних опытах
Диффузия в домашних опытах Экологическая оценка наноструктурированных материалов в архитектуре
Экологическая оценка наноструктурированных материалов в архитектуре Электромагнитные явления
Электромагнитные явления Презентация по физике "Кинематика" - скачать _
Презентация по физике "Кинематика" - скачать _ Фотоаппараты специального назначения, предназначенные для определенных видов фоторабот
Фотоаппараты специального назначения, предназначенные для определенных видов фоторабот Презентация по физике "Физика твёрдого тела" - скачать
Презентация по физике "Физика твёрдого тела" - скачать  Ударные волны и автоволны. Вязкость. Уравнение Ньютона
Ударные волны и автоволны. Вязкость. Уравнение Ньютона Силы в природе
Силы в природе Конденсатор. Накопитель заряда
Конденсатор. Накопитель заряда Презентація на тему:
Презентація на тему:  Классификация и особенности работы ДВС
Классификация и особенности работы ДВС Рабочие жидкости гидросистем и их свойства. Выбор рабочих жидкостей и требования к ним. (Лекция 2)
Рабочие жидкости гидросистем и их свойства. Выбор рабочих жидкостей и требования к ним. (Лекция 2) Электрическое поле
Электрическое поле Muscle vibrating drive - STANLEY
Muscle vibrating drive - STANLEY Терия относительности
Терия относительности Физические процессы в биологических мембранах. (Лекции 8, 9)
Физические процессы в биологических мембранах. (Лекции 8, 9) Сообщающиеся сосуды
Сообщающиеся сосуды Презентация по физике "Методика расчёта многослойных катушек" - скачать бесплатно
Презентация по физике "Методика расчёта многослойных катушек" - скачать бесплатно Презентация по физике "Сила. Сила тяжести" - скачать
Презентация по физике "Сила. Сила тяжести" - скачать  Звуковые пьезоизлучатели
Звуковые пьезоизлучатели Неделя математики, физики, информатики
Неделя математики, физики, информатики