Содержание
- 2. ОБЩИЕ АСПЕКТЫ СПЕКТРОСКОПИИ
- 3. СПЕКТР ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- 4. Характеристики электромагнитного излучения Частота излучения(ν) [c-1] Длинна волны (λ) [м] Волновое число (ν~ ) [м-1] Скорость
- 5. КВАНТОВАНИЕ ИЗЛУЧЕНИЯ Постулат Планка: излучение распространяется в пространстве и времени не непрерывным потоком, а отдельными порциями
- 6. Основные взаимосвязи между характеристиками излучения С = λν (2) ν~ = 1/λ (3) Е = hν
- 7. Происхождение спектров
- 8. Составляющие энергии молекулы Емол = Еэл + Екол + Евр Емол - энергия молекулы; Еэл –
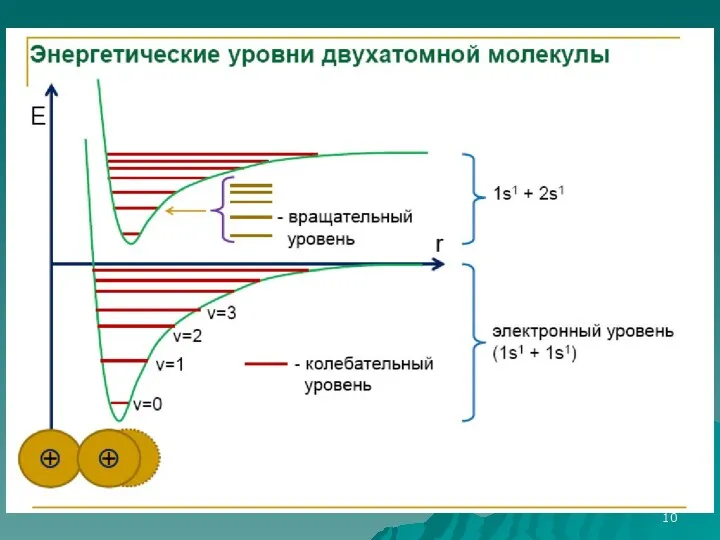
- 9. Иерархия энергетических уровней молекулы
- 11. Разновидности спектральных методов
- 12. УФ И ВИДИМАЯ СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
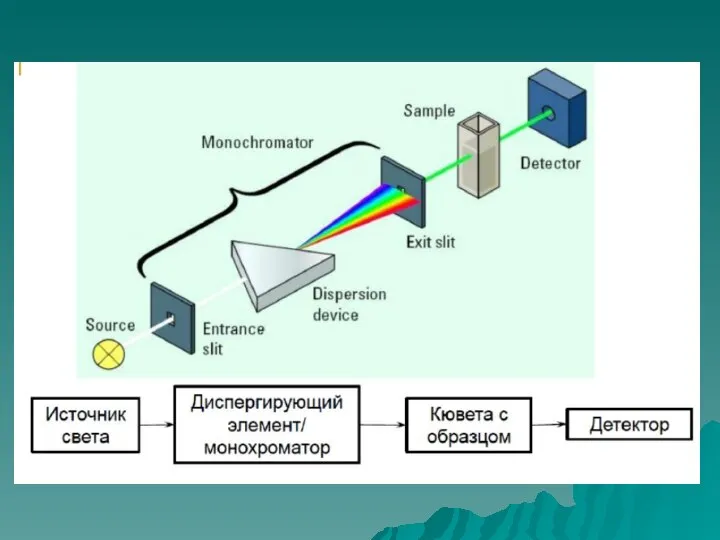
- 13. Монохроматическое излучение (т.е. с определенной длиной волны) от источника c интенсивностью (мощностью) I0 проходит через раствор
- 14. Закон Бера связывает интенсивности падающего и прошедшего через раствор света следующим образом: где: I0 – интенсивность
- 15. Закон Бера применим и к растворам, содержащим несколько поглощающих веществ, при условии, что между разными соединениями
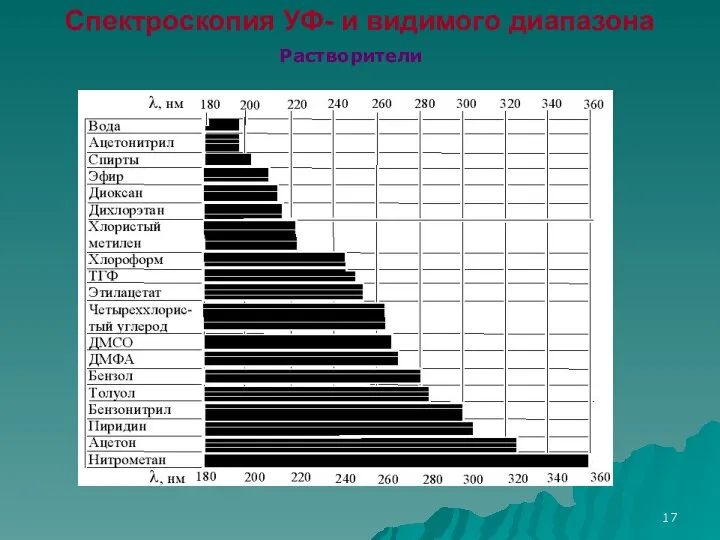
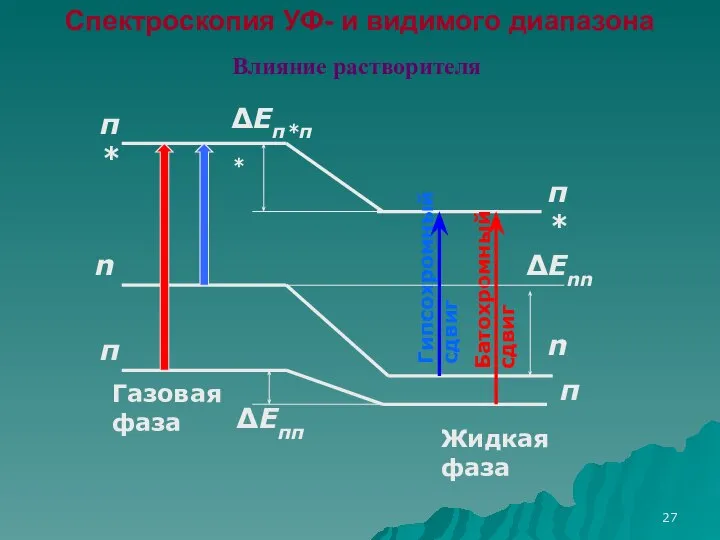
- 17. Спектроскопия УФ- и видимого диапазона Растворители
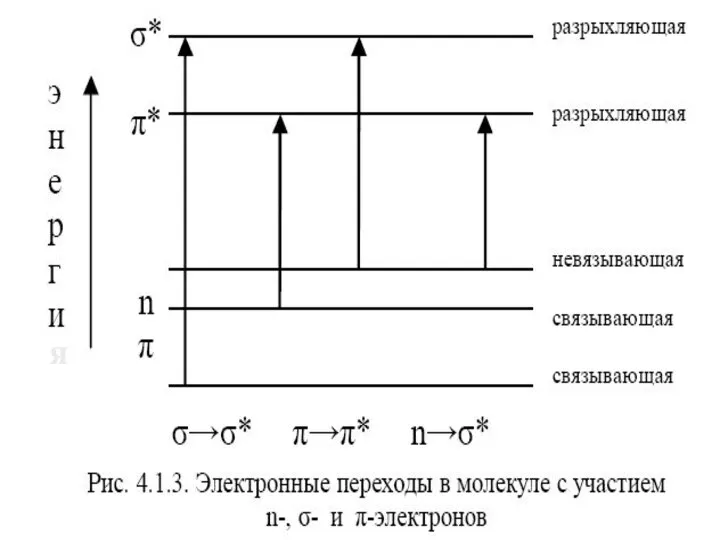
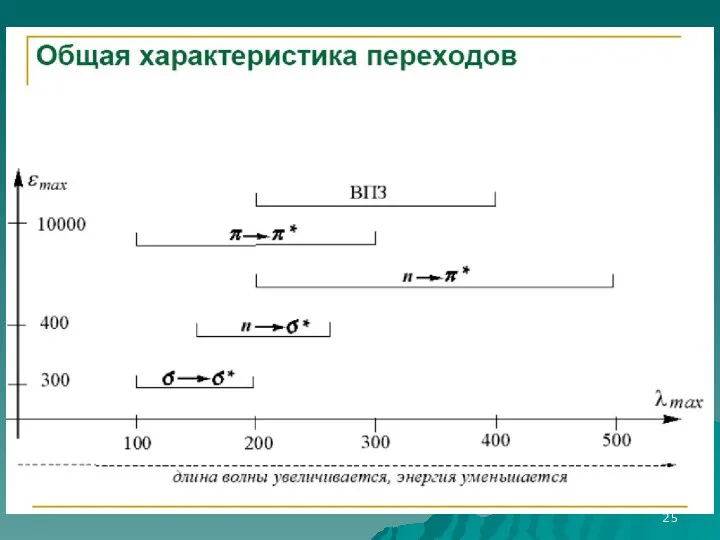
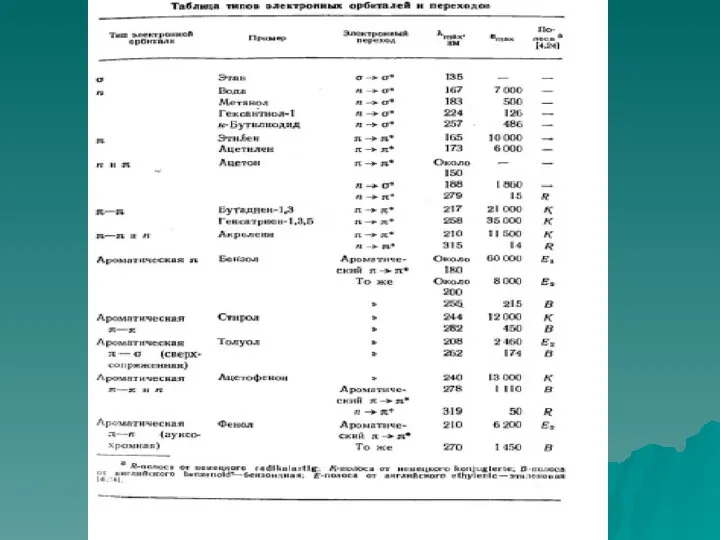
- 21. Электронные переходы Светопоглощение молекул в УФ-видимой области связано с возбуждением валентных электронов, находящихся в различных состояниях
- 22. Для молекулярных электронных переходов также справедливы определенные правила отбора. Они связаны с изменением спинового состояния, симметрии
- 23. я
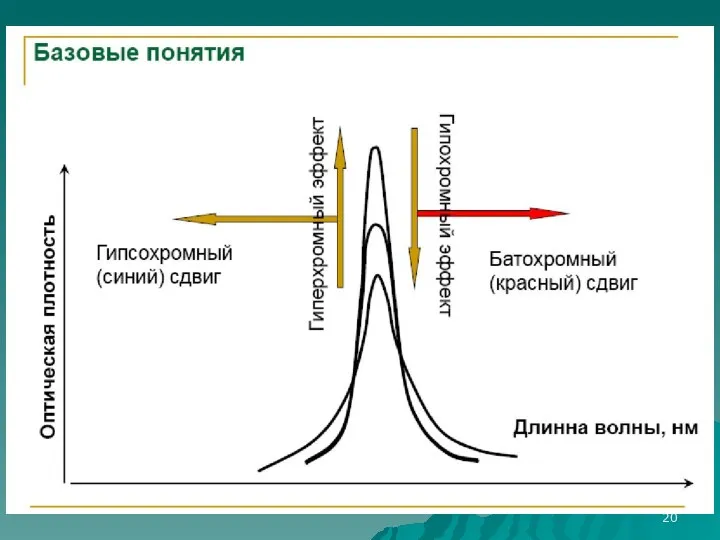
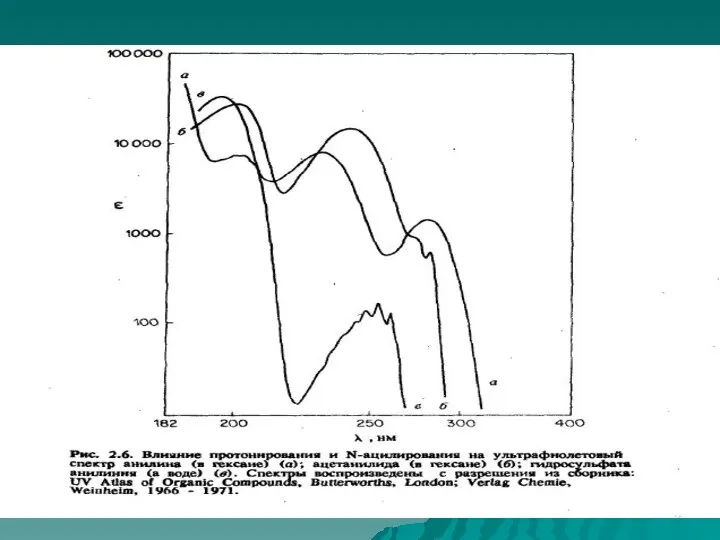
- 27. π π* π* π n n Газовая фаза Жидкая фаза Батохромный сдвиг Гипсохромный сдвиг ΔEππ ΔEπ*π*
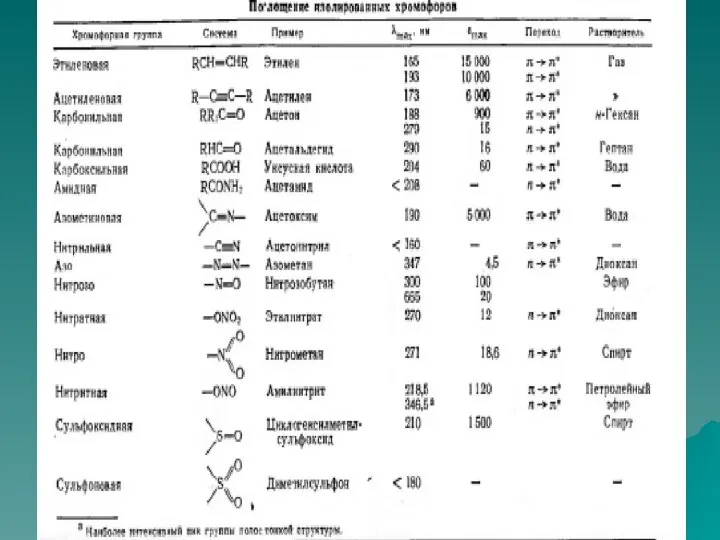
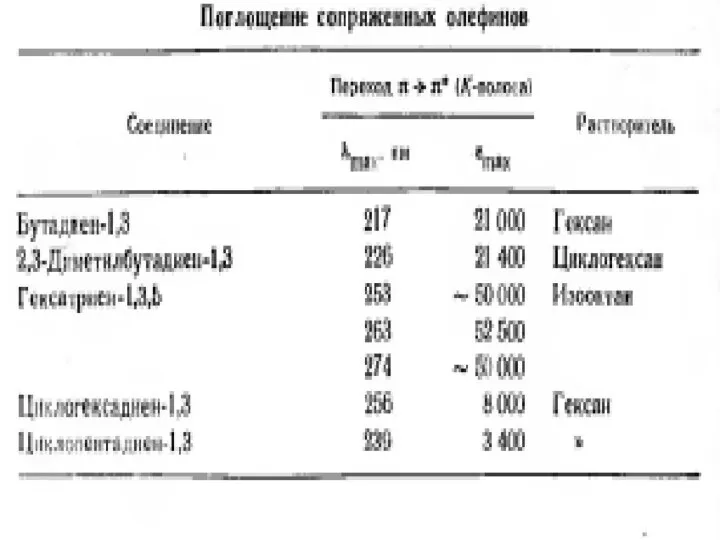
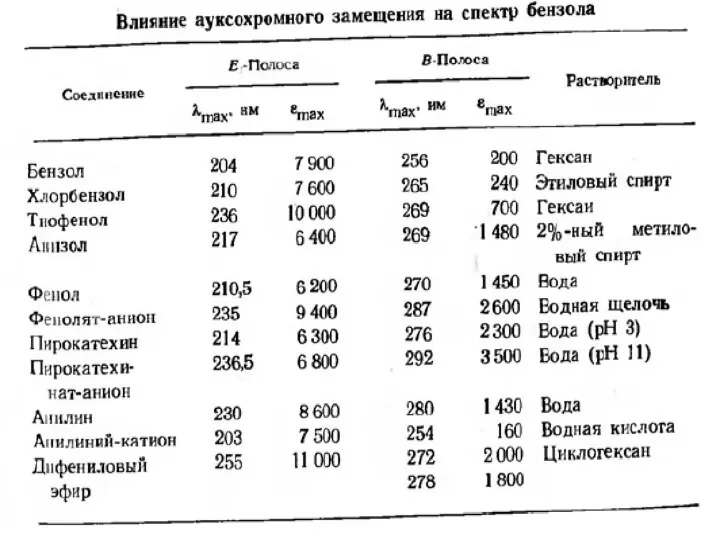
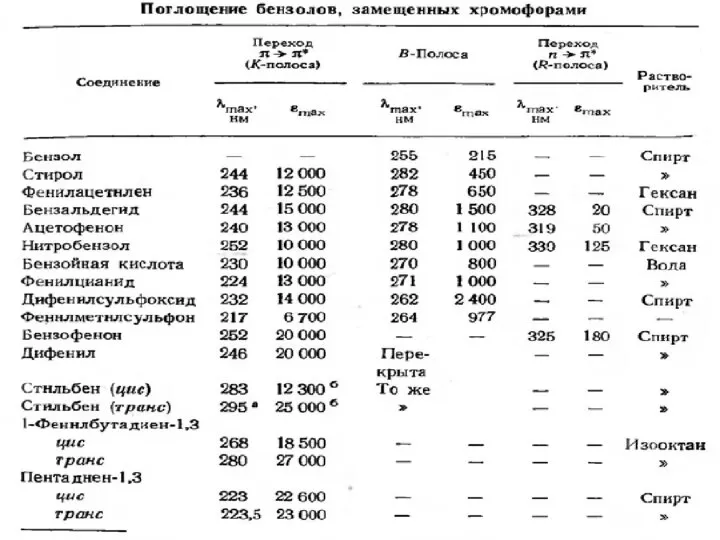
- 28. Спектроскопия УФ- и видимого диапазона Правило Вудворда и Физера
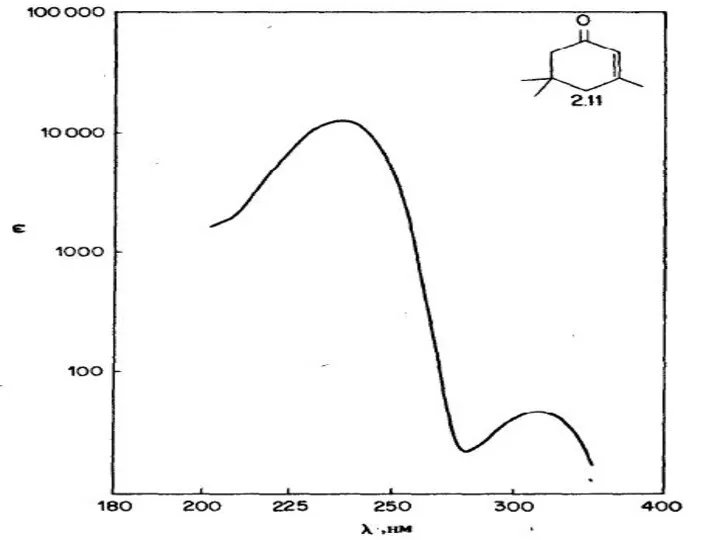
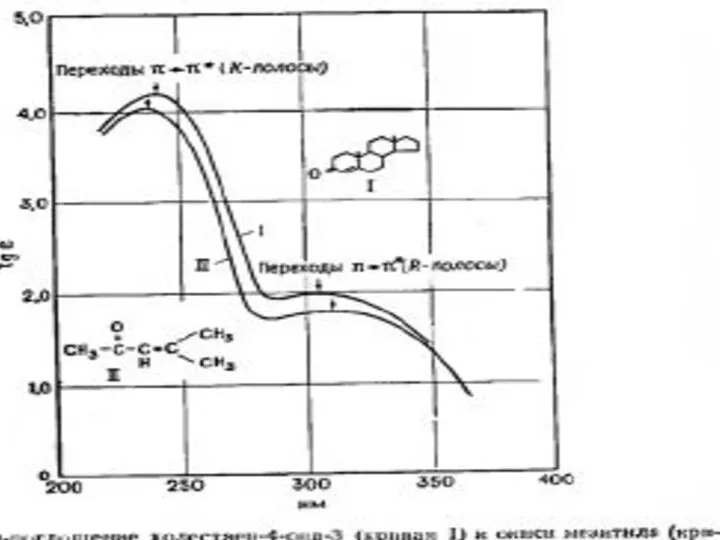
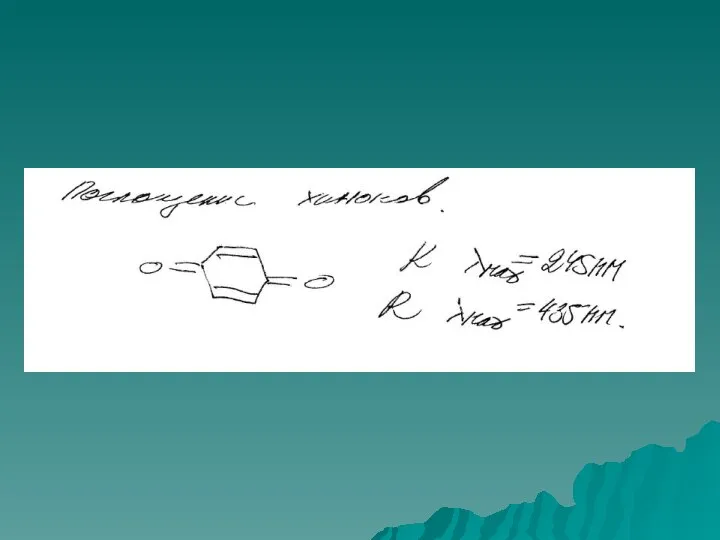
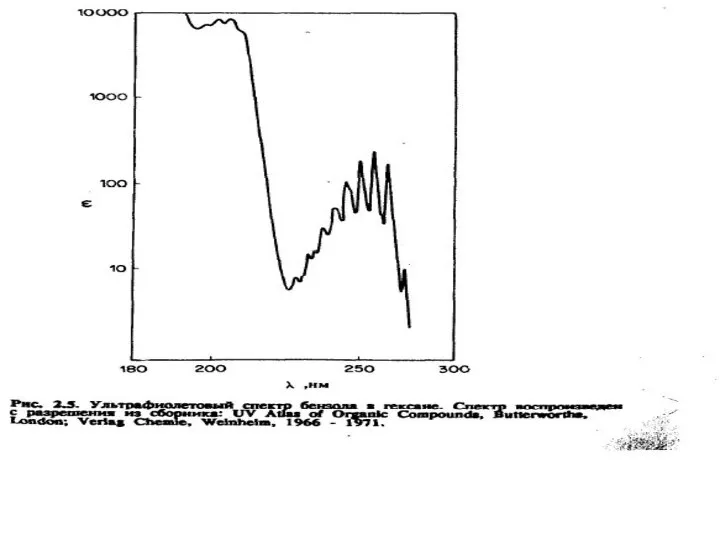
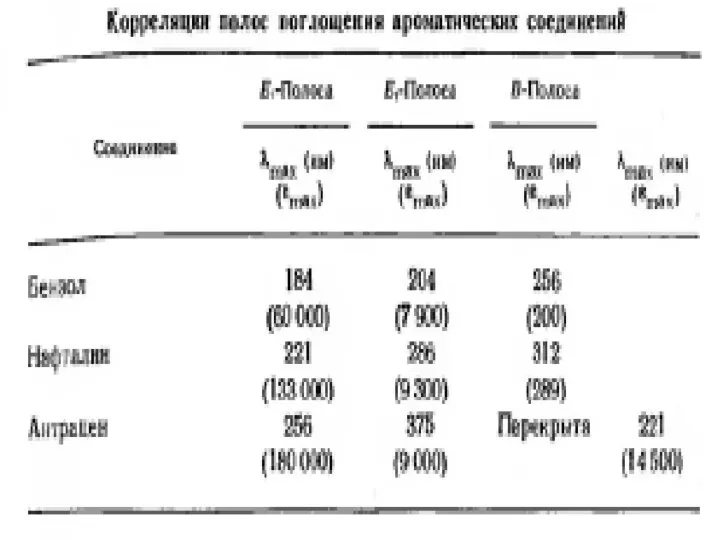
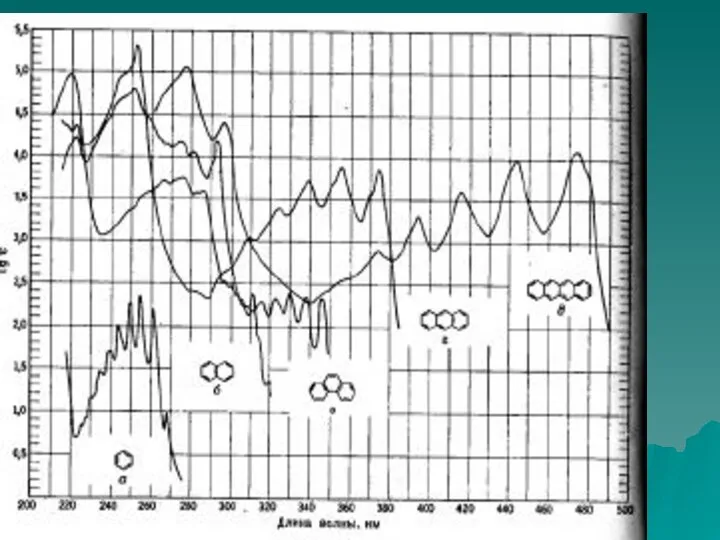
- 45. Примеры УФ - спектров
- 58. Скачать презентацию


![Характеристики электромагнитного излучения Частота излучения(ν) [c-1] Длинна волны (λ) [м] Волновое](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/742211/slide-3.jpg)

































 Электроны. История открытия.
Электроны. История открытия. Ядерное оружие
Ядерное оружие Численное моделирование реагирующих потоков. Введение в предмет
Численное моделирование реагирующих потоков. Введение в предмет Примеры инерции
Примеры инерции Измерение параметров инфракрасного и терагерцового излучения ч.2 Схемы измерения параметров
Измерение параметров инфракрасного и терагерцового излучения ч.2 Схемы измерения параметров Задняя подвеска автомобиля Volkswagen Golf 5
Задняя подвеска автомобиля Volkswagen Golf 5 Звуковые волны. Скорость звука
Звуковые волны. Скорость звука Презентация Как образуется роса, иней, дождь и снег?
Презентация Как образуется роса, иней, дождь и снег?  Аттестационная работа. Электролиз. Применение электролиза
Аттестационная работа. Электролиз. Применение электролиза Пароутворення та конденсація Підготувала Учениця 10-Б класу ЗОШ І-ІІІ ст. №11 м. Сміла Відняк Людмила
Пароутворення та конденсація Підготувала Учениця 10-Б класу ЗОШ І-ІІІ ст. №11 м. Сміла Відняк Людмила  ЭЛЕМЕНТЫ ЯДЕРНОЙ ФИЗИКИ В РАДИАЦИОННОЙ ГИГИЕНЕ Часть 1. Строение атома
ЭЛЕМЕНТЫ ЯДЕРНОЙ ФИЗИКИ В РАДИАЦИОННОЙ ГИГИЕНЕ Часть 1. Строение атома Техническое обслуживание консольно-фрезерный станок 6Р83Ш
Техническое обслуживание консольно-фрезерный станок 6Р83Ш Явление электромагнитной индукции
Явление электромагнитной индукции Что такое минералы
Что такое минералы Лекция 17 Тема: Работа газа при его расширении. Внутренняя энергия и теплоемкость идеального газа.
Лекция 17 Тема: Работа газа при его расширении. Внутренняя энергия и теплоемкость идеального газа.  Динамика механической системы и твердого тела(§9 - §11). Теорема об изменении момента количества движения системы
Динамика механической системы и твердого тела(§9 - §11). Теорема об изменении момента количества движения системы Қанның қан тамырларымен қозғалысының гемодинамикалық заңдылықтары. (Дәріс 11)
Қанның қан тамырларымен қозғалысының гемодинамикалық заңдылықтары. (Дәріс 11) Напівпровідники
Напівпровідники Прямолинейные колебания точки
Прямолинейные колебания точки Електричний заряд. Електричне поле. Закон Кулона
Електричний заряд. Електричне поле. Закон Кулона Вращение звезд. (Тема 17)
Вращение звезд. (Тема 17) Рулевое управление. Устройство и работа
Рулевое управление. Устройство и работа Физикадағы демонстрациялы тәжрибе және оқытудағы процесстері
Физикадағы демонстрациялы тәжрибе және оқытудағы процесстері Нове застосування лінз Нове застосування лінз
Нове застосування лінз Нове застосування лінз  Законы преломления.
Законы преломления. Прямой метод решения уравнений в матричной форме. Организация итерационного процесса. Проблема сходимости численных схем
Прямой метод решения уравнений в матричной форме. Организация итерационного процесса. Проблема сходимости численных схем Конструирование твэл: твэлы с металлическим и дисперсионным топливом. Лекция10
Конструирование твэл: твэлы с металлическим и дисперсионным топливом. Лекция10 Аттестационная работа. Проведение проектно–исследовательской работ по физике в 7 классе по теме Смачивание и капиллярность
Аттестационная работа. Проведение проектно–исследовательской работ по физике в 7 классе по теме Смачивание и капиллярность