Содержание
- 2. Содержание лекции Статика межфазного распределения при катионообменном механизме извлечения. Вывод гиперболической изотермы на основании закона действующих
- 3. Реакции катионного обмена где Мz+ - катион сорбата-микрокомпонента с зарядом z+; R- - полианион матрицы сорбента
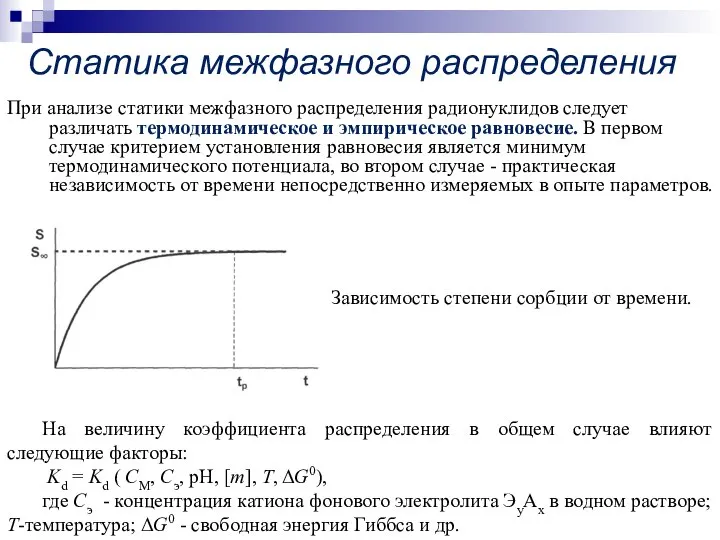
- 4. При анализе статики межфазного распределения радионуклидов следует различать термодинамическое и эмпирическое равновесие. В первом случае критерием
- 5. Предположим, что процесс межфазного распределения протекает по реакции катионного обмена: В соответствии с законом действующих масс
- 6. Изотерма Генри Условия выполнения изотермы Генри: Сорбцию ведут из разбавленных растворов, следовательно, fM = const. Взаимодействия
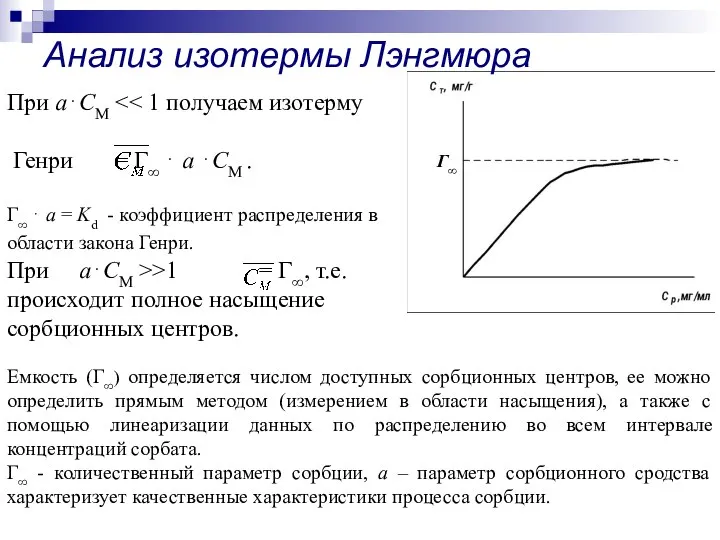
- 7. Теория Ленгмюра является фундаментальным вкладом в учение о сорбции. Наиболее сильное отклонение от закона Генри связаны
- 8. Ионообменные центры поглотителя могут быть заняты либо ионами сорбата, либо ионами конкурента: Г∞= + - полная
- 9. При а⋅CM Генри = Г∞ ⋅ а ⋅CM . Г∞ ⋅ а = Kd - коэффициент
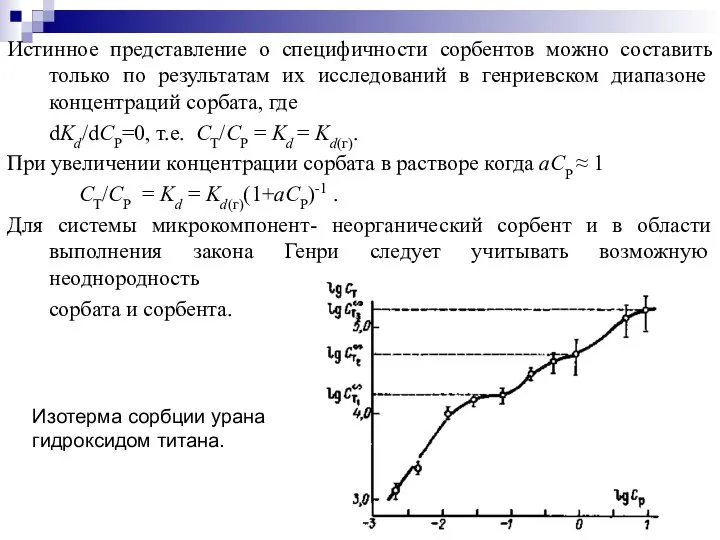
- 10. Истинное представление о специфичности сорбентов можно составить только по результатам их исследований в генриевском диапазоне концентраций
- 11. Влияние удельного содержания сорбента в системе Сорбат-микрокомпонент представлен единственной формой. Сорбционное пове-дение описывается законом Генри: ε
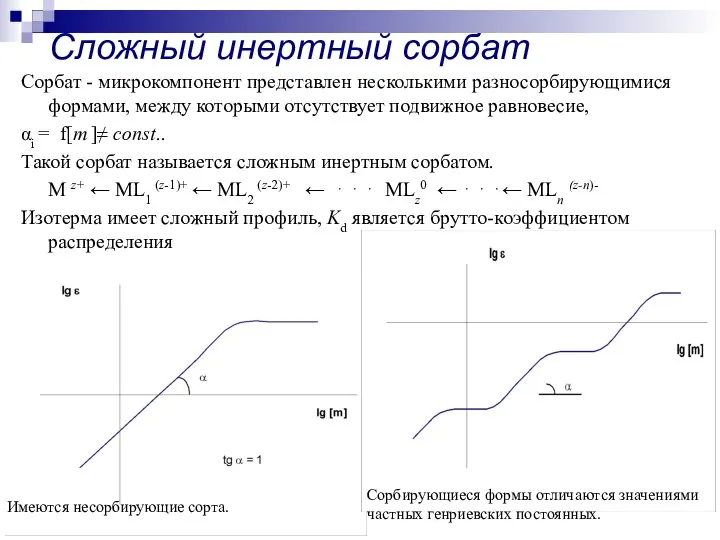
- 12. Сложный инертный сорбат Сорбат - микрокомпонент представлен несколькими разносорбирующимися формами, между которыми отсутствует подвижное равновесие, αi
- 13. Фоновый электролит называют нейтральным, если его хорошо диссоциирующая, растворимая соль ЭА при введении в раствор не
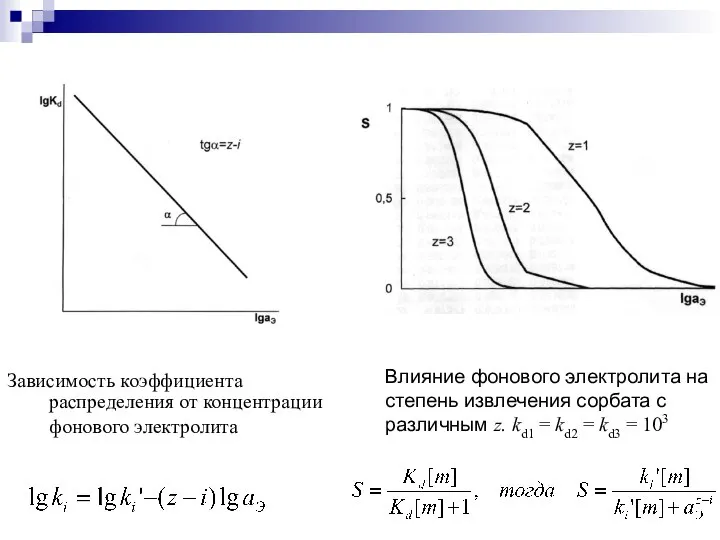
- 14. Зависимость коэффициента распределения от концентрации фонового электролита Влияние фонового электролита на степень извлечения сорбата с различным
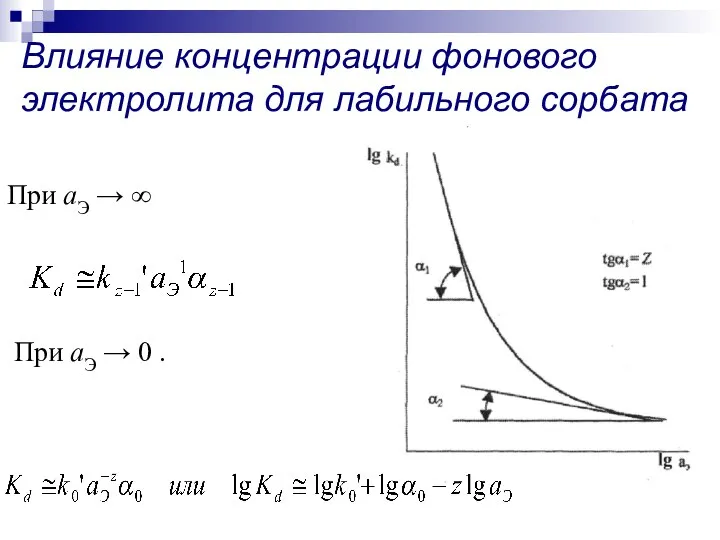
- 15. При аЭ → ∞ При аЭ → 0 . Влияние концентрации фонового электролита для лабильного сорбата
- 16. Влияние концентрации фонового электролита для инертного сорбата В случае инертного сорбата, представленного в растворе только сорбирующимися
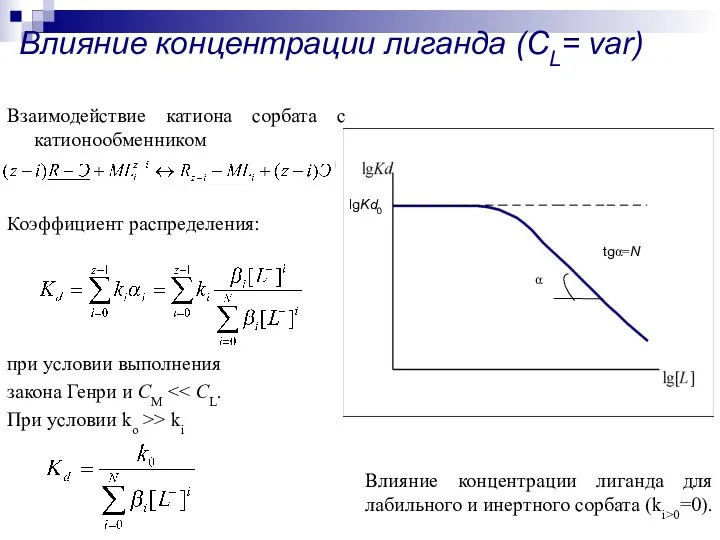
- 17. Влияние концентрации лиганда (CL= var) Взаимодействие катиона сорбата с катионообменником Коэффициент распределения: при условии выполнения закона
- 18. Определение констант образования комплексных соединений В методе Шуберта предполагается, что в растворе образуется только один комплексный
- 19. При изменении рН сорбат может участвовать в реакциях образования моноядерных гидроксокомплексов. Процесс сорбции происходит в соответствии
- 20. В условиях высокой ионной силы раствора сорбция положительно заряженных форм сорбата подавлена, в межфазном распределении участвует
- 21. Принимая aЭ+ = aH+ , получим для лабильного сорбата Для левой ассимптоты: Для правой ассимптоты: только
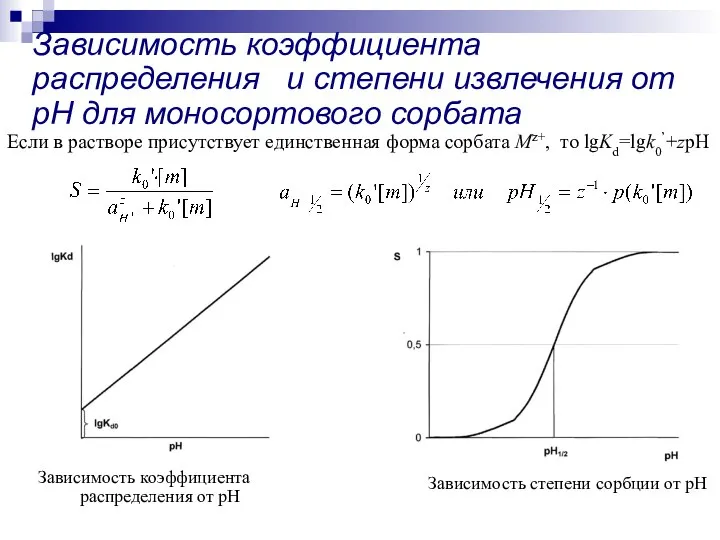
- 22. Зависимость коэффициента распределения и степени извлечения от рН для моносортового сорбата Зависимость коэффициента распределения от рН
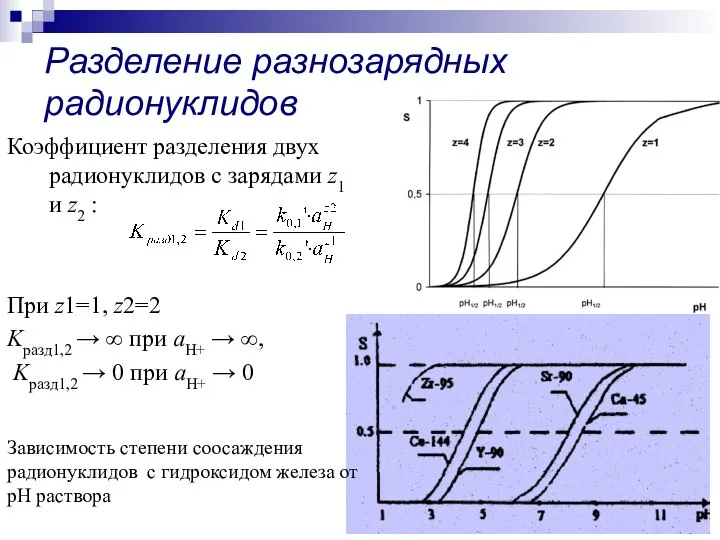
- 23. Разделение разнозарядных радионуклидов Коэффициент разделения двух радионуклидов с зарядами z1 и z2 : При z1=1, z2=2
- 24. Анализ изотермы График изотермы "lgKd-pH" в зависимости от соотношения величин ki, biT и [m] может иметь
- 25. Выводы Проанализировано влияние концентрации сорбата. Показано, что в случае сорбции микрокомпонентов выполняется изотерма Генри. Анализ изотермы
- 26. Выводы Показано влияние концентрации фонового электролита, лиганда, рН раствора на статику сорбции. В случае сильнокислотного катионита
- 28. Скачать презентацию
















 Физика в маслёнке Выполнила: Васнева Анастасия Сергеевна Ученица 9 «В» класса ГОУ СОШ № 1338 САО Наставник и руководител
Физика в маслёнке Выполнила: Васнева Анастасия Сергеевна Ученица 9 «В» класса ГОУ СОШ № 1338 САО Наставник и руководител Квантовые свойства света Силина Н. А. – МОУ СОШ №2 П. Редкино
Квантовые свойства света Силина Н. А. – МОУ СОШ №2 П. Редкино Основные понятия о взаимозаменяемости и точности в машиностроении
Основные понятия о взаимозаменяемости и точности в машиностроении Сообщающиеся сосуды
Сообщающиеся сосуды Нанопорошки металлов и их применение в технологии керамических материалов
Нанопорошки металлов и их применение в технологии керамических материалов Диод Шоттки
Диод Шоттки Закон всемирного тяготения
Закон всемирного тяготения Электрическое поле. Напряженность электрического поля. Линии напряженности электрического поля
Электрическое поле. Напряженность электрического поля. Линии напряженности электрического поля Взаимодействие тел. Второй закон Ньютона
Взаимодействие тел. Второй закон Ньютона Опасность лазерного излучения
Опасность лазерного излучения Нагревание воздуха и его температура
Нагревание воздуха и его температура Електричне коло та його складові (9 клас)
Електричне коло та його складові (9 клас) Движение тела по окружности с постоянной по модулю скоростью
Движение тела по окружности с постоянной по модулю скоростью Геометрическая оптика. Радуга
Геометрическая оптика. Радуга Динамика в физике. Динамика в спорте. Динамика в карате
Динамика в физике. Динамика в спорте. Динамика в карате Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики
Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики Электромагнетизм
Электромагнетизм Эффект Доплера в аккустике
Эффект Доплера в аккустике Ламинарное и турбулентное движения газа и жидкости
Ламинарное и турбулентное движения газа и жидкости Система мониторинга водного баланса Балтийского моря
Система мониторинга водного баланса Балтийского моря Тепловые двигатели
Тепловые двигатели Презентация Виды сил 7 класс
Презентация Виды сил 7 класс Конденсаторы. Электрическая емкость
Конденсаторы. Электрическая емкость Проектирование электроснабжения нефтяного месторождения «Небит-Даг»
Проектирование электроснабжения нефтяного месторождения «Небит-Даг» Festkörperphysik. Material design
Festkörperphysik. Material design Презентация по физике "Насыщенный пар. Влажность воздуха" - скачать
Презентация по физике "Насыщенный пар. Влажность воздуха" - скачать  Применение лазерных технологий («лазерный пинцет») для исследования динамики наномашин
Применение лазерных технологий («лазерный пинцет») для исследования динамики наномашин Естественная электрохимическая активность
Естественная электрохимическая активность