Содержание
- 2. Поверхностное натяжение Капиллярные явления
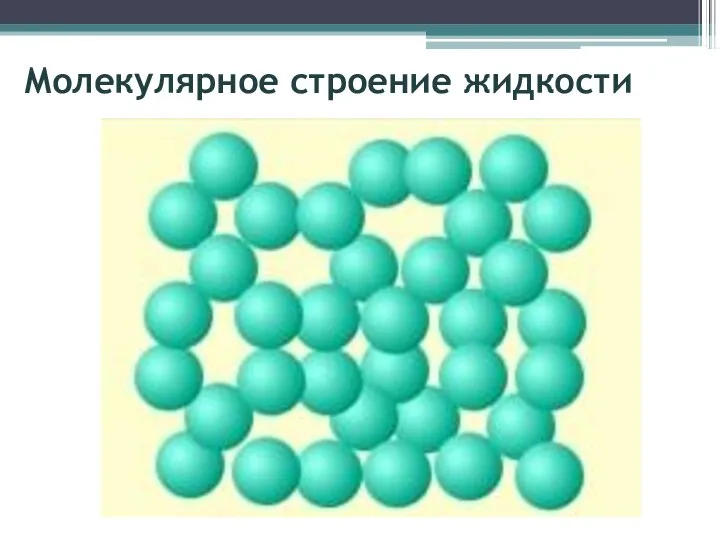
- 3. Молекулярное строение жидкости
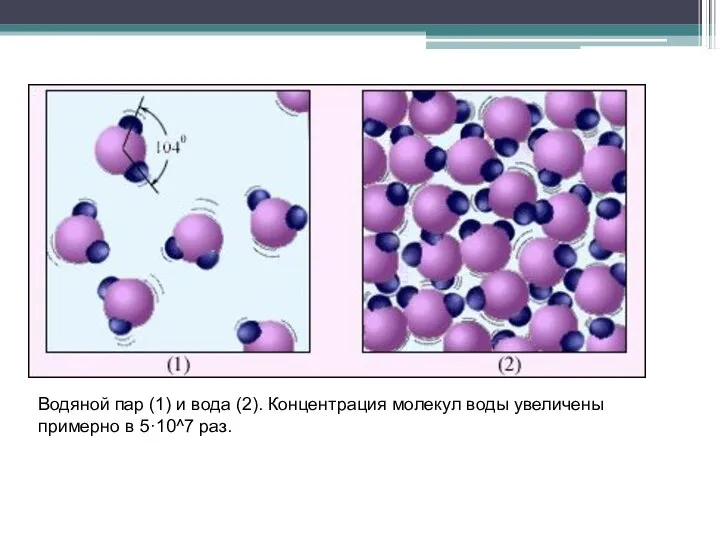
- 4. Водяной пар (1) и вода (2). Концентрация молекул воды увеличены примерно в 5·10^7 раз.
- 5. Жидкости, как и твердые тела, изменяют свой объем при изменении температуры. Для не очень больших интервалов
- 6. Коэффициент β называют температурным коэффициентом объемного расширения. Этот коэффициент у жидкостей в десятки раз больше, чем
- 7. Поверхностное натяжение — явление молекулярного давления на жидкость, вызванное, притяжением молекул поверхностного слоя к молекулам внутри
- 8. ΔAвнеш = σΔS. Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Коэффициент поверхностного натяжения равен
- 9. Поверхностное натяжение в природе
- 10. Смачивание и несмачивание притяжение между молекулами жидкости меньше чем между молекулами жидкости и поверхности притяжение между
- 11. Вблизи границы между жидкостью и твердым телом форма свободной поверхности жидкости зависит от сил взаимодействия молекул
- 12. Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то краевой
- 13. Капиллярные явления- это физические явления, обусловленные действием поверхностного натяжения на границе раздела несмешивающихся сред.
- 14. Капиллярный эффект — физическое явление, заключающееся в способности жидкостей изменять уровень в трубках, узких каналах произвольной
- 16. Скачать презентацию











 Литография. Виды литографии
Литография. Виды литографии Сейсмограф или сейсмометр
Сейсмограф или сейсмометр Применение кулачковых- кривошатунных и рычажных механизмов
Применение кулачковых- кривошатунных и рычажных механизмов Основы дозиметрии
Основы дозиметрии Атмосферное давление на разных высотах. Манометры
Атмосферное давление на разных высотах. Манометры Электромагнитные колебания
Электромагнитные колебания Классификация тракторов
Классификация тракторов Кампания ядерного реактора
Кампания ядерного реактора МОУ Первомайская средняя общеобразовательная школа. Презентация урока по физике в 11 классе. Тема: «Основные понятия и величины
МОУ Первомайская средняя общеобразовательная школа. Презентация урока по физике в 11 классе. Тема: «Основные понятия и величины Логические задачи области физики
Логические задачи области физики Антенно-фидерные устройства и распространение радиоволн
Антенно-фидерные устройства и распространение радиоволн дифракция света
дифракция света Физика в быту
Физика в быту Кинематика. Виды движения
Кинематика. Виды движения Плазма
Плазма Гипотеза де Бройля. Дифракция электронов. Микрочастица в двухщелевом интерферометре. Соотношение неопределенностей Гейзенберга
Гипотеза де Бройля. Дифракция электронов. Микрочастица в двухщелевом интерферометре. Соотношение неопределенностей Гейзенберга Научно - исследовательская работа Испарение жидкости. Факторы, влияющие на испарение жидкости
Научно - исследовательская работа Испарение жидкости. Факторы, влияющие на испарение жидкости Синергетика. Основные мировоззренческие идеи синергетики
Синергетика. Основные мировоззренческие идеи синергетики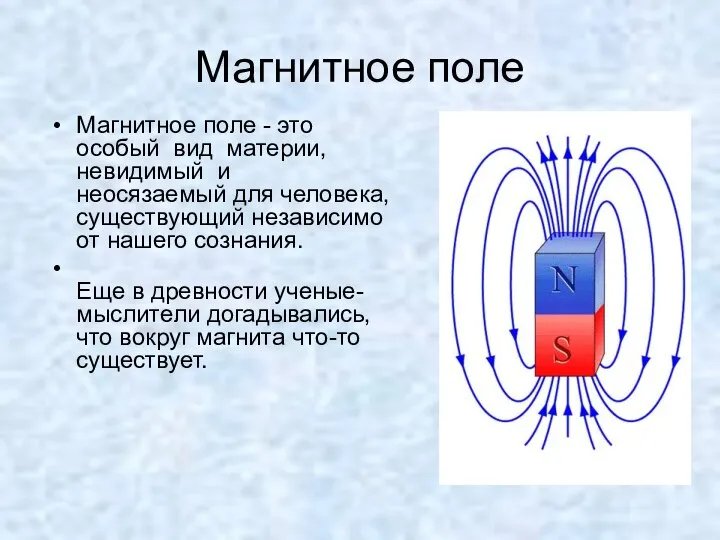 Магнитное поле Магнитное поле - это особый вид материи, невидимый и неосязаемый для человека, существующий н
Магнитное поле Магнитное поле - это особый вид материи, невидимый и неосязаемый для человека, существующий н Презентация по физике "Затухающие колебания" - скачать
Презентация по физике "Затухающие колебания" - скачать  История Левкит и Демокрит (379 г. до н.э.) – вещество из атомов (от греческого слова неделимый). Теория теплорода – невидимое и нев
История Левкит и Демокрит (379 г. до н.э.) – вещество из атомов (от греческого слова неделимый). Теория теплорода – невидимое и нев Презентация по физике "Уравнение Максвелла" - скачать
Презентация по физике "Уравнение Максвелла" - скачать  Электромагнитные излучения
Электромагнитные излучения Атомная физика
Атомная физика Основные типы межфазного распределения и их характеристики
Основные типы межфазного распределения и их характеристики Cadillac Eldorado 1954
Cadillac Eldorado 1954 Аттестационная работа. Использование проектно-исследовательской деятельности на уроках физики
Аттестационная работа. Использование проектно-исследовательской деятельности на уроках физики Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли