Содержание
- 2. Идеальная тепловая машина. Цикл Карно Наибольшим КПД при заданных температурах нагревателя T1 и холодильника T2 обладает
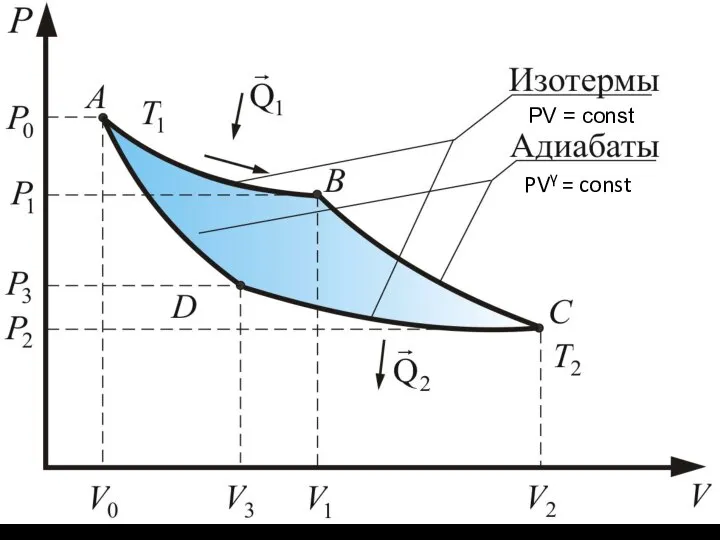
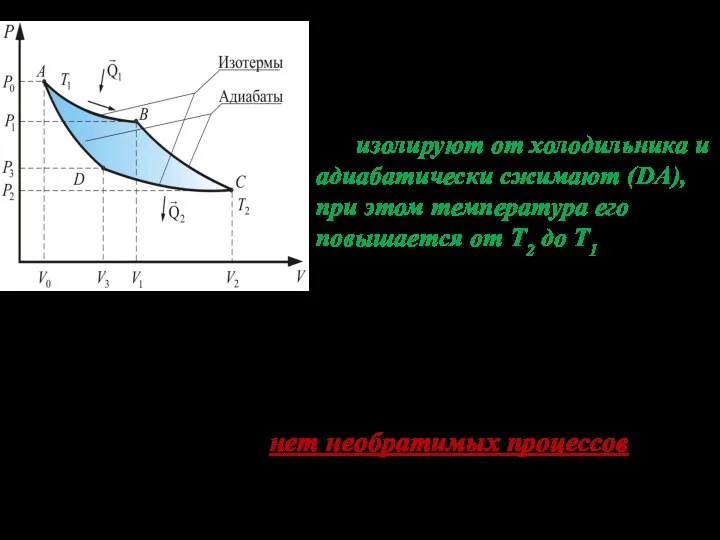
- 3. Тепловую машину, работающую по циклу Карно, называют идеальной, потому что в этом цикле отсутствуют необратимые процессы,
- 4. PV = const PVγ = const
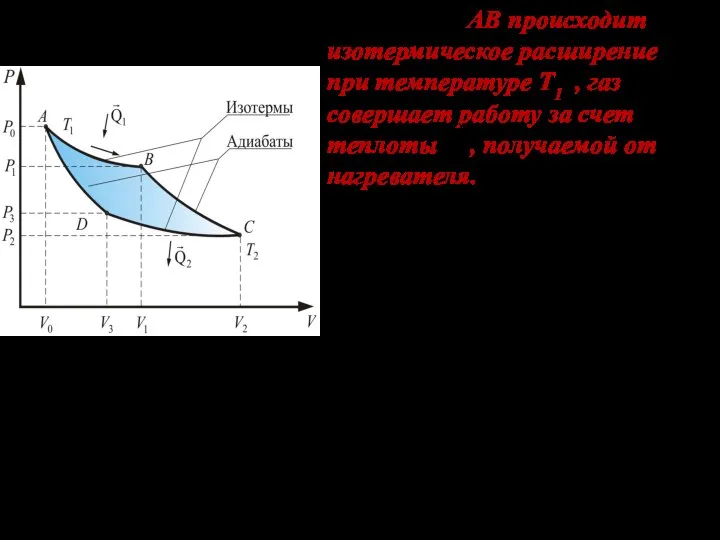
- 5. На участке АВ происходит изотермическое расширение при температуре Т1 , газ совершает работу за счет теплоты
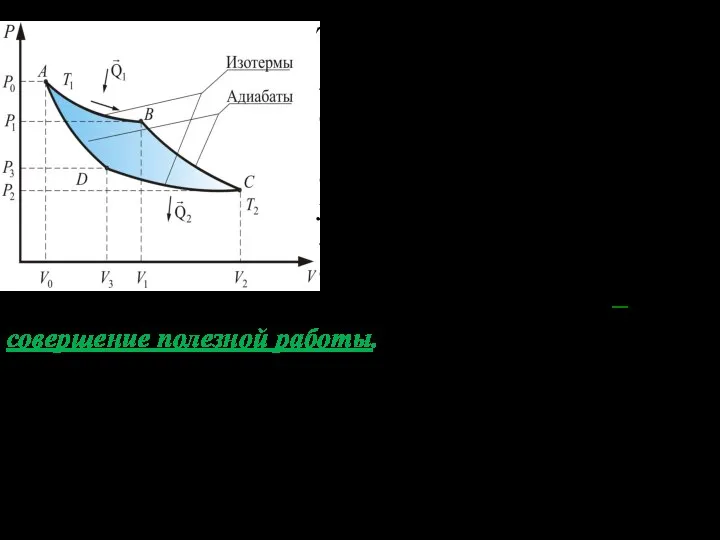
- 6. Для этого в точке В газ отклю- чают от контакта с нагрева- телем и совершают процесс
- 7. В точке D изотермическое сжатие заканчивается. Теперь нужно вернуть газ в исходное состояние (точку А). Для
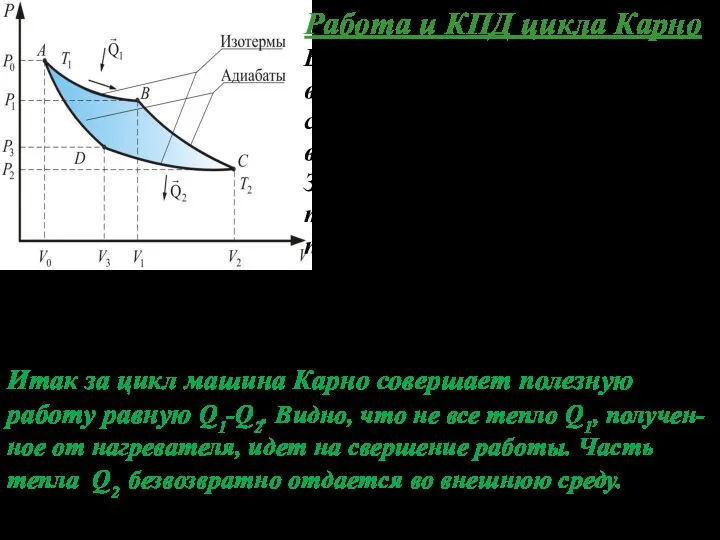
- 8. Работа и КПД цикла Карно В результате цикла газ возвращается в исходное состояние, т.е. изменения его
- 9. Исходя из этого за КПД машины Карно η примем отношение полезной работы А к теплоте Q1
- 10. Это сформулировано в 1-ой теореме Карно: Тепловая машина, работающая при данных значениях температур нагревателя и холодиль-
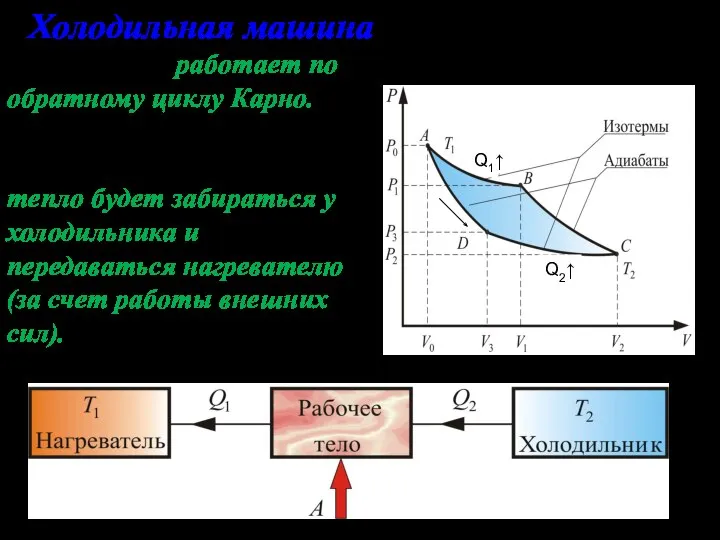
- 11. Холодильная машина Эта машина работает по обратному циклу Карно. Если проводить цикл в обратном направлении, тепло
- 12. Холодильная машина отбирает за цикл от холодного тела с температурой T2 количество теплоты Q2 и отдает
- 13. Второе начало термодинамики Идеальная машина Карно показала невозможность превращения всего тепла, полученного от нагревателя, в механическую
- 14. Появление второго начала термодинамики связано с необходимостью дать ответ на вопрос, какие процессы в природе возможны,
- 15. Формулировка У.Томсона: «Невозможны такие процессы, единственным результатом которых явилось бы отнятие от некоторого тела определенного количества
- 16. Клаузиус Рудольф Юлиус Эмануэль (1822 – 1888) – немецкий физик-теоретик, один из создателей термодинамики и кинетической
- 17. Для количественной характеристики степени хао- тичности т/д состояния вводят специальную функцию. Энтропия (греческая entropia – поворот,
- 18. Отношение теплоты Q к температуре, при которой происходила передача теплоты, называется приведенной теплотой. Для квазистатического процесса
- 19. Убедимся, к примеру, что это справедливо для обратимого цикла Карно. Напомним , что для цикла Карно
- 20. Можно показать, что и для любого другого обратимого кругового процесса Полученное выражение называется: равенство Клаузиуса
- 21. Напомним, если в круговом процессе интеграл от полного дифференциала какой-либо функции равен нулю, то эта функция
- 22. Для обратимых процессов изменение энтропии вычисляют интегрированием: За нулевое значение (S = 0) выбирается состояние с
- 23. Так как то После интегрирования
- 24. Каждый из изопроцессов идеального газа характери-зуется своим изменением энтропии, а именно: Изотермический ( ): Изобарический (
- 25. Изохорический ( ) Адиабатический ( ): Адиабатический процесс называют изоэнтропийным процессом.
- 26. Энтропия в изолированной системе при необратимых процессах. Из 1-ой теоремы Карно: для любой тепловой машины, использующей
- 27. Это означает, что для квазистатических процессов в цикле при наличии необратимых процессов: (Неравенство Клаузиуса) На примере
- 28. Распишем цикл поэтапно: Для обратимого процесса Тогда Если система изолирована: и следовательно Т. е. энтропия изолированной
- 29. Основные итоги рассмотренного. При любом необратимом процессе в изолированной системе энтропия возрастает (dS > 0). Энтропия
- 30. Первое и второе начала термодинамики в объединенной форме имеют вид: Здесь использовано
- 31. Третье начало термодинамики. Первое и второе начала термодинамики не указывают на поведение энтропии при абсолютном нуле
- 33. Скачать презентацию
























 Мбоу Полх-Майданская сош учитель физики и математики КозинаТ.И.
Мбоу Полх-Майданская сош учитель физики и математики КозинаТ.И. Необходимость разработки и строительства в Республике Беларусь исследовательского ядерного реактора
Необходимость разработки и строительства в Республике Беларусь исследовательского ядерного реактора Презентация по физике "Электроёмкость. Конденсаторы" - скачать
Презентация по физике "Электроёмкость. Конденсаторы" - скачать  Двигатель Стирлинга
Двигатель Стирлинга Индукция магнитного поля. Магнитный поток
Индукция магнитного поля. Магнитный поток Принцип действия и КПД тепловых двигателей
Принцип действия и КПД тепловых двигателей Сверхпроводники. Эффект Мейснера
Сверхпроводники. Эффект Мейснера Демонтаж систем охлаждения и смазки двигателей
Демонтаж систем охлаждения и смазки двигателей Основные определения метрологии. Меры и эталоны
Основные определения метрологии. Меры и эталоны Лауреаты Нобелевской премии
Лауреаты Нобелевской премии Усилители мощности звуковой частоты (УМЗЧ)
Усилители мощности звуковой частоты (УМЗЧ) Сложение скоростей в релятивистской механике
Сложение скоростей в релятивистской механике Электронные свойства низкоразмерных электронных систем. Принцип размерного квантования
Электронные свойства низкоразмерных электронных систем. Принцип размерного квантования Вклад Ломоносова в изучение физики и астрономии.
Вклад Ломоносова в изучение физики и астрономии. Радиоактивность. Открытие радиоактивности. Природа радиоактивных излучений. Радиоактивные превращения. Изотопы
Радиоактивность. Открытие радиоактивности. Природа радиоактивных излучений. Радиоактивные превращения. Изотопы «Своя Игра» на тему: «Давление»
«Своя Игра» на тему: «Давление» Количество теплоты. Единицы количества теплоты. Удельная теплоемкость
Количество теплоты. Единицы количества теплоты. Удельная теплоемкость Химическая эволюция и биогенез
Химическая эволюция и биогенез Электромагнитные излучения
Электромагнитные излучения Напряженность магнитного поля
Напряженность магнитного поля Закон Ома для участка цепи Цель урока: установить зависимость между силой тока, напряжением на участке цепи и сопротивлением это
Закон Ома для участка цепи Цель урока: установить зависимость между силой тока, напряжением на участке цепи и сопротивлением это Поляризация света
Поляризация света Нетрадиционные электростанции
Нетрадиционные электростанции Понятия релятивистской динамики - масса, импульс. Закон взаимодействия массы и энергии. Связь между импульсом и энергией тела
Понятия релятивистской динамики - масса, импульс. Закон взаимодействия массы и энергии. Связь между импульсом и энергией тела Подготовка к ЕГЭ по физике
Подготовка к ЕГЭ по физике Колебательное движение. Свободные колебания. Колебательные системы. Маятник
Колебательное движение. Свободные колебания. Колебательные системы. Маятник История отечественных космических ядерных установок
История отечественных космических ядерных установок Дія магнітного поля на провідник зі струмом. Сила ампера. ПІДГОТОВИЛА
Дія магнітного поля на провідник зі струмом. Сила ампера. ПІДГОТОВИЛА