Содержание
- 2. Работа в термодинамике. При расширении газа работа, производимая газом, положительна, т.к. сила давления направлена в сторону
- 3. Если газ расширяется при постоянном давлении р, то сила, действующая со стороны газа на поршень: F
- 4. При медленном сжимании газа работа, совершаемая внешними телами над газом, будет отличаться только знаком: Работа, совершаемая
- 5. Геометрическое истолкование работы. Работе A' газа для случая постоянного давления можно дать простое геометрическое истолкование. Построим
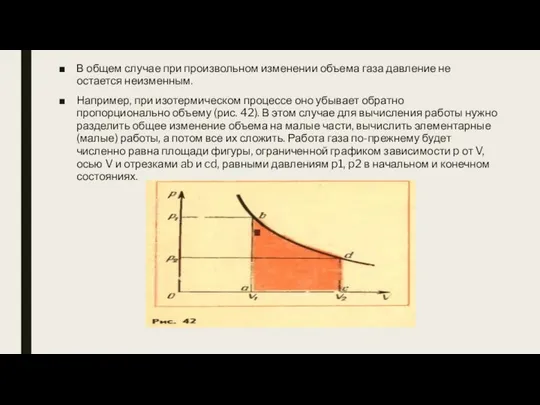
- 6. В общем случае при произвольном изменении объема газа давление не остается неизменным. Например, при изотермическом процессе
- 7. Закон сохранения энергии Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно,
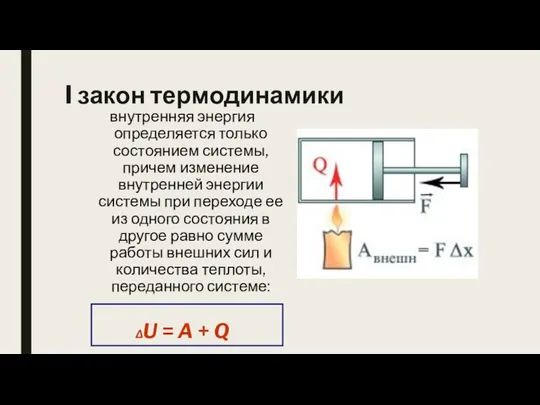
- 8. I закон термодинамики внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе
- 9. Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно
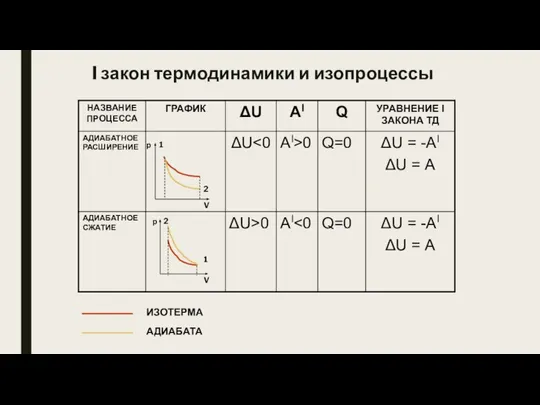
- 10. I закон термодинамики и изопроцессы
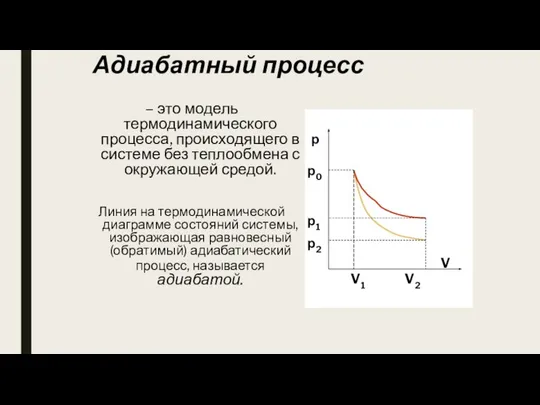
- 11. Адиабатный процесс – это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. Линия
- 12. I закон термодинамики и изопроцессы V р 1 2 ИЗОТЕРМА АДИАБАТА V р 2 1
- 13. источники http://www.physbook.ru/index.php/%D0%A2._%D0%90%D0%B4%D0%B8%D0%B0%D0%B1%D0%B0%D1%82%D0%BD%D1%8B%D0%B9_%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D1%81%D1%81 http://www.yaklass.ru/materiali?mode=lsntheme&themeid=128 http://www.eduspb.com/node/1746 http://www.eduspb.com/node/1744
- 15. Скачать презентацию








 Закон Ома для полной цепи. Законы Кирхгофа
Закон Ома для полной цепи. Законы Кирхгофа Тепломассообмен. Теплопроводность
Тепломассообмен. Теплопроводность Обеспечение стойкости ЭС к электромагнитным и ионизирующим излучениям
Обеспечение стойкости ЭС к электромагнитным и ионизирующим излучениям Проводники и электростатическое поле
Проводники и электростатическое поле Течение и свойства жидкости
Течение и свойства жидкости Плотность разных тел и их свойства
Плотность разных тел и их свойства 1. Электростатика
1. Электростатика Эволюция механики
Эволюция механики Магнитное поле. Постоянные магниты и магнитное поле тока. Индукция магнитного поля
Магнитное поле. Постоянные магниты и магнитное поле тока. Индукция магнитного поля Механическая работа 8 класс - Презентация по физике_
Механическая работа 8 класс - Презентация по физике_ Колебания и волны
Колебания и волны Свободное падение
Свободное падение Професія зварювальник
Професія зварювальник Некоторые вопросы физики магнитных явлений
Некоторые вопросы физики магнитных явлений Характеристики интерференции двух пересекающихся широкополосных диспергированных пучков
Характеристики интерференции двух пересекающихся широкополосных диспергированных пучков Энергия. Работа. Закон сохранения механической энергии
Энергия. Работа. Закон сохранения механической энергии Газовые законы
Газовые законы Физика в нашей жизни
Физика в нашей жизни Электропитание и электроснабжение нетяговых потребителей
Электропитание и электроснабжение нетяговых потребителей Работу выполнила: Макарова Екатерина, ученица 7 класса, ГОУ СОШ № 546 г.Москвы Руководитель: Казакова Ю.В., учитель физики
Работу выполнила: Макарова Екатерина, ученица 7 класса, ГОУ СОШ № 546 г.Москвы Руководитель: Казакова Ю.В., учитель физики Нанотехнологии и науки о материалах
Нанотехнологии и науки о материалах Движение тела по окружности с постоянной по модулю скоростью.
Движение тела по окружности с постоянной по модулю скоростью. Мир в магнитах. При поддержке туристической компании «Колесница»
Мир в магнитах. При поддержке туристической компании «Колесница» Лазерная указка: мифы и реальность
Лазерная указка: мифы и реальность Презентация по физике "Рудольф Дизель. Немецкий изобретатель" - скачать
Презентация по физике "Рудольф Дизель. Немецкий изобретатель" - скачать  Механика. Механическое движение. Урок 1 9 класс
Механика. Механическое движение. Урок 1 9 класс Взаимодействие магнитного поля и проводников с током
Взаимодействие магнитного поля и проводников с током Двигатели внутреннего сгорания. Эксплуатация и ремонт базовых машин бронетанковой техники
Двигатели внутреннего сгорания. Эксплуатация и ремонт базовых машин бронетанковой техники