Содержание
- 2. Зависимость давления идеального (достаточно разреженного) газа от температуры и концентрации его молекул имеет вид: p =
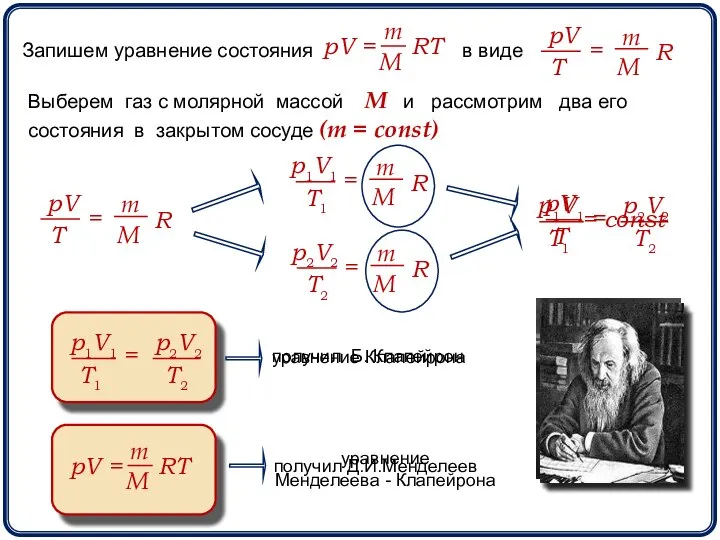
- 3. Запишем уравнение состояния в виде Выберем газ с молярной массой М и рассмотрим два его состояния
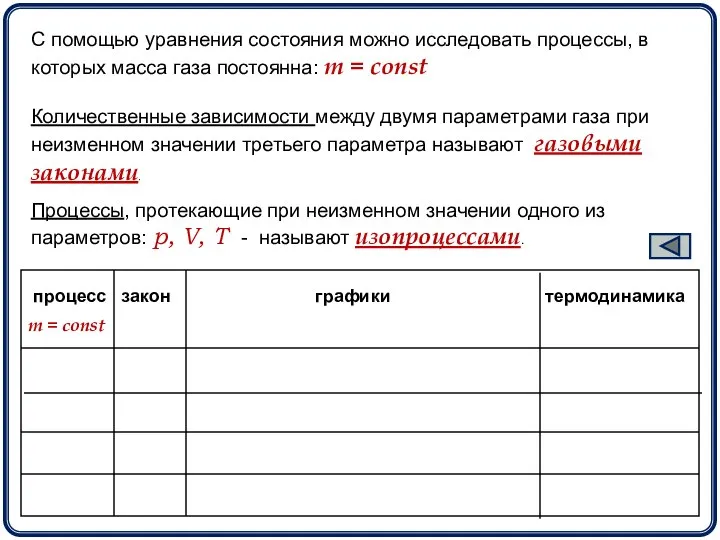
- 4. С помощью уравнения состояния можно исследовать процессы, в которых масса газа постоянна: m = const Количественные
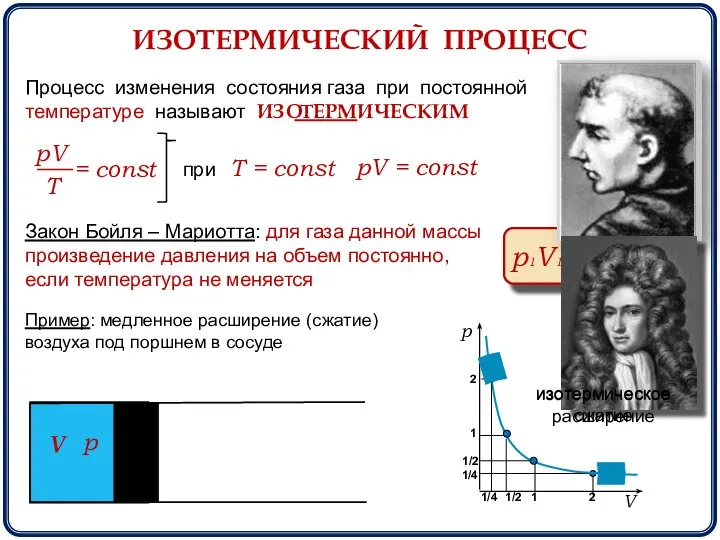
- 5. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс изменения состояния газа при постоянной температуре называют ИЗО ИЧЕСКИМ при Т = const
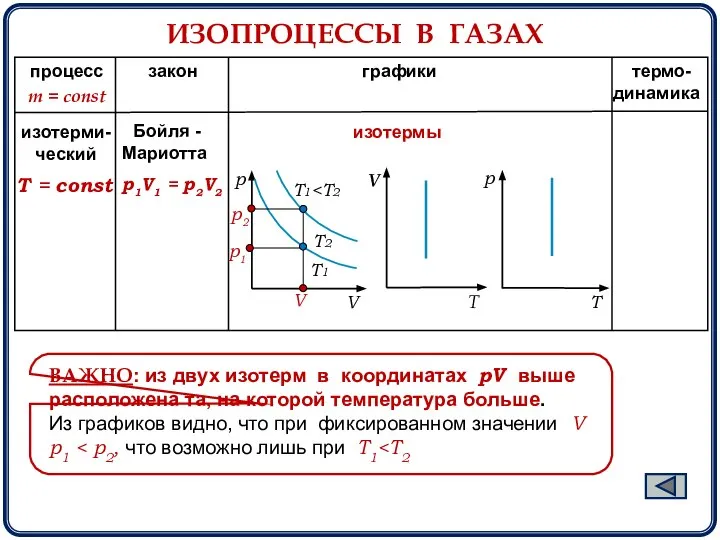
- 6. процесс закон графики термо- динамика Т = const m = const изотерми- ческий Бойля - Мариотта
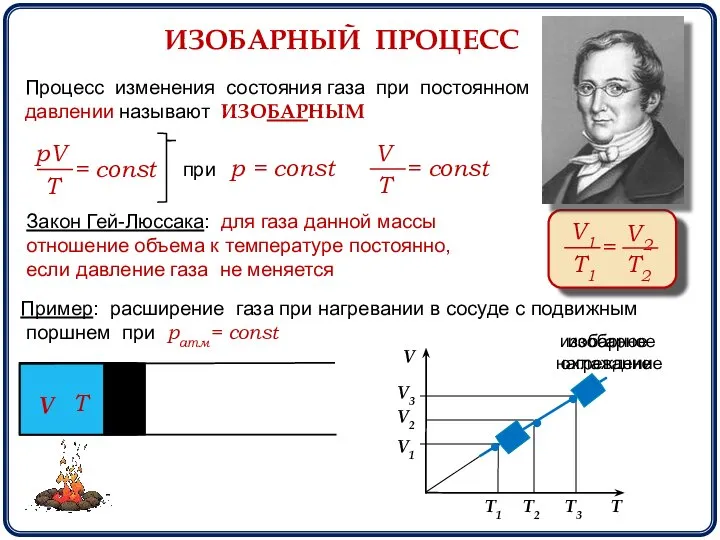
- 7. ИЗОБАРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном давлении называют ИЗОБАРНЫМ при р = const Закон
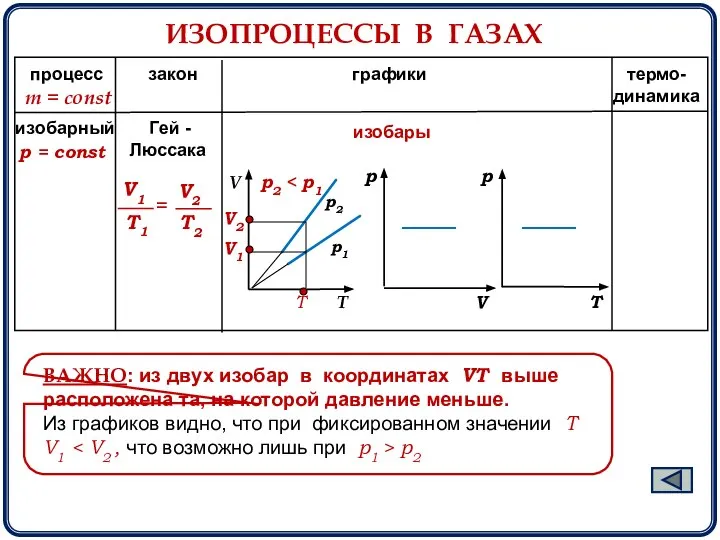
- 8. ИЗОПРОЦЕССЫ В ГАЗАХ процесс закон графики термо- динамика m = const р2 р1 изобары ВАЖНО: из
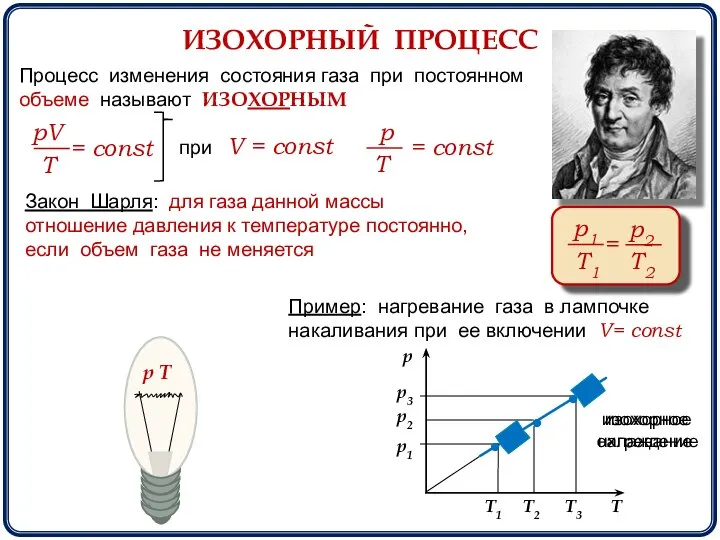
- 9. ИЗОХОРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном объеме называют ИЗОХОРНЫМ при V = const Закон
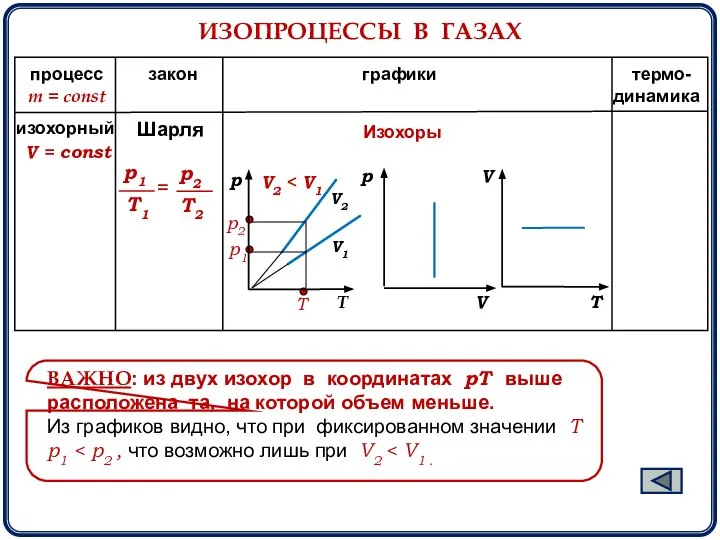
- 10. ИЗОПРОЦЕССЫ В ГАЗАХ m = const процесс закон графики термо- динамика V2 V1 Изохоры T V2
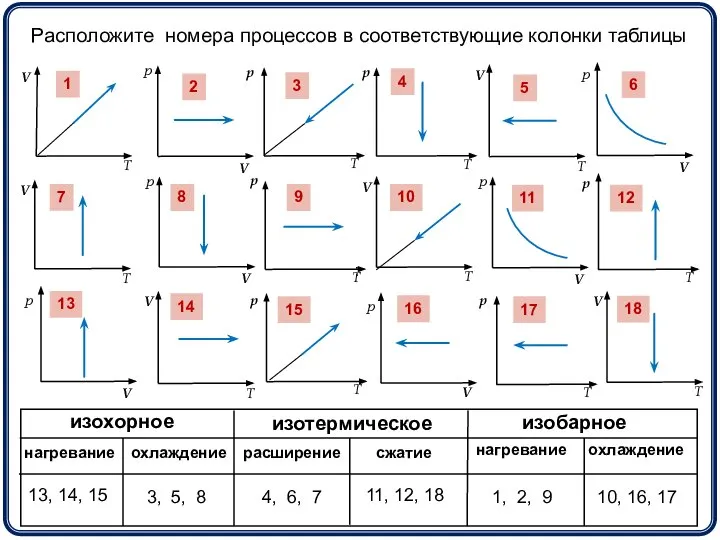
- 11. 1 3 2 4 5 6 7 8 9 10 11 12 13 14 15 16
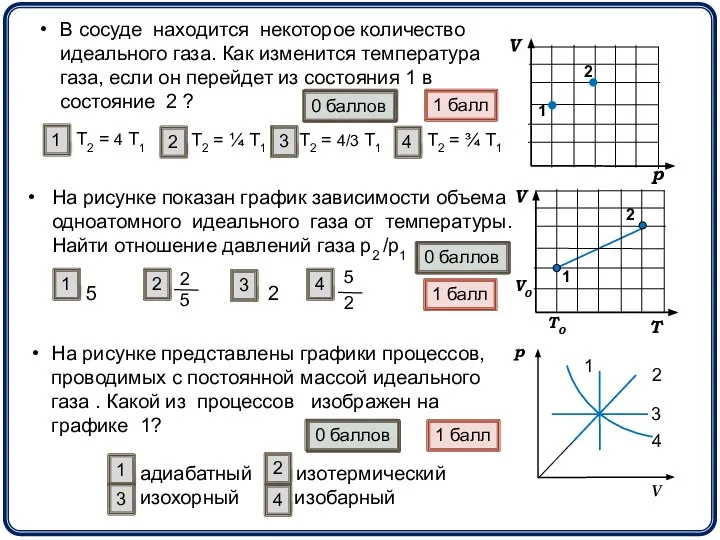
- 12. На рисунке показан график зависимости объема одноатомного идеального газа от температуры. Найти отношение давлений газа р2
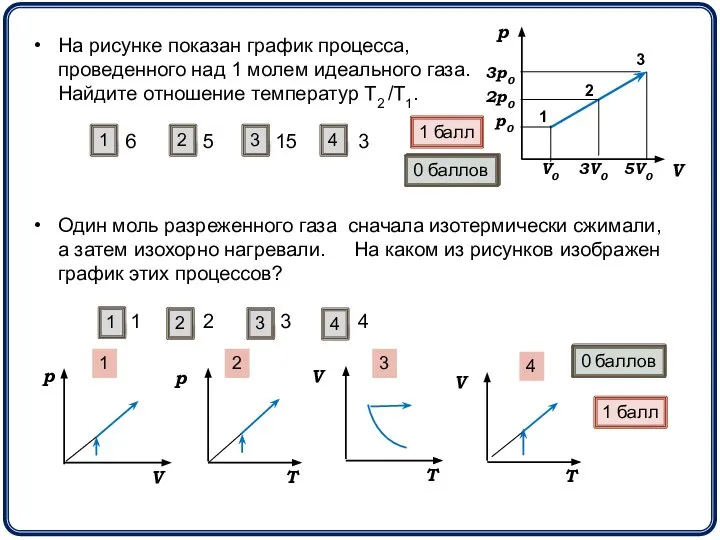
- 13. На рисунке показан график процесса, проведенного над 1 молем идеального газа. Найдите отношение температур Т2 /Т1.
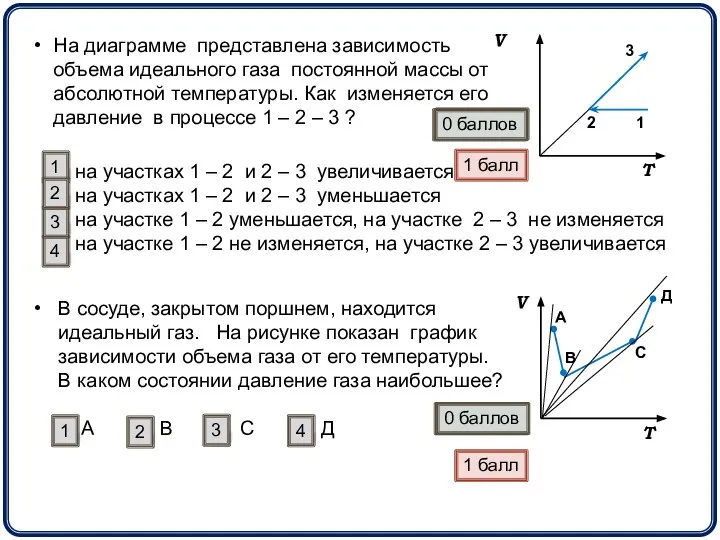
- 14. На диаграмме представлена зависимость объема идеального газа постоянной массы от абсолютной температуры. Как изменяется его давление
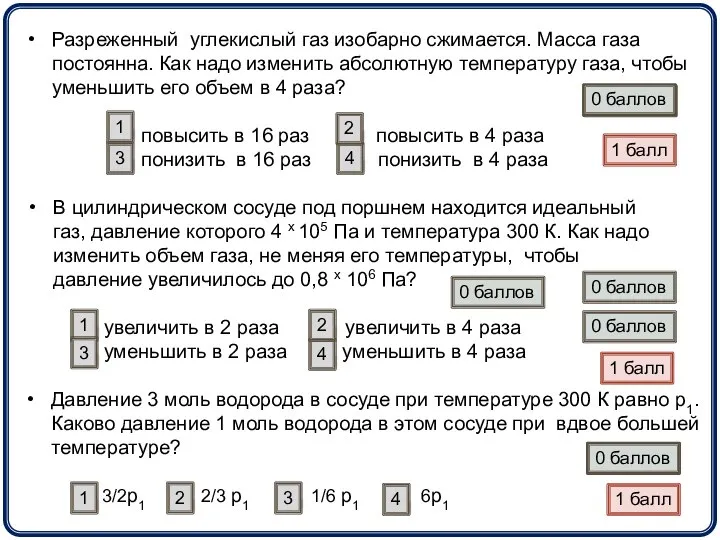
- 15. Разреженный углекислый газ изобарно сжимается. Масса газа постоянна. Как надо изменить абсолютную температуру газа, чтобы уменьшить
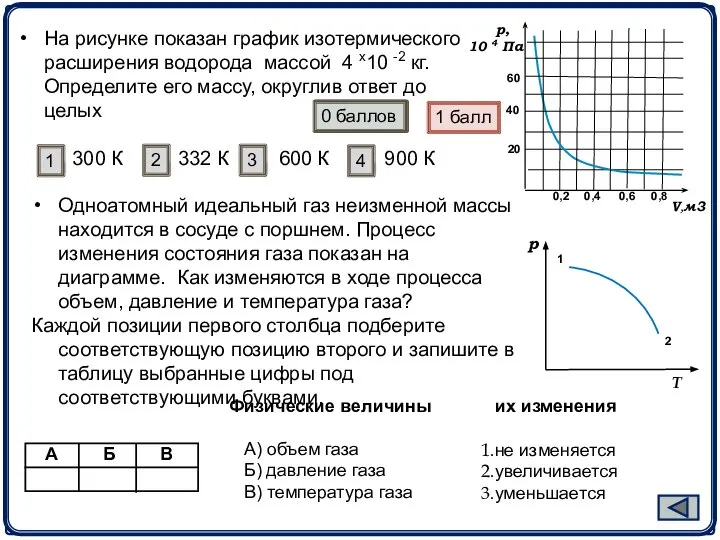
- 16. На рисунке показан график изотермического расширения водорода массой 4 х10 -2 кг. Определите его массу, округлив
- 18. Скачать презентацию

 Атмосферное оптическое явление - гало
Атмосферное оптическое явление - гало Тракторы МТЗ-82
Тракторы МТЗ-82 Проектирование ТРДДФ для многоцелевого истребителя с модификацией маслосистемы
Проектирование ТРДДФ для многоцелевого истребителя с модификацией маслосистемы Негативное воздействие электромагнитного излучения на организм человека
Негативное воздействие электромагнитного излучения на организм человека Устройство, техническое обслуживание и ремонт системы смазки грузового автомобиля КамАЗ 4310
Устройство, техническое обслуживание и ремонт системы смазки грузового автомобиля КамАЗ 4310 Машина переменного тока. Лекция 15
Машина переменного тока. Лекция 15 Диэлектриктердегі электр өрісі үшін
Диэлектриктердегі электр өрісі үшін Физические свойства воды в разных агрегатных состояниях
Физические свойства воды в разных агрегатных состояниях Опыт Э.Резерфорда по строению атома
Опыт Э.Резерфорда по строению атома Исследование зависимости силы тока в проводнике от напряжения на его концах. Лабораторная работа
Исследование зависимости силы тока в проводнике от напряжения на его концах. Лабораторная работа Термодинамикалық жүйе, процесс және тепе-теңдік
Термодинамикалық жүйе, процесс және тепе-теңдік Волновая оптика. Поляризация света. Тепловое излучение (Лекция 3)
Волновая оптика. Поляризация света. Тепловое излучение (Лекция 3) Создание источника электричества из овощей и фруктов
Создание источника электричества из овощей и фруктов Электропроводность полупроводников
Электропроводность полупроводников Физика 8 класс.
Физика 8 класс.  Самостоятельная работа 66 урок
Самостоятельная работа 66 урок Механика. Глава 3. Работа и энергия
Механика. Глава 3. Работа и энергия Монохроматоры. Аппаратура в спектрофотометрических методах анализа
Монохроматоры. Аппаратура в спектрофотометрических методах анализа Виштовхувальна сила. Закон Архімеда
Виштовхувальна сила. Закон Архімеда Физические свойства строительных материалов
Физические свойства строительных материалов Магнитное поле Земли
Магнитное поле Земли  Презентация по физике "Условие равновесия рычага. Правило моментов" - скачать
Презентация по физике "Условие равновесия рычага. Правило моментов" - скачать  Презентация по физике Как все двигается с точки зрения физики
Презентация по физике Как все двигается с точки зрения физики  Визначення опору навантаження лінії передачі методом еквівалентного перетину. (Лекция 15)
Визначення опору навантаження лінії передачі методом еквівалентного перетину. (Лекция 15) Технология компрессии изображений «Smart Compression of Images»
Технология компрессии изображений «Smart Compression of Images» Галогенная лампа
Галогенная лампа Виды спектров. Спектральный анализ.
Виды спектров. Спектральный анализ. Энергия. Кинетическая энергия
Энергия. Кинетическая энергия