Содержание
- 2. Лекция 4 Закон Кирхгоффа. Использование теплоемкостей для расчетов изменения энергии и энтальпии реакций. Возможности расчёта энтальпий
- 3. Ответ в чате должен содержать НОМЕР группы! Должен выглядеть так: «Фамилия» (пробел) Номер группы (пробел) Цифра
- 4. 1 балл
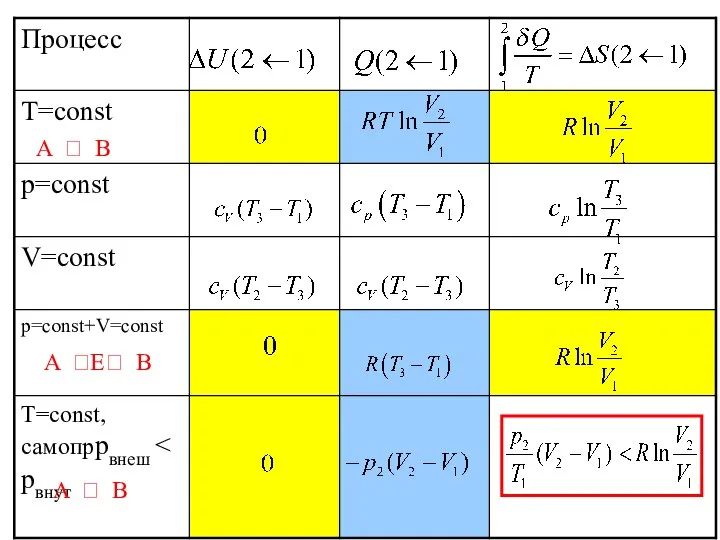
- 6. 1) Соответствует реакции, протекающей при постоянной температуре T; 2) Растет с увеличением температуры Т; 3) Если
- 7. Связь ∆Н и ∆U химической реакции. Для идеальных газов: pV = nRT Для твердых и жидких:
- 8. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ С60
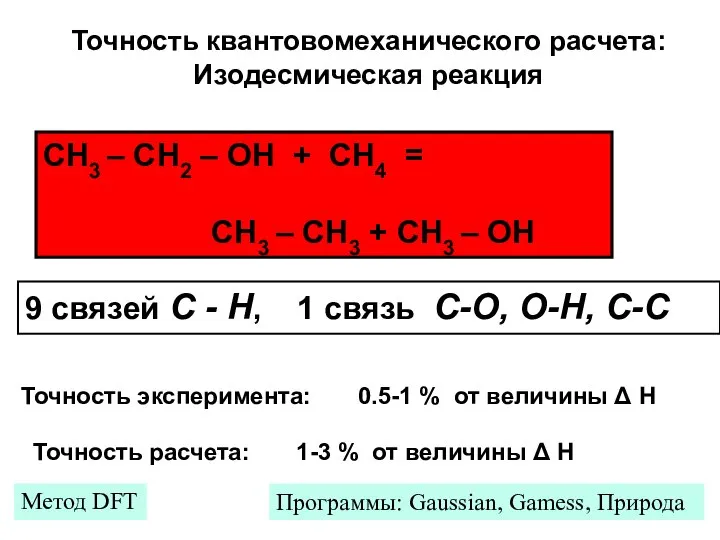
- 9. Точность квантовомеханического расчета: Изодесмическая реакция СН3 – СН2 – ОН + СН4 = СН3 – СН3
- 10. Для реакции 3KF(тв.) +AlF3(тв) = K3AlF6(тв) измерили тепловой эффект QV при температуре T. Нужно посчитать энтальпию
- 11. Простым веществом для элемента Pt служит Pt(тв). Какое из следующих утверждений верно? 1 балл
- 12. Мы знаем, что для реакции 3K(тв.) +Al (тв.) + 3F2(газ) = K3AlF6(тв) величина ∆ср положительна. Как
- 13. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
- 14. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ «Состояние 1» «Состояние 2» Q1 Q2
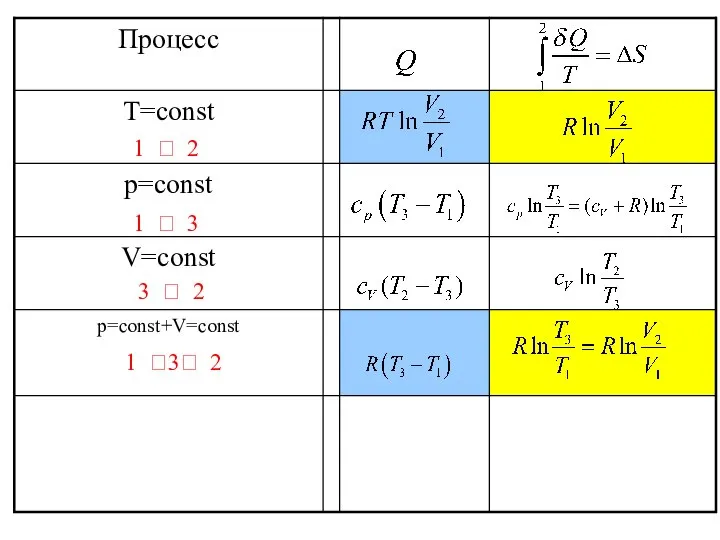
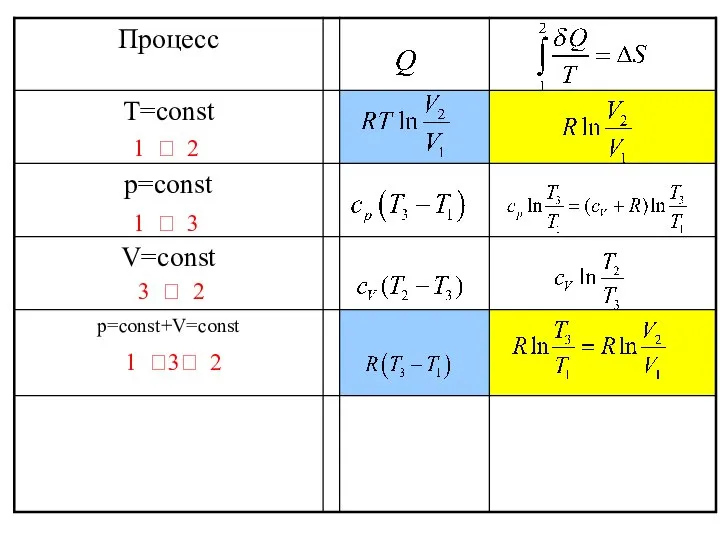
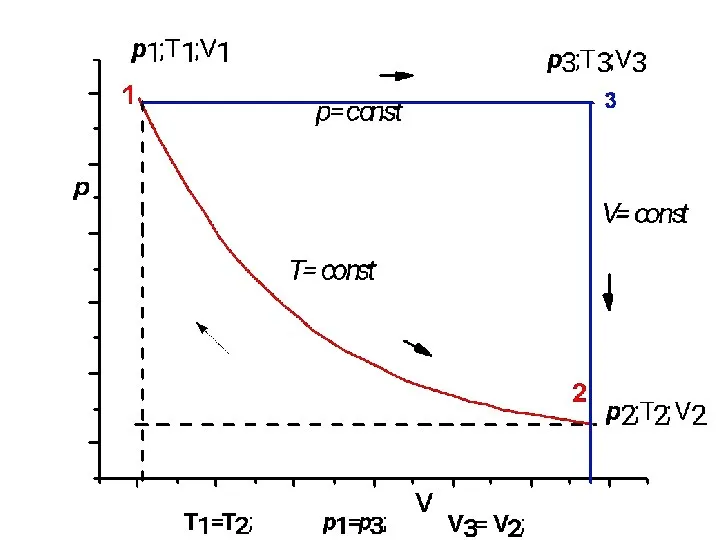
- 15. 1 ? 2 1 ?3? 2 3 ? 2 1 ? 3
- 17. 1 ? 2 1 ?3? 2 3 ? 2 1 ? 3
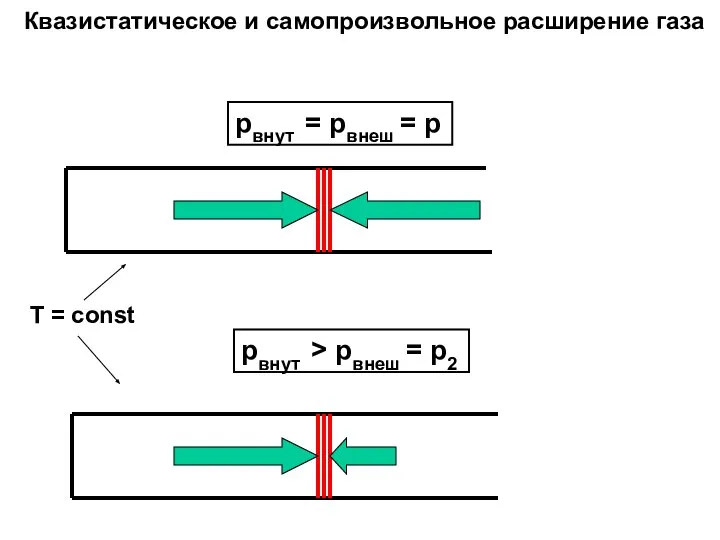
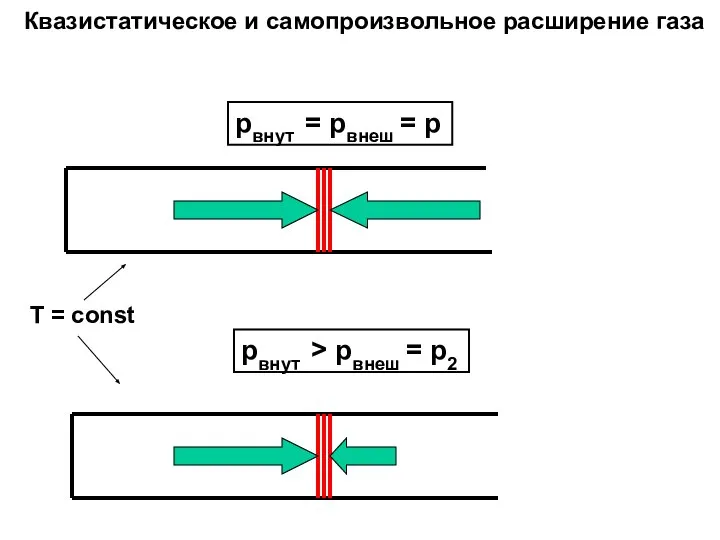
- 20. pвнут = pвнеш = p pвнут > pвнеш = p2 Квазистатическое и самопроизвольное расширение газа T
- 21. НЕКВАЗИСТАТИЧЕСКИЙ, ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС. ИДЕАЛЬНЫЙ ГАЗ ∆U = 0 ; dU = δQ + δW ; δW
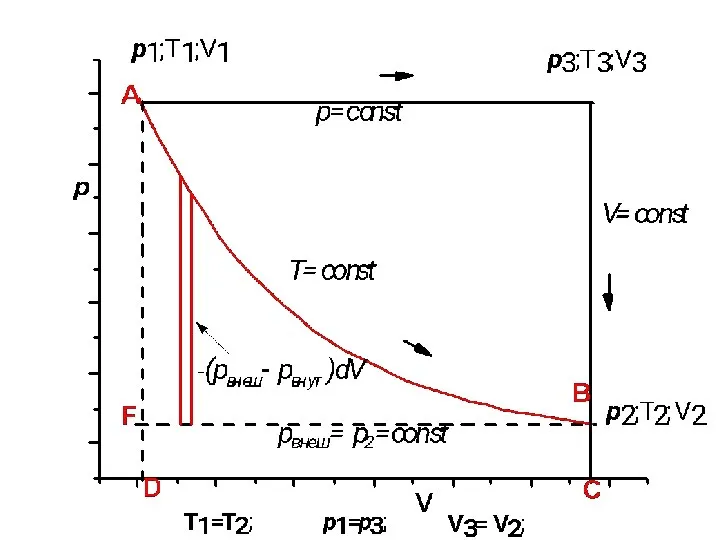
- 22. A ? B A ?E? B A ? B
- 24. pвнут = pвнеш = p pвнут > pвнеш = p2 Квазистатическое и самопроизвольное расширение газа T
- 25. Квазистатический и самопроизвольный процесс
- 26. Первый закон термодинамики. У любой системы существует функция состояния, называемая внутренней энергией, U. Второй закон термодинамики.
- 27. Полный дифференциал внутренней энергии, dU, равен: Закрытая система Система переходит из состояния 1 в состояние 2:
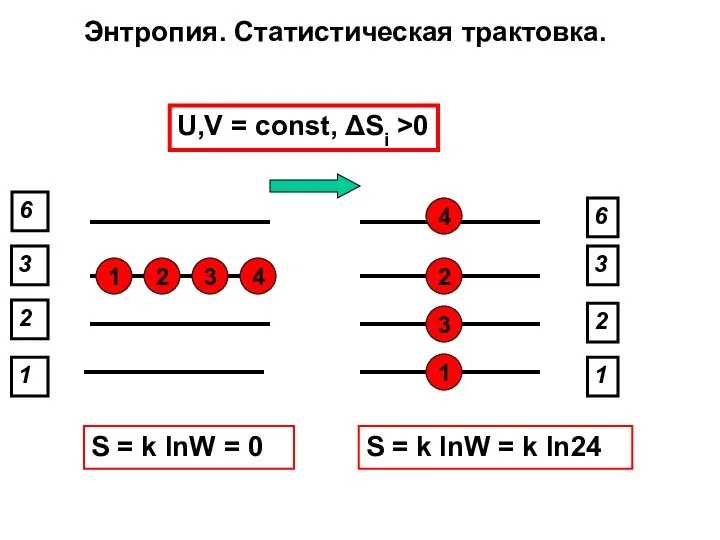
- 28. Изолированная система: Первый закон: Внутренняя энергия U изолированной системы постоянна. Второй закон: Энтропия S изолированной системы
- 29. КВАЗИСТАТИЧЕСКИЙ 1 моль Fe нагрели от 300 до 400 К при атмосферном давлении. Как изменилась энтропия
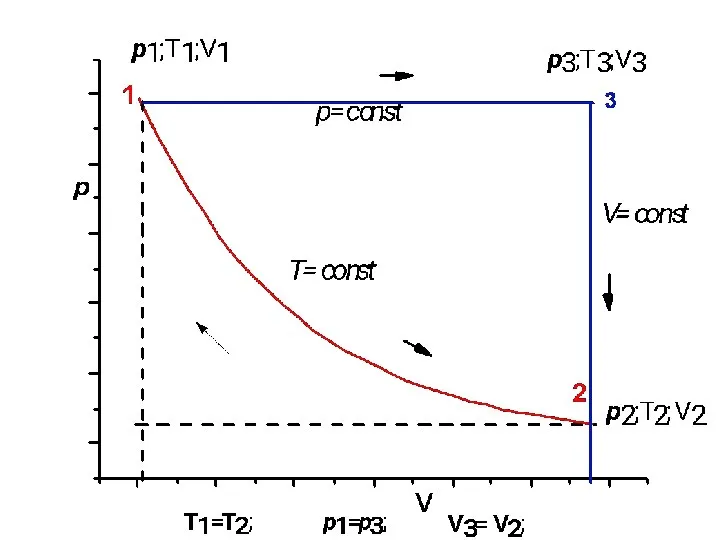
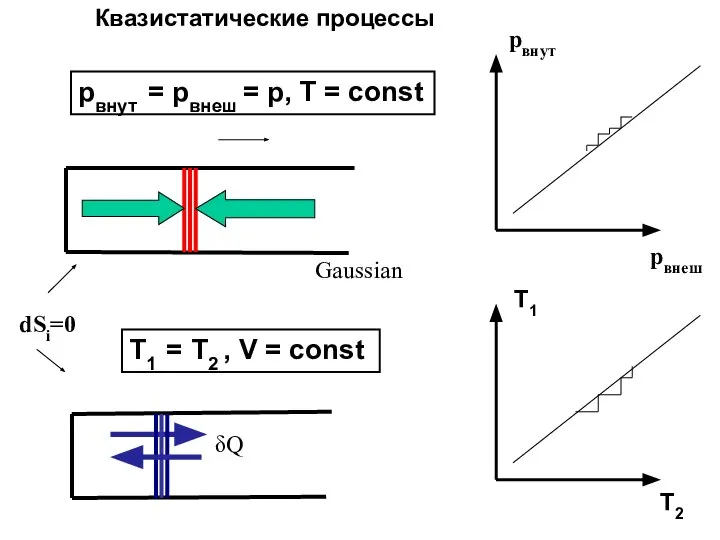
- 30. pвнут = pвнеш = p, T = const Т1 = Т2 , V = const Квазистатические
- 31. 1 2 3 4 1 2 4 3 1 6 3 2 1 2 6 3
- 32. Самопроизвольный процесс. Движение к равновесию.
- 33. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ. Самопроизвольное движение к равновесию. Производство энтропии больше нуля.
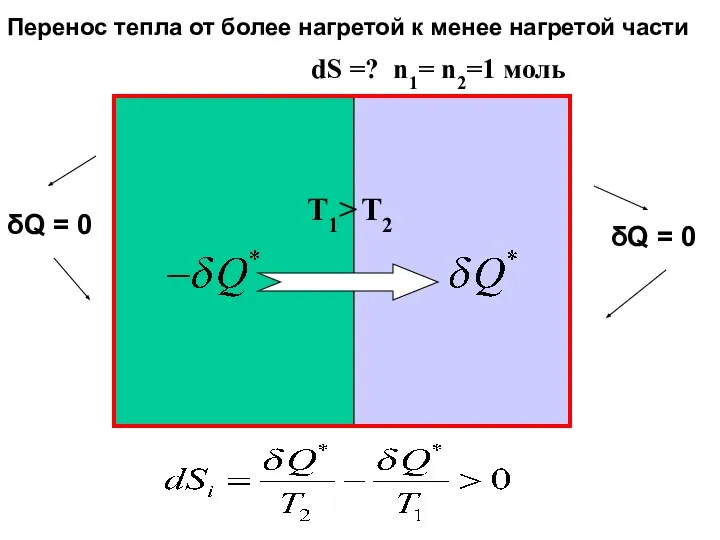
- 34. T1> T2 Перенос тепла от более нагретой к менее нагретой части δQ = 0 δQ =
- 35. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ. Самопроизвольное движение к равновесию. Производство энтропии больше нуля. Энтропия изолированной системы возрастает
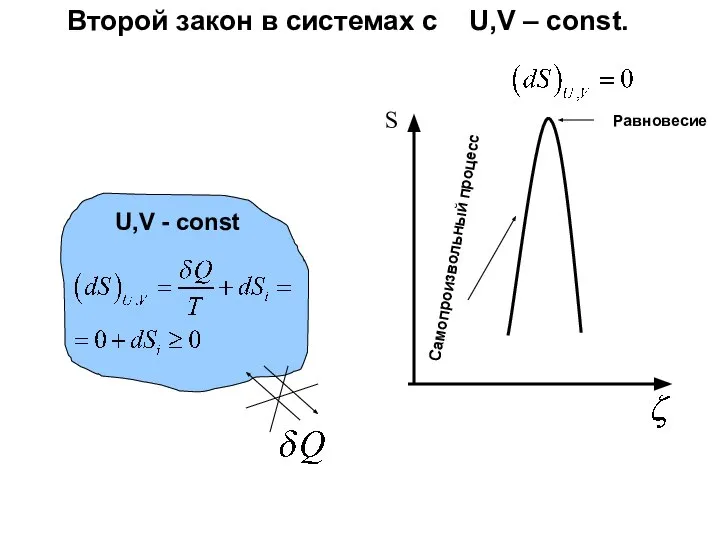
- 36. U,V - const S Самопроизвольный процесс Равновесие Второй закон в системах с U,V – const.
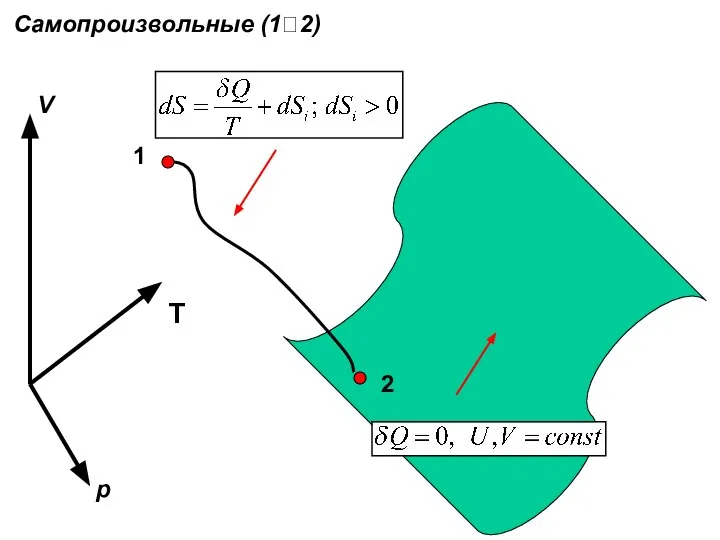
- 37. Самопроизвольные (1?2) 1 2 V p T
- 38. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ. Самопроизвольное движение к равновесию. Производство энтропии больше нуля. Внутренняя энергия закрытой системы при
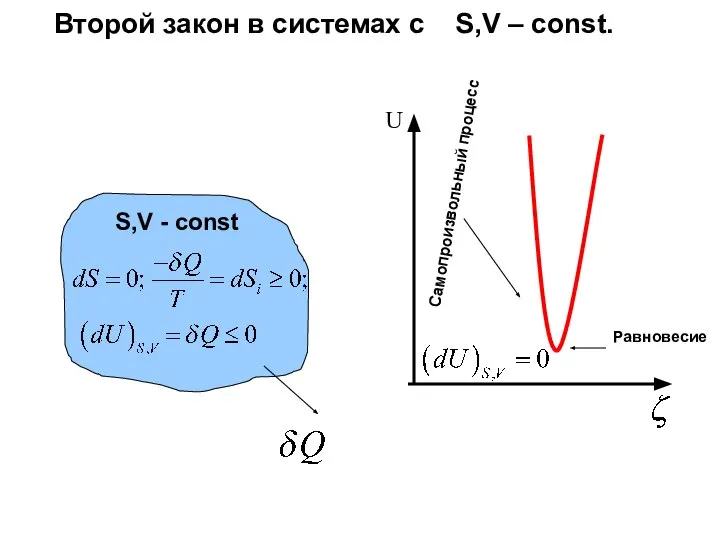
- 39. S,V - const U Самопроизвольный процесс Равновесие Второй закон в системах с S,V – const.
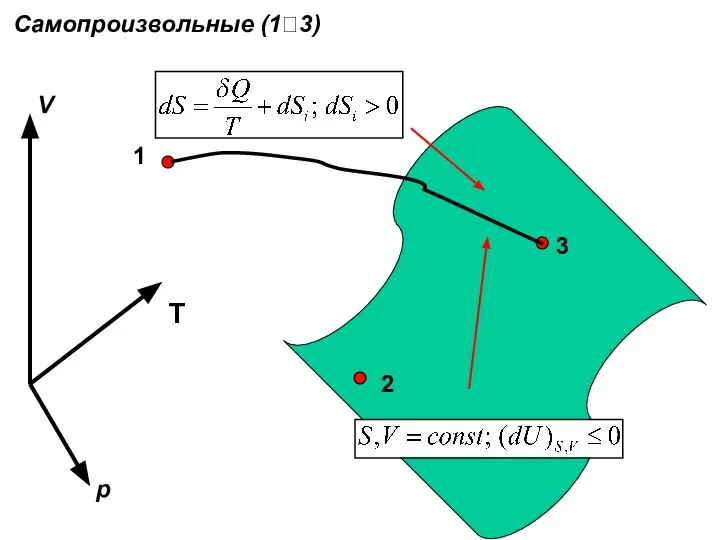
- 40. Самопроизвольные (1?3) 1 2 3 V p T
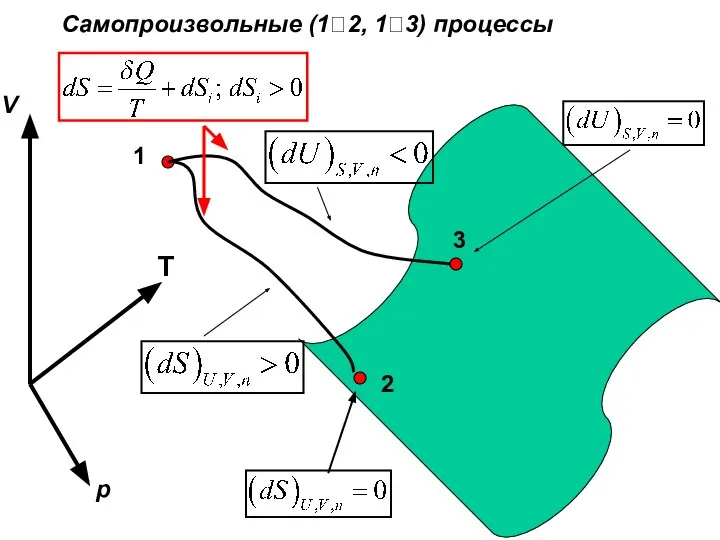
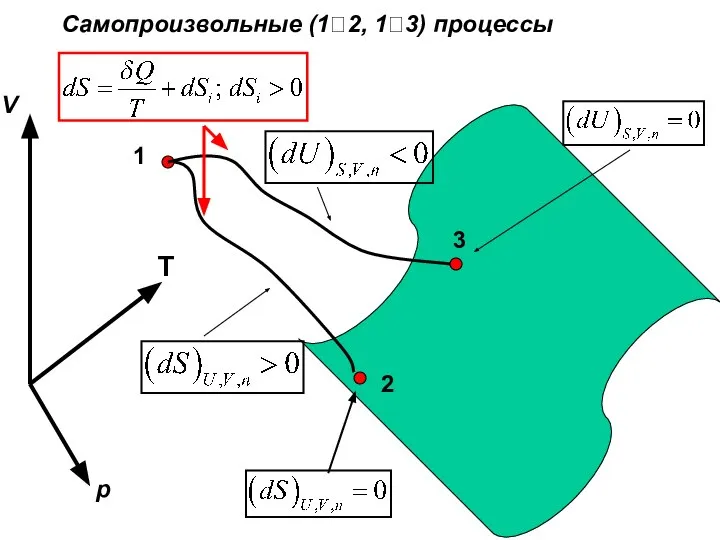
- 41. Самопроизвольные (1?2, 1?3) процессы 1 2 3 V p T
- 42. T1> T2 Перенос тепла от более нагретого к менее нагретому телу δQ = 0 δQ =
- 43. T1> T2 Перенос тепла от более нагретого к менее нагретому телу δQ1 δQ2 n1= n2=1 моль
- 44. Самопроизвольные (1?2, 1?3) процессы 1 2 3 V p T
- 46. Скачать презентацию

























 Объемные ионизационные эффекты в ПП и ИС (ИЭТ) при воздействии импульсного ИИ
Объемные ионизационные эффекты в ПП и ИС (ИЭТ) при воздействии импульсного ИИ Ультрафиолетовое излучение
Ультрафиолетовое излучение Школьное учебно-методическое объединение учителей физики
Школьное учебно-методическое объединение учителей физики Физико-математические основы РКТ
Физико-математические основы РКТ Физика твёрдого тела. Кристаллические и аморфные твёрдые тела
Физика твёрдого тела. Кристаллические и аморфные твёрдые тела Аттестационная работа. Проектно-исследовательская деятельность в рамках науки Физика. (7 класс)
Аттестационная работа. Проектно-исследовательская деятельность в рамках науки Физика. (7 класс) Электрический ток и его использование (8 класс)
Электрический ток и его использование (8 класс) Элементы специальной теории относительности
Элементы специальной теории относительности Лабораторные работы по физике 8 класс Учитель сош№53 г.Краснодар Меденюк О.В. 2010г г.Краснодар
Лабораторные работы по физике 8 класс Учитель сош№53 г.Краснодар Меденюк О.В. 2010г г.Краснодар Обертальний рух тіла. Період та частота обертання
Обертальний рух тіла. Період та частота обертання Стульчик для огорода
Стульчик для огорода Физические повреждающие факторы внешней среды
Физические повреждающие факторы внешней среды Мощные силовые выпрямительные диоды
Мощные силовые выпрямительные диоды Эмпирические и теоретические зависимости в практике статического зондирования
Эмпирические и теоретические зависимости в практике статического зондирования Униполярный генератор Фарадея Выполнил Агафонов Илья Ученик 11 класса ФМЛ г. Глазова
Униполярный генератор Фарадея Выполнил Агафонов Илья Ученик 11 класса ФМЛ г. Глазова Простейшие движения твердого тела
Простейшие движения твердого тела Автор презентации – учитель МКОУ СОШ №11 г. Палласовки Волгоградской области Букешева Гулзара Нурболатовна
Автор презентации – учитель МКОУ СОШ №11 г. Палласовки Волгоградской области Букешева Гулзара Нурболатовна  Понятие о машине и механизме (6 класс)
Понятие о машине и механизме (6 класс) Общие указания к построению эпюр поперечных сил и изгибающих моментов
Общие указания к построению эпюр поперечных сил и изгибающих моментов Уравнение состояния идеального газа
Уравнение состояния идеального газа Тұрғын үй мен қоғамдық ғимараттарда пайдаланылатын жасанды жарықтандырудың заманауи
Тұрғын үй мен қоғамдық ғимараттарда пайдаланылатын жасанды жарықтандырудың заманауи Свойства и строение жидкости
Свойства и строение жидкости Электричество. Решение изобретательских задач
Электричество. Решение изобретательских задач Строительная механика. Часть 2. Понятие о нелинейно деформируемых системах и методах их расчёта
Строительная механика. Часть 2. Понятие о нелинейно деформируемых системах и методах их расчёта Electro-mechanical Steering System
Electro-mechanical Steering System Кинематика. Основные кинематические характеристики прямолинейного и криволинейного движения
Кинематика. Основные кинематические характеристики прямолинейного и криволинейного движения Качение бревна сосновых пород по наклонной плоскости с учетом сучковатости
Качение бревна сосновых пород по наклонной плоскости с учетом сучковатости Эпиграф: Владея опытом естественных наук, Изучим все, что есть в подлунном мире. Тогда лишь станет ясным все вокруг. И пониманье
Эпиграф: Владея опытом естественных наук, Изучим все, что есть в подлунном мире. Тогда лишь станет ясным все вокруг. И пониманье