Содержание
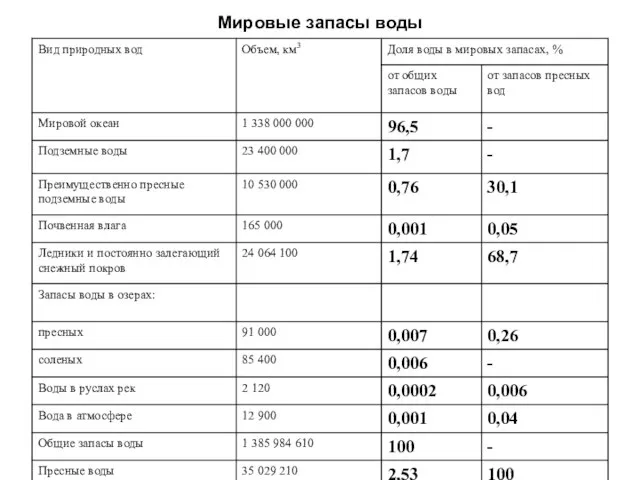
- 2. Мировые запасы воды
- 3. Глобальный кругооборот воды в природе Qиспарения = Qосадки Qиспарения = Qиспарения океан + Qиспарения суша 520
- 4. Примерный расход воды в мире (тыс. км3) Сельское хозяйство 7 Промышленность 1,7 Разбавление сточных вод 9
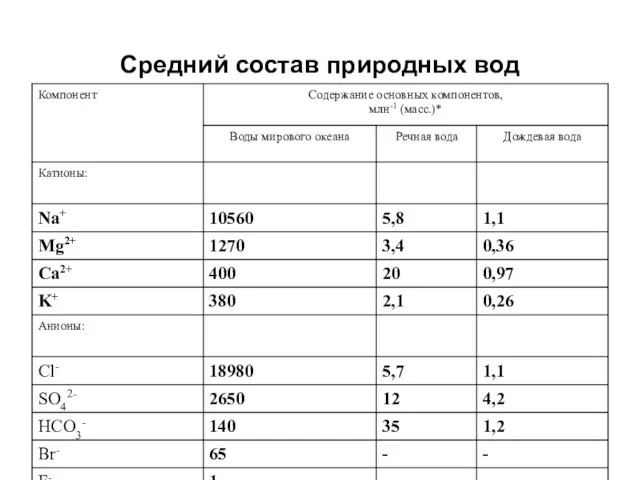
- 5. Средний состав природных вод
- 6. Жесткость природных вод Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния.
- 7. По величине общей жесткости природные воды принято делить на ряд групп: вода очень мягкая - Ж
- 8. Немецкий градус жесткости соответствует содержанию в воде 10, 0 мг/л СаО. Один Французкий градус жесткости соответствует
- 9. Растворимость карбонатов и рН подземных и поверхностных природных вод Процесс непосредственного растворения карбоната кальция по уравнению:
- 10. Щелочность природных вод Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта
- 11. Процессы закисления поверхностных водоемов В нормальном водоеме, Щ =1 ммоль/л рН = 8,3 Несмотря на поступление
- 12. Процессы закисления поверхностных водоемов Первый этап. Щ=0,1 ммоль/л Обычно рН =7-8. В период интесивного поступления кислых
- 14. Скачать презентацию









 Материк Евразия
Материк Евразия Смена времён года
Смена времён года Гидросфера. Подземные воды
Гидросфера. Подземные воды Великие географические открытия
Великие географические открытия Территориальные факторы и особенности расселения населения
Территориальные факторы и особенности расселения населения Социалистическая Республика Вьетнам
Социалистическая Республика Вьетнам Поволжский экономический район
Поволжский экономический район the United Arab Emirates
the United Arab Emirates Вода на Земле
Вода на Земле Экономический кризис? Москва- Муром, февраль 2009 года
Экономический кризис? Москва- Муром, февраль 2009 года 20150123_avstraliya
20150123_avstraliya Заповедными тропинками. Путешествие по Тебердинскому заповеднику
Заповедными тропинками. Путешествие по Тебердинскому заповеднику Миграционные процессы
Миграционные процессы Горные породы
Горные породы The United Kingdom of Great Britain and Northern Ireland
The United Kingdom of Great Britain and Northern Ireland Реки и озёра Южной Америки
Реки и озёра Южной Америки Народы Российской Федерации - презентация к уроку Географии_
Народы Российской Федерации - презентация к уроку Географии_ Все приезжающие в Петербург беспрестанно повторяют слово «фантастика». ©
Все приезжающие в Петербург беспрестанно повторяют слово «фантастика». © Открытие Австралии и островов Тихого океана
Открытие Австралии и островов Тихого океана Внутренние воды Северной Америки - презентация к уроку Географии
Внутренние воды Северной Америки - презентация к уроку Географии Смоленская область РФ
Смоленская область РФ The Three Kings Monument
The Three Kings Monument Дивногорье
Дивногорье Киселевск – мой город Автор : Ширинская Любовь Анатольевна, учитель географии город Киселевск Кемеровская область
Киселевск – мой город Автор : Ширинская Любовь Анатольевна, учитель географии город Киселевск Кемеровская область  Япония – страна восходящего солнца
Япония – страна восходящего солнца Климат
Климат Можайск- межа, могу, можай?
Можайск- межа, могу, можай? Глобус и карта
Глобус и карта