Содержание
- 2. ЖИДКИЕ СМЕСИ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ Смеси, отклоняющиеся от закона Рауля Для идеальной смеси двух жидкостей
- 3. Смеси, отклоняющиеся от закона Рауля Табл. 1 Отклонения от закона Рауля
- 4. Смеси с положительным отклонением от закона Рауля а) В этих смесях энергия взаимодействия между молекулами разных
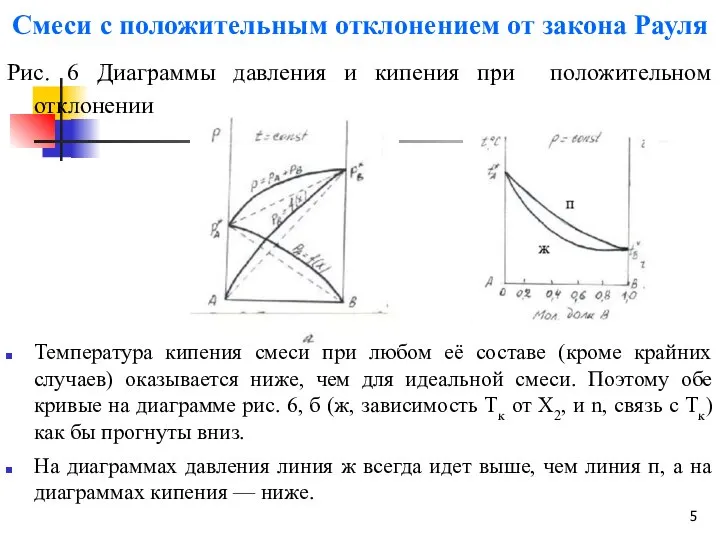
- 5. Смеси с положительным отклонением от закона Рауля Рис. 6 Диаграммы давления и кипения при положительном отклонении
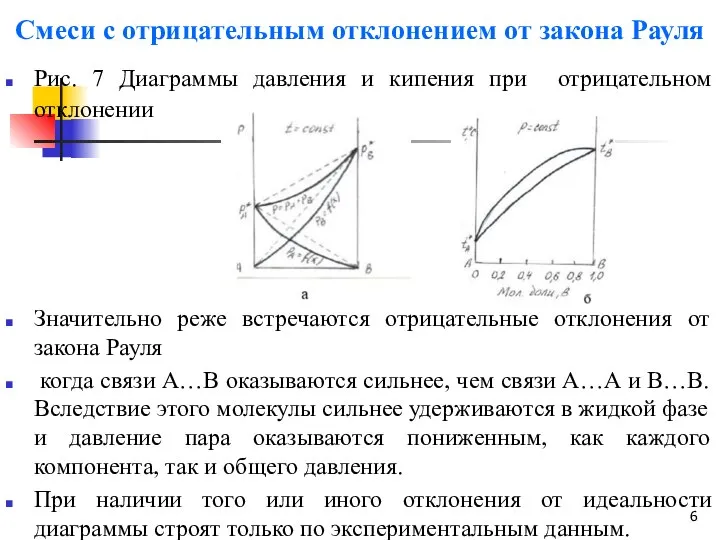
- 6. Смеси с отрицательным отклонением от закона Рауля Рис. 7 Диаграммы давления и кипения при отрицательном отклонении
- 7. Неограниченно растворимые жидкости, не подчиняющиеся закону Рауля, с положительными или отрицательными отклонениями и с максимумом или
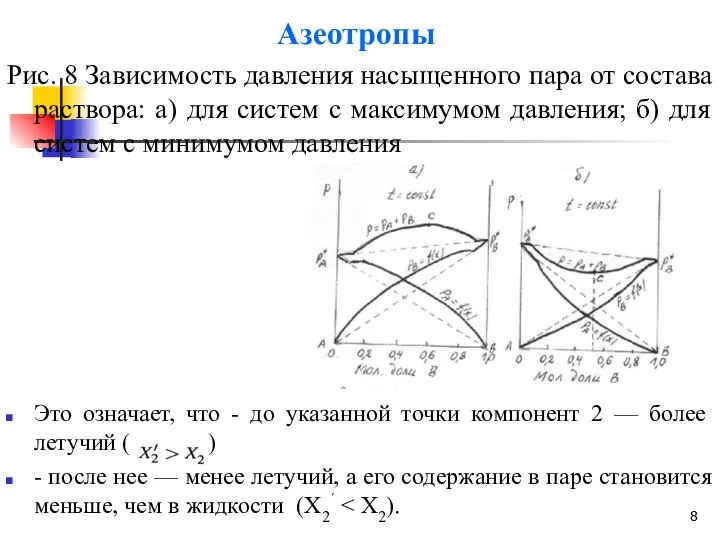
- 8. Азеотропы Рис. 8 Зависимость давления насыщенного пара от состава раствора: а) для систем с максимумом давления;
- 9. Азеотропы Рис. 9. Зависимость температуры кипения от состава раствора: а) для систем с максимумом на кривой
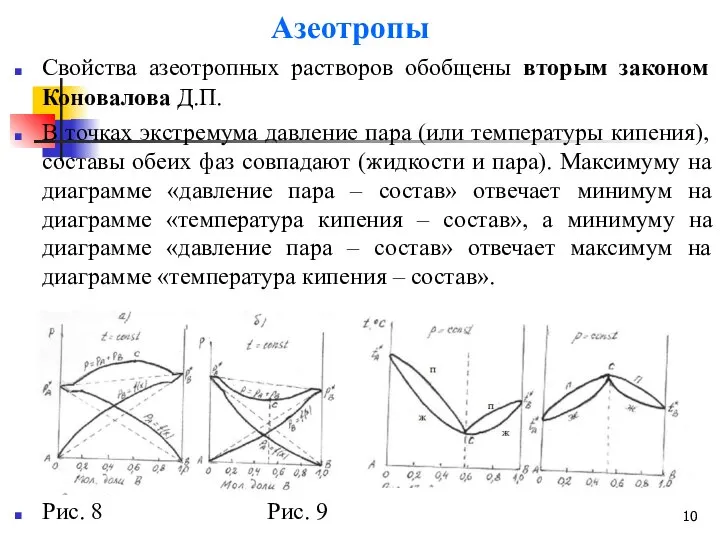
- 10. Азеотропы Свойства азеотропных растворов обобщены вторым законом Коновалова Д.П. В точках экстремума давление пара (или температуры
- 11. Азеотропы Азеотропный раствор кипит при постоянной температуре (при условии постоянства внешнего давления) без изменения своего состава.
- 12. Разделение жидкостей — перегонка и ректификация Метод разделения хорошо растворимых друг в друге жидкостей на отдельные
- 13. Простая перегонка Известны три модификации данного метода — простая перегонка, фракционная перегонка и ректификация. Простая перегонка.
- 14. Простая перегонка Это приводит к изменению состава жидкости до Y2 и повышению температуры кипения до Т2.
- 15. Простая перегонка Рис. 11 Перегонка в лабораторных условиях
- 16. Фракционная перегонка Но основная масса компонентов все же остается в жидкой смеси, образующейся при конденсации. Для
- 17. Ректификация Рис. 13 Ректификационная колонна (схема) Колонка содержит систему «тарелок»; внизу находится нагреватель. Поступающая в колонку
- 18. Разделение азеотропных смесей а) Если смесь — азеотропная, то методом перегонки можно получить в чистом виде
- 19. Разделение азеотропных смесей Дальнейшая очистка азеотропной смеси возможна 3 методами: Химическое связывание одного из компонентов. Например,
- 20. Законы Вревского Первый закон. При данном составе жидкой фазы равновесная с ней газовая фаза с увеличением
- 21. Список литературы Физическая химия: учебник / Ю.Я. Харитонов. – М.: ГЭОТАР - Медиа, 2013. – 608
- 23. Скачать презентацию
















 Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Кислоты. Классификация кислот
Кислоты. Классификация кислот ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Методы защиты растений от вредителей
Методы защиты растений от вредителей Твердость минералов и их применение
Твердость минералов и их применение Современные представления о происхождении нефти и газа
Современные представления о происхождении нефти и газа Органические вещества 9 класс
Органические вещества 9 класс Элементы IV группы, побочной подгруппы периодической системы Менделеева
Элементы IV группы, побочной подгруппы периодической системы Менделеева Органические вещества
Органические вещества Молекулы. Свойства молекул
Молекулы. Свойства молекул Уравнения химической реакции 8 класс
Уравнения химической реакции 8 класс Оксид кремния
Оксид кремния Жуғыш заттар және жуғыш әсері. 1 Лекция
Жуғыш заттар және жуғыш әсері. 1 Лекция Чугуны. Структура и свойства. Классификация и применение
Чугуны. Структура и свойства. Классификация и применение Алканы. Хлороформ
Алканы. Хлороформ Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Минералы. Классификация
Минералы. Классификация Строение атома кремния
Строение атома кремния Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Оксиды азота (II и IV). Азотная кислота. Строение молекулы Презентация урока химии: «Металлы и их соединения» 9 класс. Учитель хим
Презентация урока химии: «Металлы и их соединения» 9 класс. Учитель хим Занимательные опыты по химии
Занимательные опыты по химии Enantioselective Total Synthesis
Enantioselective Total Synthesis Углерод. 9 класс
Углерод. 9 класс Спирты
Спирты Биополимеры: естественные и искусственные
Биополимеры: естественные и искусственные Коллигативные свойства растворов
Коллигативные свойства растворов Производство аммиака
Производство аммиака