Содержание
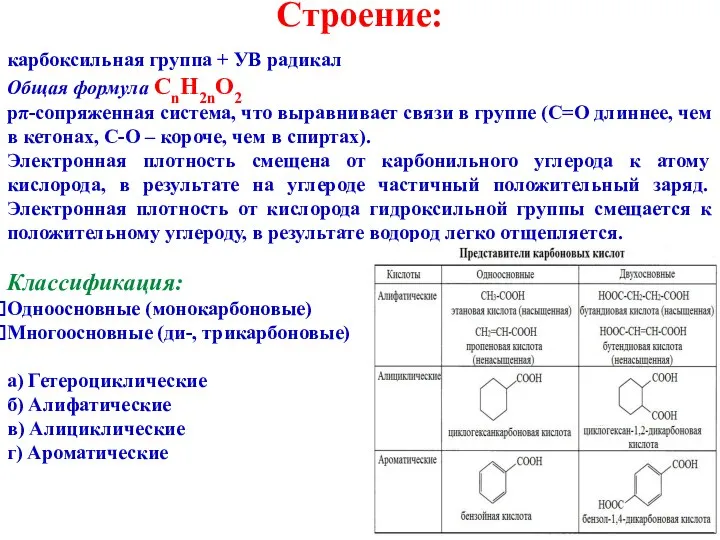
- 2. Строение: карбоксильная группа + УВ радикал Общая формула CnH2nO2 pπ-сопряженная система, что выравнивает связи в группе
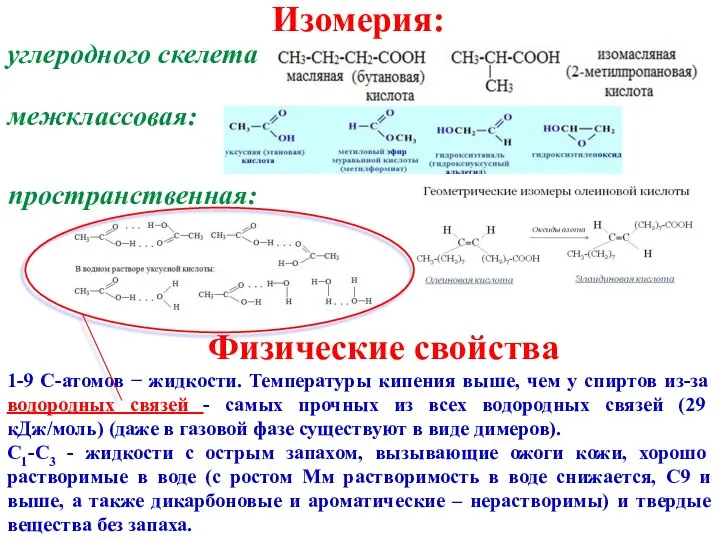
- 3. Изомерия: углеродного скелета межклассовая: Физические свойства 1-9 С-атомов − жидкости. Температуры кипения выше, чем у спиртов
- 4. Номенклатура: 1.муравьиная 2.уксусная 3.Пропионовая (С2Н5СООН) 4.Масляная (С3Н7СООН) 5.Валериановая (С4Н9СООН) Первые пять представителей (+ бензойная кислота) имеют
- 5. Получение: 1. Окисление соответствующих альдегидов, кетонов или спиртов (KMnO4, хромовая смесь). При окислении кетонов перекисями образуются
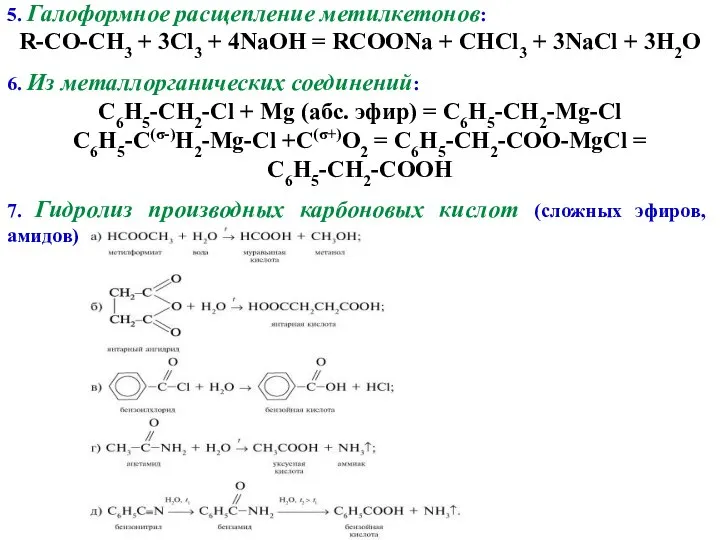
- 6. 5. Галоформное расщепление метилкетонов: R-CO-CH3 + 3Cl3 + 4NaOH = RCOONa + CHCl3 + 3NaCl +
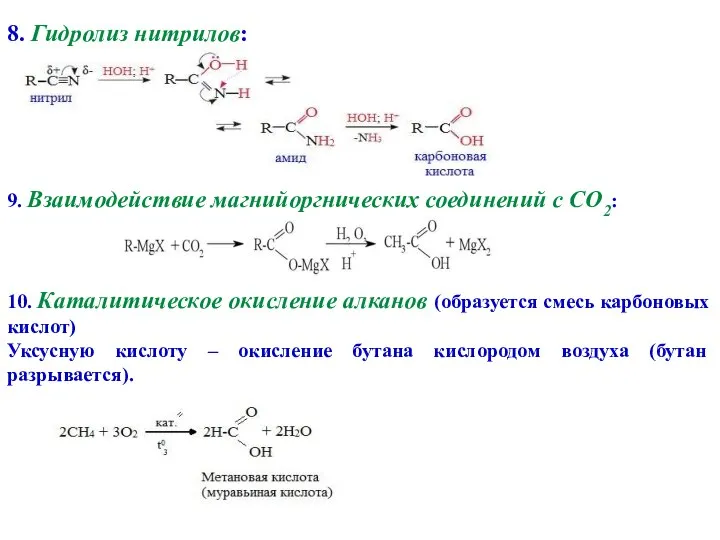
- 7. 8. Гидролиз нитрилов: 9. Взаимодействие магнийоргнических соединений с CO2: 10. Каталитическое окисление алканов (образуется смесь карбоновых
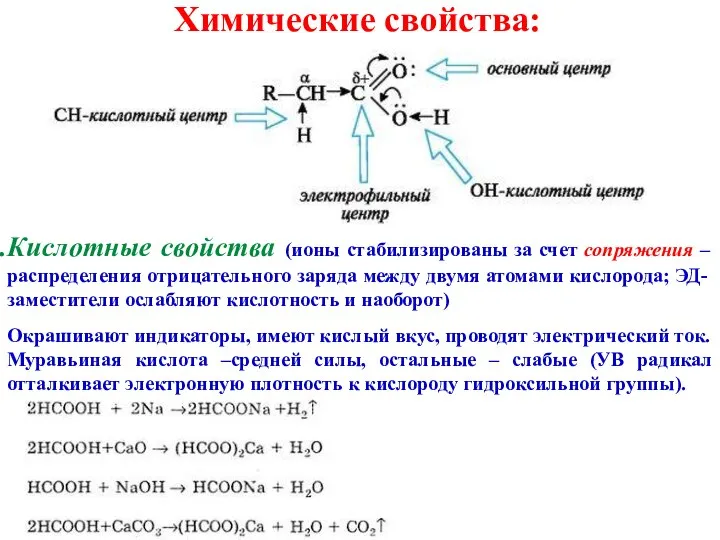
- 8. Химические свойства: Кислотные свойства (ионы стабилизированы за счет сопряжения – распределения отрицательного заряда между двумя атомами
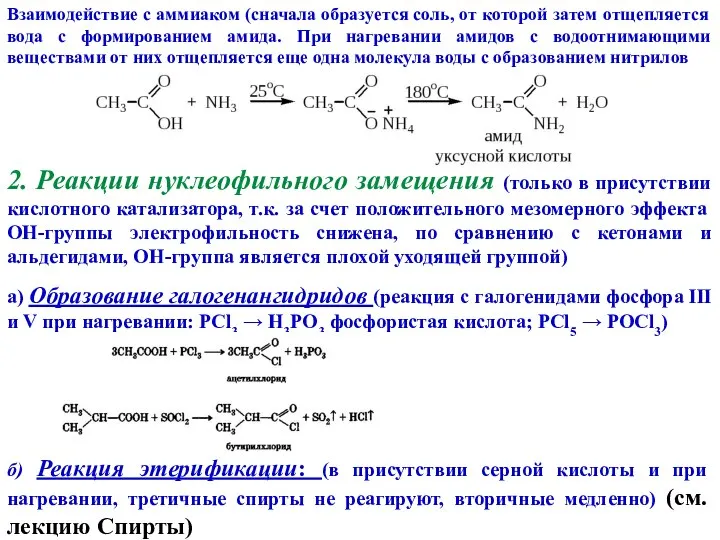
- 9. Взаимодействие с аммиаком (сначала образуется соль, от которой затем отщепляется вода с формированием амида. При нагревании
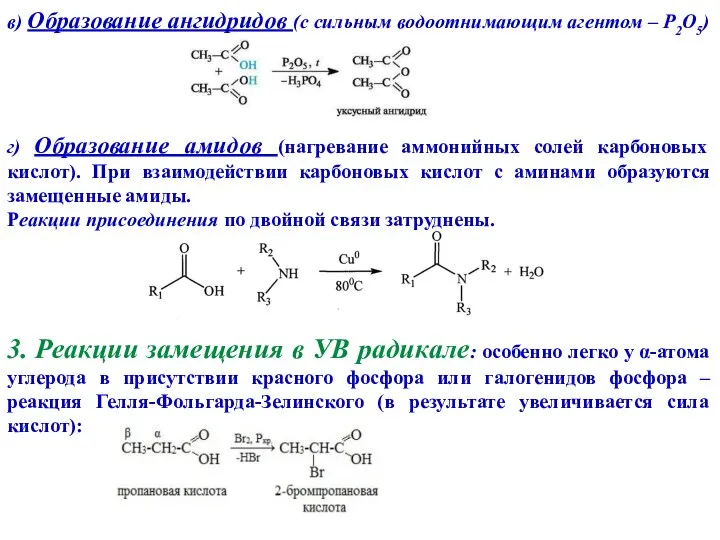
- 10. в) Образование ангидридов (c сильным водоотнимающим агентом – P2O5) г) Образование амидов (нагревание аммонийных солей карбоновых
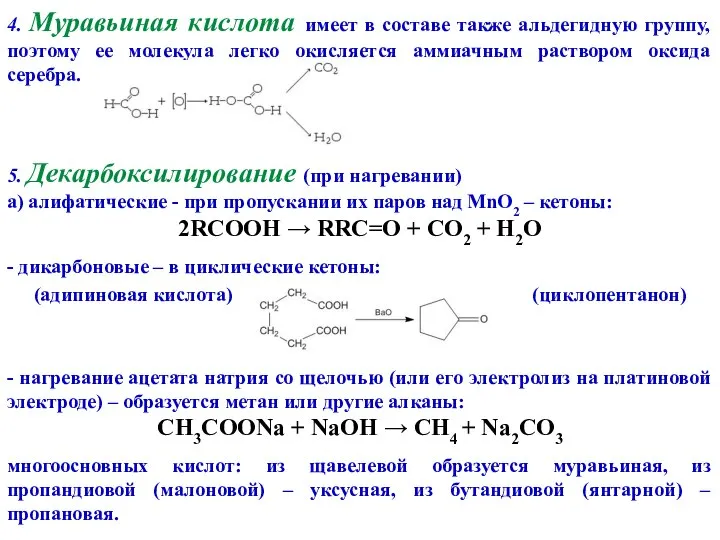
- 11. 4. Муравьиная кислота имеет в составе также альдегидную группу, поэтому ее молекула легко окисляется аммиачным раствором
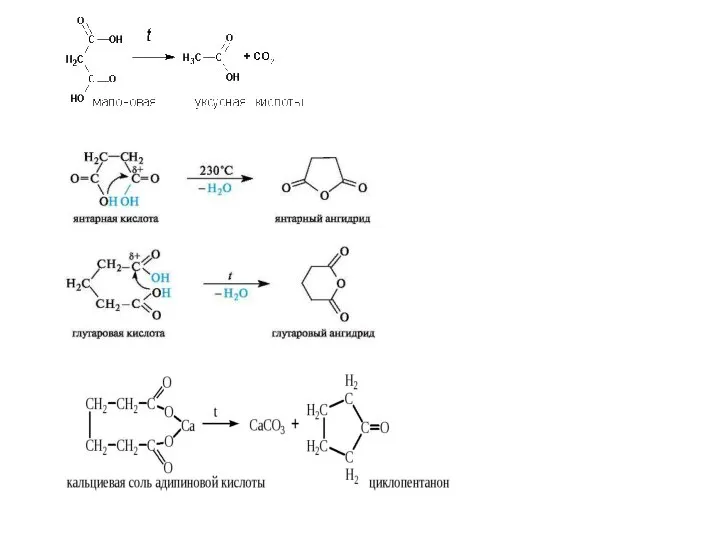
- 12. - α,β-ненасыщенные или ароматические (нагревание в хинолине в присутствии порошкообразной меди): - пиролиз кальциевых солей: -
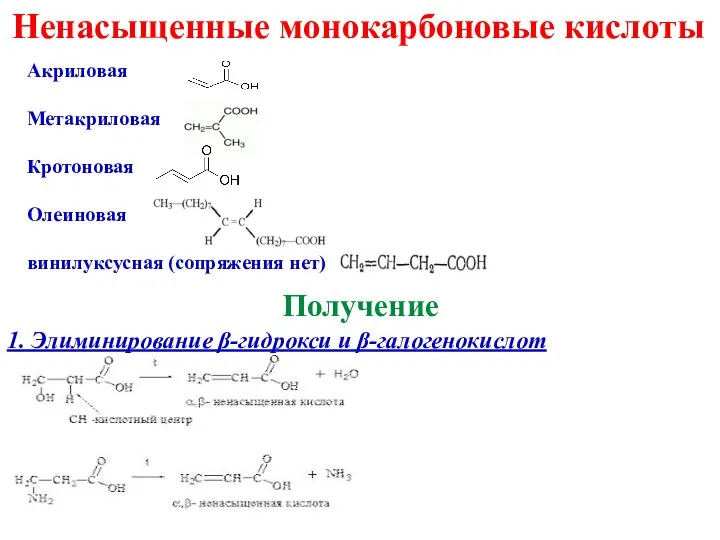
- 13. Ненасыщенные монокарбоновые кислоты Акриловая Метакриловая Кротоновая Олеиновая винилуксусная (сопряжения нет) Получение 1. Элиминирование β-гидрокси и β-галогенокислот
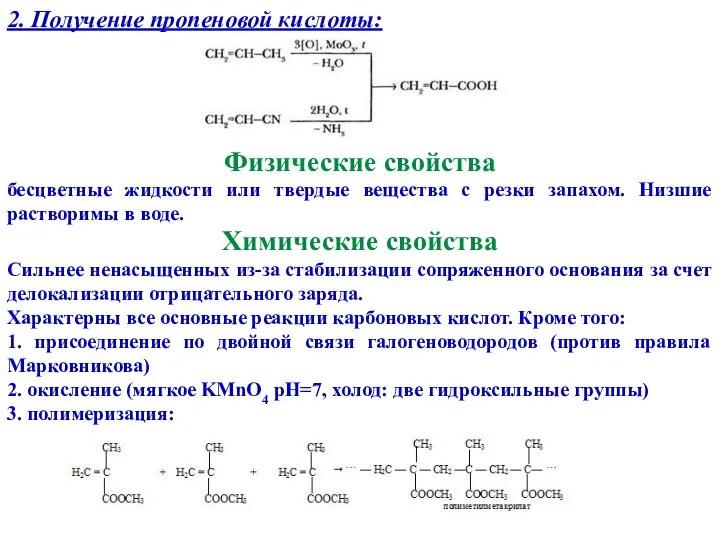
- 14. 2. Получение пропеновой кислоты: Физические свойства бесцветные жидкости или твердые вещества с резки запахом. Низшие растворимы
- 15. Акриловая кислота вступает в реакции диенового синтеза в качестве диенофила:
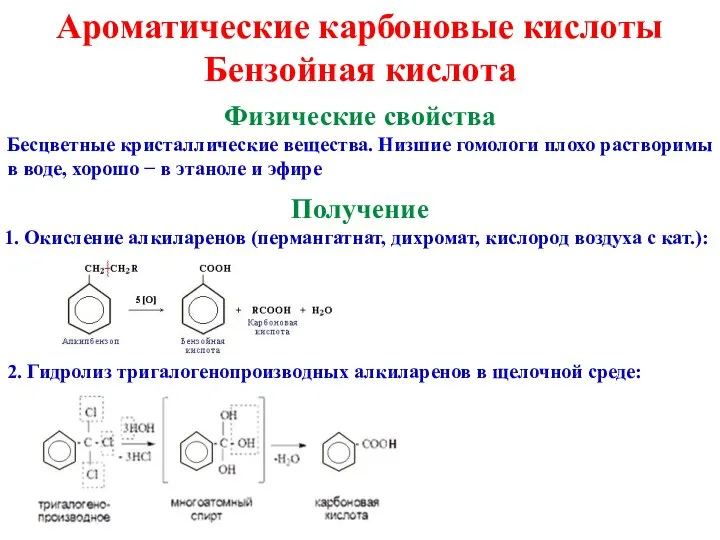
- 16. Ароматические карбоновые кислоты Бензойная кислота Физические свойства Бесцветные кристаллические вещества. Низшие гомологи плохо растворимы в воде,
- 17. Химические свойства По кислотным свойствам сильнее даже ненасыщенных за счет сопряжения. Характерны все реакции карбоновых кислот.
- 18. Насыщенные дикарбоновые кислоты Физические свойства Дикарбоновые кислоты – твердые вещества. Низшие члены ряда хорошо растворимы в
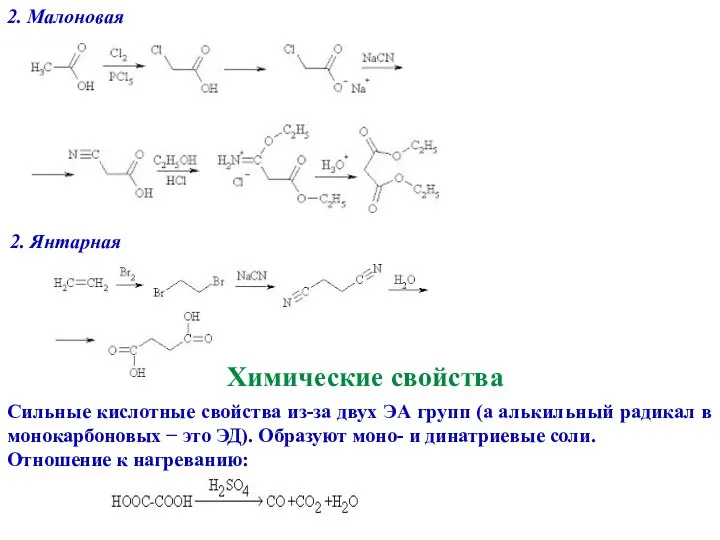
- 19. 2. Малоновая 2. Янтарная Химические свойства Сильные кислотные свойства из-за двух ЭА групп (а алькильный радикал
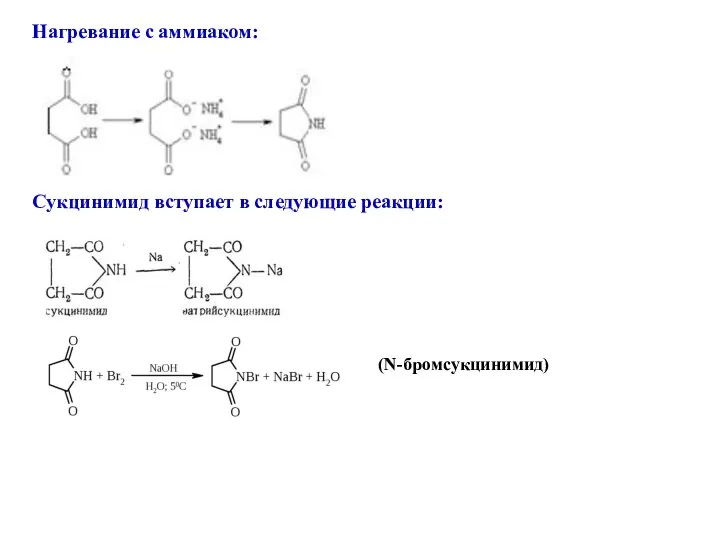
- 21. Нагревание с аммиаком: Сукцинимид вступает в следующие реакции: (N-бромсукцинимид)
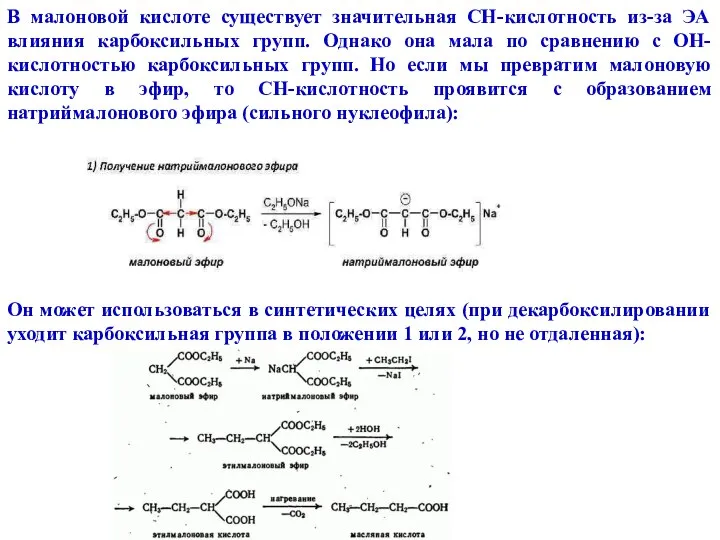
- 22. В малоновой кислоте существует значительная CH-кислотность из-за ЭА влияния карбоксильных групп. Однако она мала по сравнению
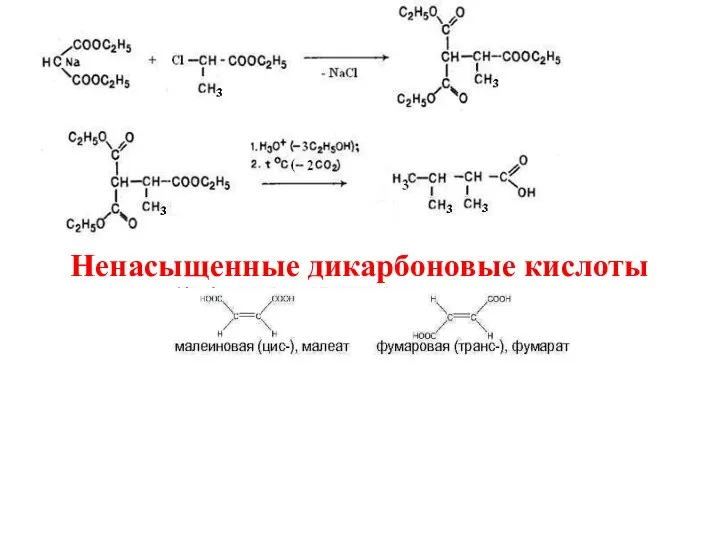
- 23. Ненасыщенные дикарбоновые кислоты
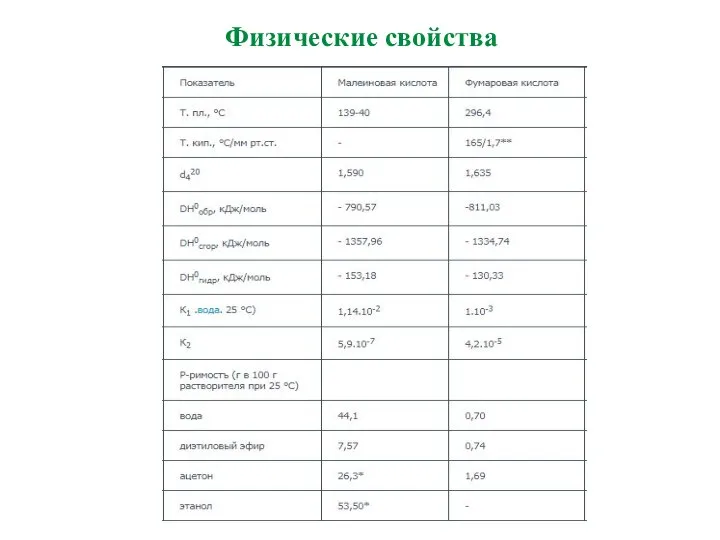
- 24. Физические свойства
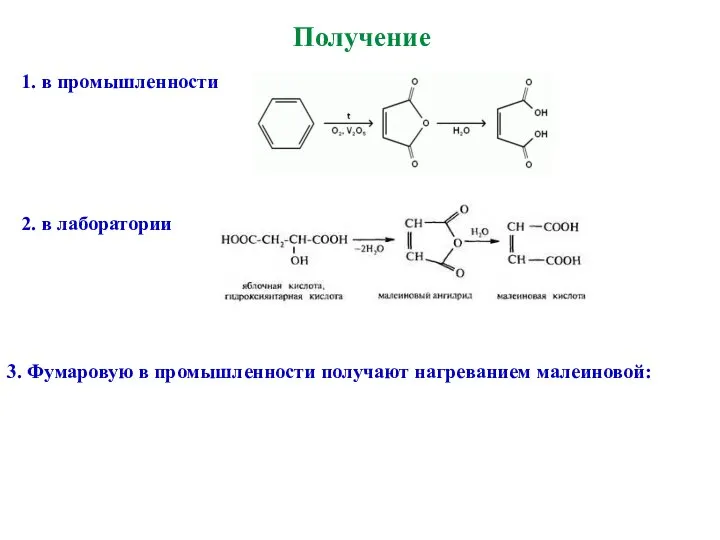
- 25. Получение 1. в промышленности 2. в лаборатории 3. Фумаровую в промышленности получают нагреванием малеиновой:
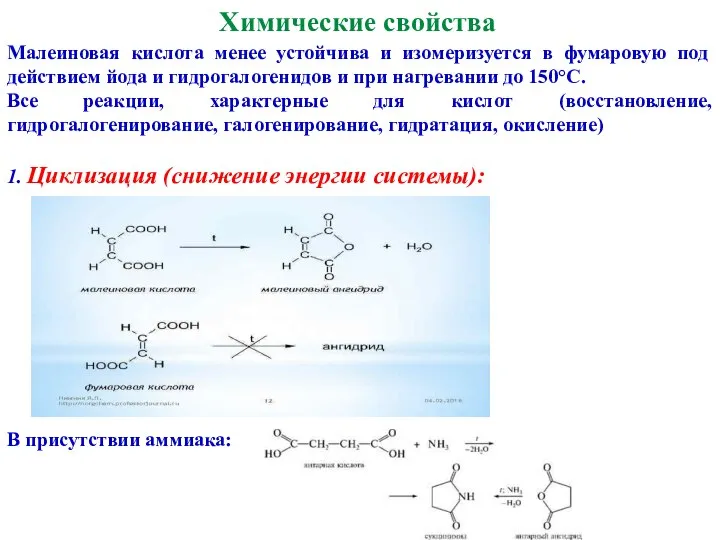
- 26. Химические свойства Малеиновая кислота менее устойчива и изомеризуется в фумаровую под действием йода и гидрогалогенидов и
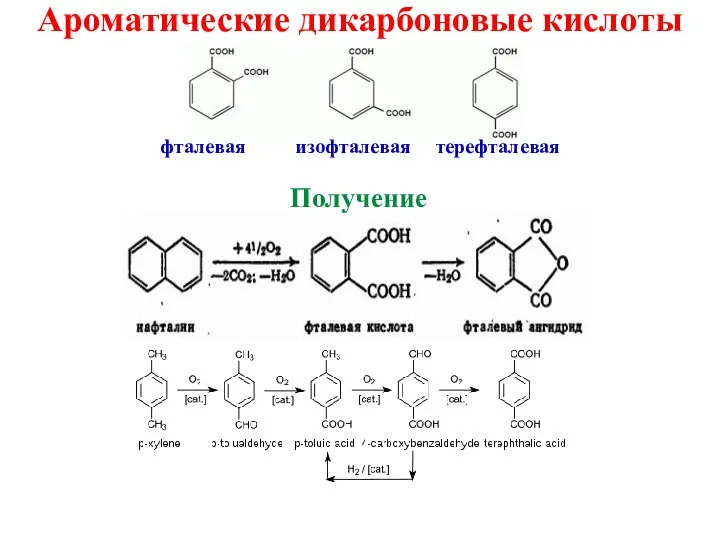
- 27. Ароматические дикарбоновые кислоты фталевая изофталевая терефталевая Получение
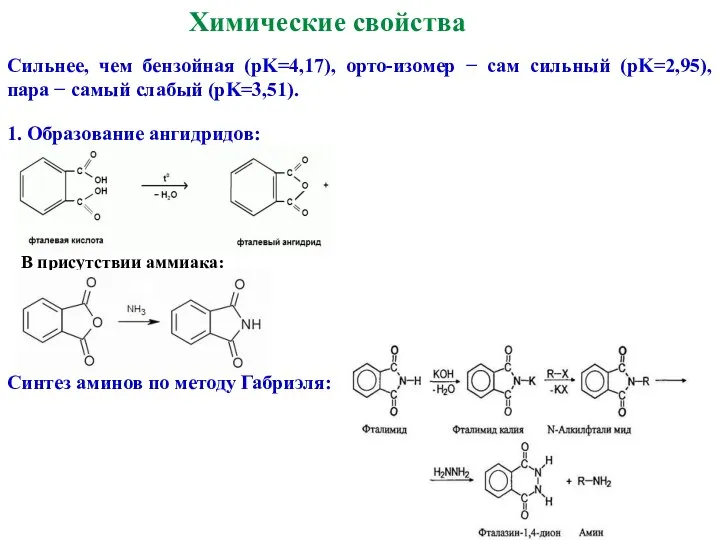
- 28. Химические свойства Сильнее, чем бензойная (pK=4,17), орто-изомер − сам сильный (pK=2,95), пара − самый слабый (pK=3,51).
- 30. Скачать презентацию






 Полисилоксаны. Классификация полимеров
Полисилоксаны. Классификация полимеров ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна
ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна  Жидкие кристаллы и их свойства
Жидкие кристаллы и их свойства Пептиды. Тема 3
Пептиды. Тема 3 Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599
Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599 Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле»  Введение в биохимию. Строение и функции белков (часть 2)
Введение в биохимию. Строение и функции белков (часть 2) Липиды. Классификация, физические и химические свойства
Липиды. Классификация, физические и химические свойства Материаловедение для пирсера. Материалы, используемые в пирсинге
Материаловедение для пирсера. Материалы, используемые в пирсинге Азот. История открытия азота
Азот. История открытия азота Периодический закон. Периодическая система химических элементов
Периодический закон. Периодическая система химических элементов 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Wybrane sybstancje chemiczne i ich działanie
Wybrane sybstancje chemiczne i ich działanie Фенол. Получение и использование, физические и химические свойства. Биологическая роль
Фенол. Получение и использование, физические и химические свойства. Биологическая роль Аморфные тела
Аморфные тела Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.
Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.  Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Организация е-транспортной цепи
Организация е-транспортной цепи Общая фармакология
Общая фармакология Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Классификация химических реакций
Классификация химических реакций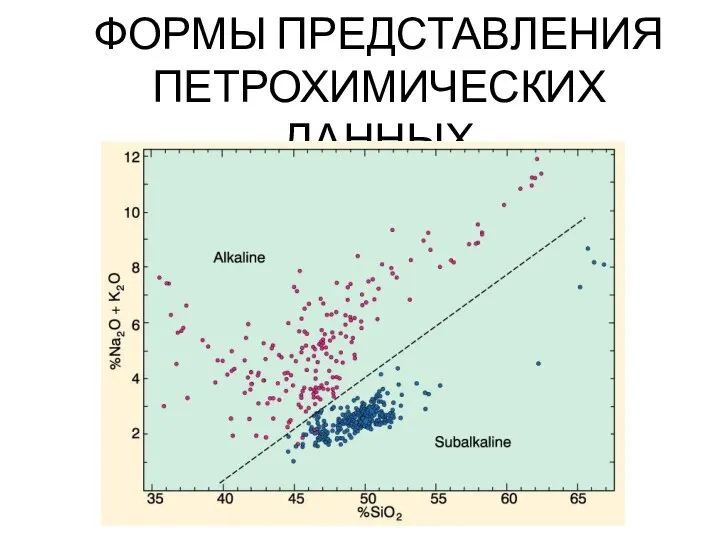 Формы представления петрохимических данных
Формы представления петрохимических данных Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Презентация по Химии "Химические элементы металлы и здоровье человека" - скачать смотреть бесплатно
Презентация по Химии "Химические элементы металлы и здоровье человека" - скачать смотреть бесплатно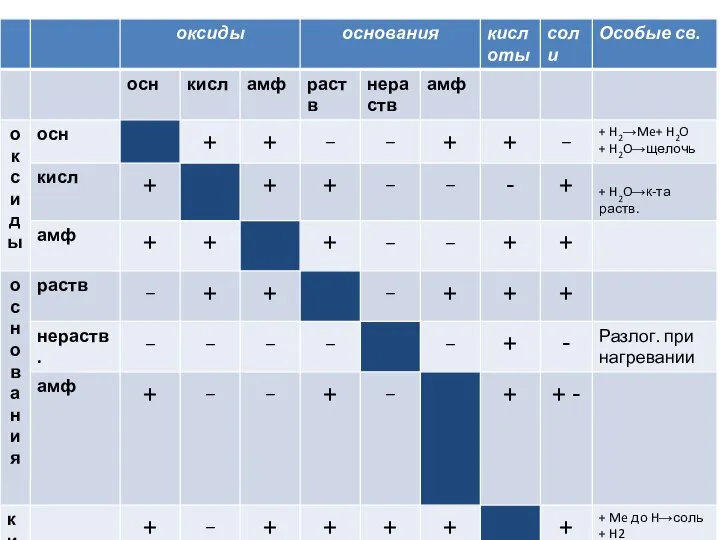 Оксиды, основания, кислоты
Оксиды, основания, кислоты Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией
Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов