Содержание
- 2. Кислород – это вещество, вокруг которого вращается вся земная химия. (Й.Я.Берцелиус)
- 3. Докажите, что кислород - невидимка, но находится везде и может все» .
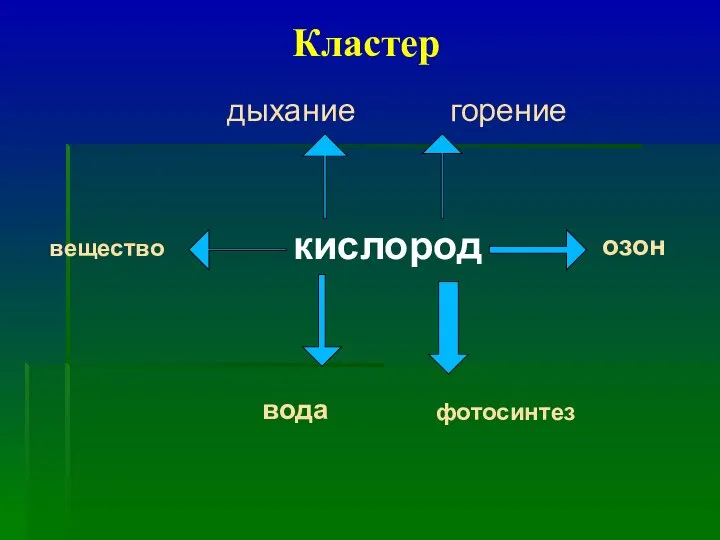
- 4. Кластер кислород дыхание горение фотосинтез озон вода вещество
- 5. Актуализация опорных знаний Определенный вид атомов — …. химический элемент Свойство атомов удерживать определенное число других
- 6. План изучения нового материала 1. История открытия кислорода. 2. Кислород как химический элемент 3. Кислород как
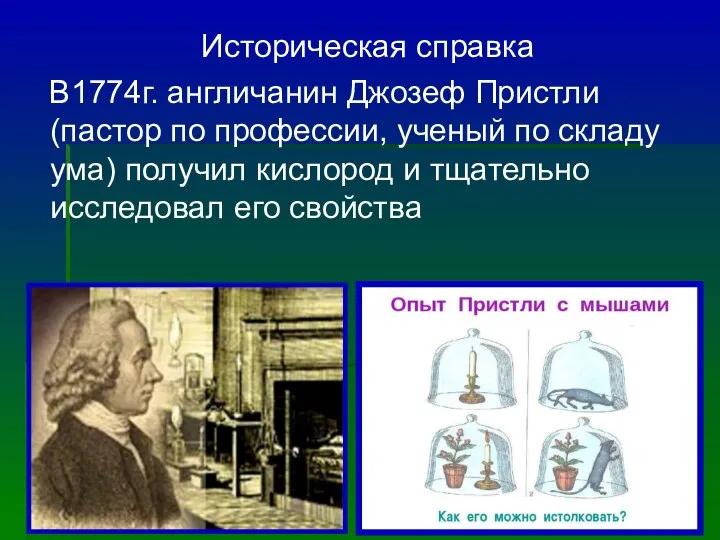
- 7. Историческая справка В1774г. англичанин Джозеф Пристли (пастор по профессии, ученый по складу ума) получил кислород и
- 8. О своем открытии Пристли сообщил другу - французу А. Л. Лавуазье. Тот отличил полученный газ от
- 9. 1. Кислород как химический элемент План характеристики химического элемента 1. Химический знак. 2. Положение в периодической
- 10. Кислород как элемент Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8,
- 11. 2. Кислород как вещество План характеристики простого вещества 1. Химическая формула. 2. Относительная молекулярная масса. 3.
- 12. Кислород в природе В земной коре его 49%, в воде – 89%. В составе воздуха (в
- 13. Жидкий кислород Твердый кислород
- 14. Физические свойства кислорода. Признаки Кислород-простое вещество Формула молекулы кислорода Агрегатное состояние Цвет запах Растворимость в воде
- 15. Способы получения и собирания кислорода. Кислород в природе образуется в процессе фотосинтеза. В промышленности его получают
- 16. В лаборатории кислород получают реакциями разложения: а) воды под действием электрического тока (электролиз): 2H2O → 2H2
- 17. назад
- 18. назад
- 19. назад
- 20. Получение кислорода , проверка его наличия тлеющей лучиной
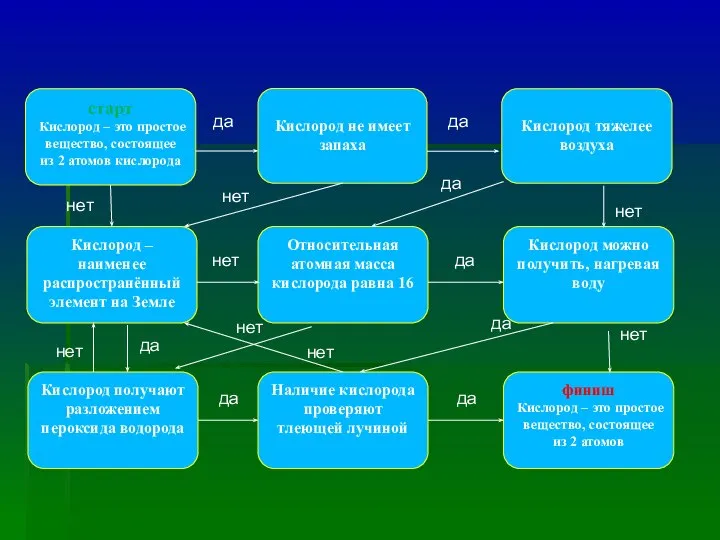
- 21. старт Кислород – это простое вещество, состоящее из 2 атомов кислорода Кислород не имеет запаха Кислород
- 23. Скачать презентацию

















 Строение атома. Периодический закон. Периодическая система
Строение атома. Периодический закон. Периодическая система Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан
Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан Периодический закон и ПСХЭ Д.И. Менделеева
Периодический закон и ПСХЭ Д.И. Менделеева Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Органическая химия
Органическая химия Алкины
Алкины Францій БІОЛОГІЧНА РОЛЬ
Францій БІОЛОГІЧНА РОЛЬ  Биологически активные низкомолекулярные вещества
Биологически активные низкомолекулярные вещества Нефть
Нефть Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ Презентация по Химии "Металлическая химическая связь" - скачать смотреть
Презентация по Химии "Металлическая химическая связь" - скачать смотреть  Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть
Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть  Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Алкадиены. Физические свойства
Алкадиены. Физические свойства Кривые титрования. (Лекция 6)
Кривые титрования. (Лекция 6) Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц
Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц Элементы-металлы. Викторина. 9 класс
Элементы-металлы. Викторина. 9 класс Минеральные удобрения
Минеральные удобрения Химическое загрязнение почвы
Химическое загрязнение почвы Презентация по Химии "Задания на соответствие" - скачать смотреть
Презентация по Химии "Задания на соответствие" - скачать смотреть  ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Менделєєв Дмитро Іванович
Менделєєв Дмитро Іванович  Химическая связь
Химическая связь s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Химия и сельское хозяйство
Химия и сельское хозяйство