Содержание
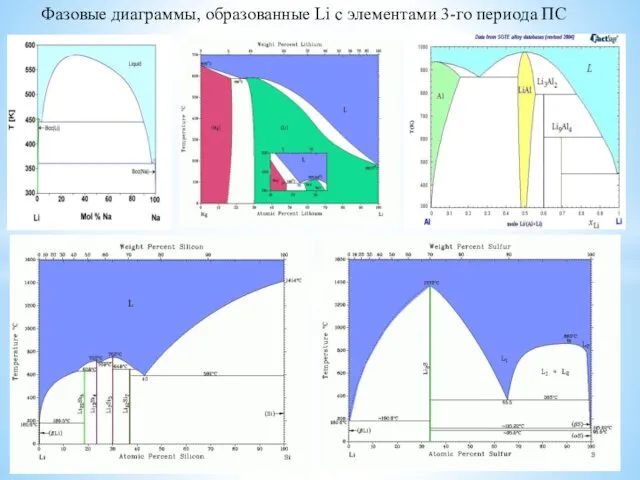
- 2. Фазовые диаграммы, образованные Li с элементами 3-го периода ПС
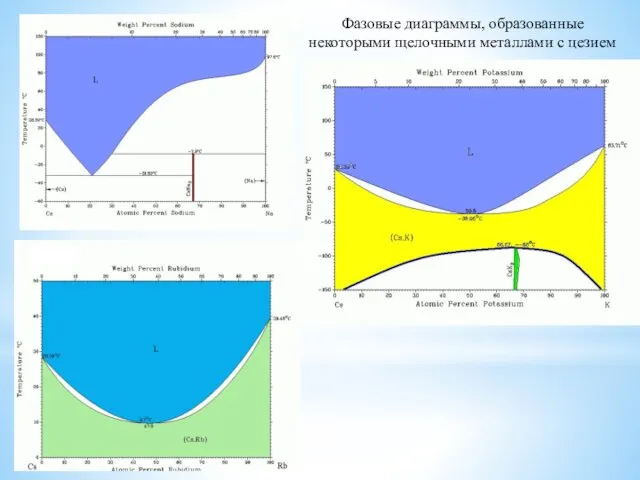
- 4. Фазовые диаграммы, образованные некоторыми щелочными металлами с цезием
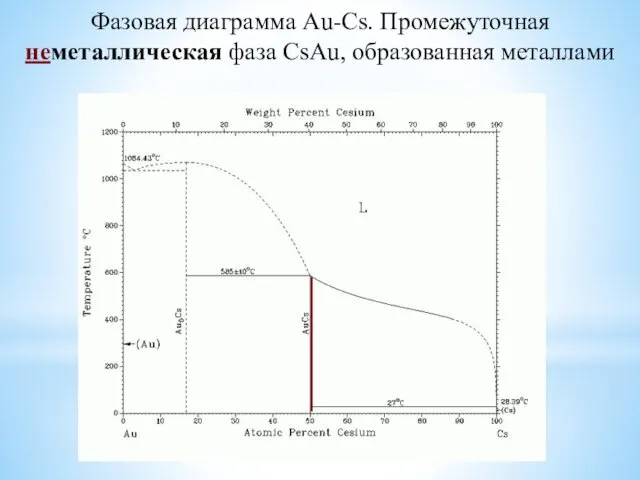
- 5. Фазовая диаграмма Au-Cs. Промежуточная неметаллическая фаза CsAu, образованная металлами
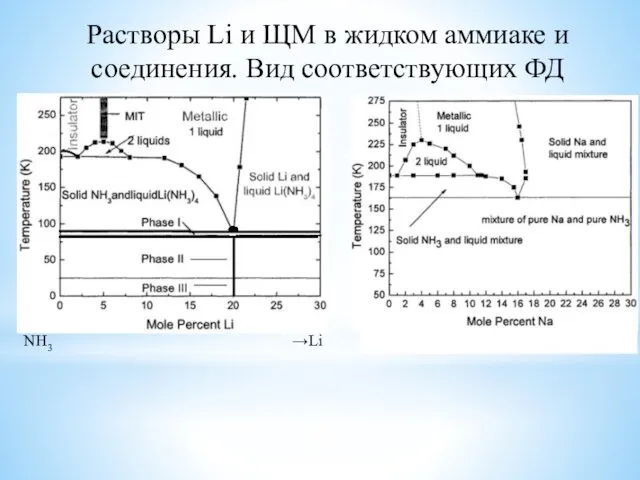
- 6. Растворы Li и ЩМ в жидком аммиаке и соединения. Вид соответствующих ФД Важно: 1. Эти диаграммы
- 7. Растворы Li и ЩМ в жидком аммиаке и соединения. Вид соответствующих ФД NH3 →Li NH3 →Na
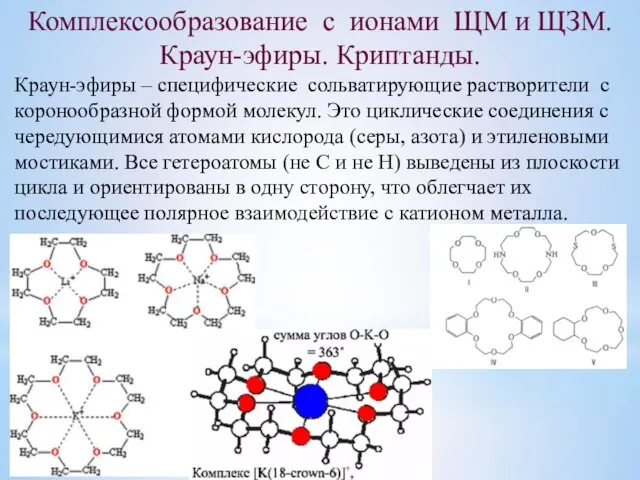
- 8. Комплексообразование с ионами ЩМ и ЩЗМ. Краун-эфиры. Криптанды. Краун-эфиры – специфические сольватирующие растворители с коронообразной формой
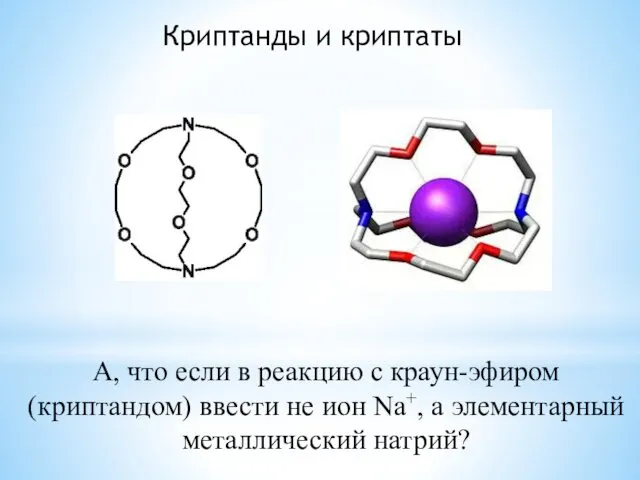
- 9. Криптанды и криптаты А, что если в реакцию с краун-эфиром (криптандом) ввести не ион Na+, а
- 10. Электрид, образованный натрием и краун-эфиром Электриды и алкилиды Алкилид, образованный натрием и краун-эфиром
- 11. План: Электронное строение элементов Ia и IIa подгрупп ПС; Простые вещества, металлохимические свойства; Ослабление активности в
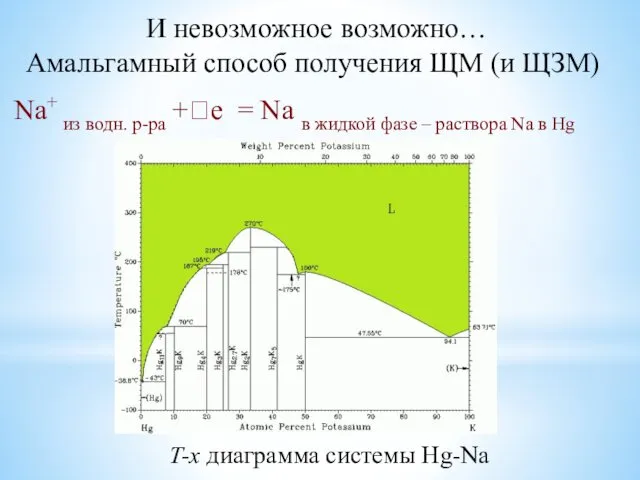
- 12. И невозможное возможно… Амальгамный способ получения ЩМ (и ЩЗМ) T-x диаграмма системы Hg-Na Na+ из водн.
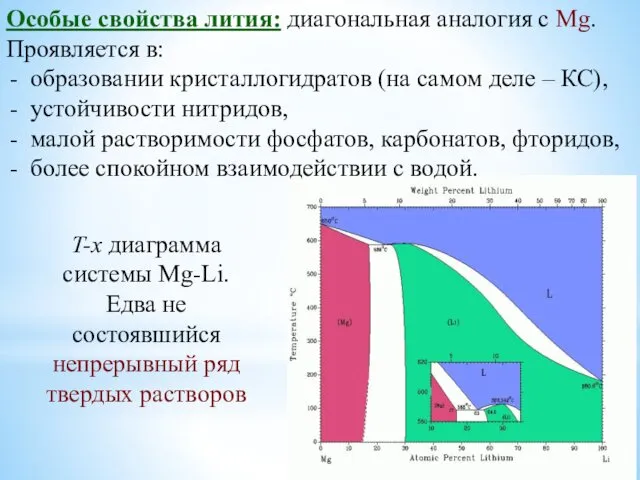
- 13. Особые свойства лития: диагональная аналогия с Mg. Проявляется в: образовании кристаллогидратов (на самом деле – КС),
- 14. Кислородные соединения ЩМ 4Li + O2 = 2Li2O (много); 2Li + O2 = Li2O2 (следы) 2Na
- 15. II главная подгруппа ПС: Be, Mg, Ca, Sr, Ba, Ra Be (у других элементов – аналогично,
- 16. Особые свойства бериллия: диагональная аналогия с алюминием + невозможность ковалентности выше 4. Особые свойства бериллия проявляются
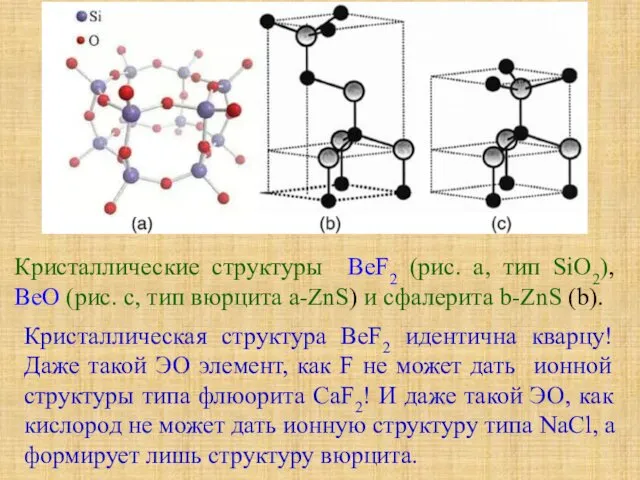
- 17. Кристаллическая структура BeF2 идентична кварцу! Даже такой ЭО элемент, как F не может дать ионной структуры
- 18. Общие закономерности при переходе от Be к Ra: - увеличение размеров атомов и ионов; - увеличение
- 19. Характерные свойства ЩЗМ (Ca, Sr, Ba, Ra): Растворимость в безводном жидком аммиаке Me + 14NH3 (ж)
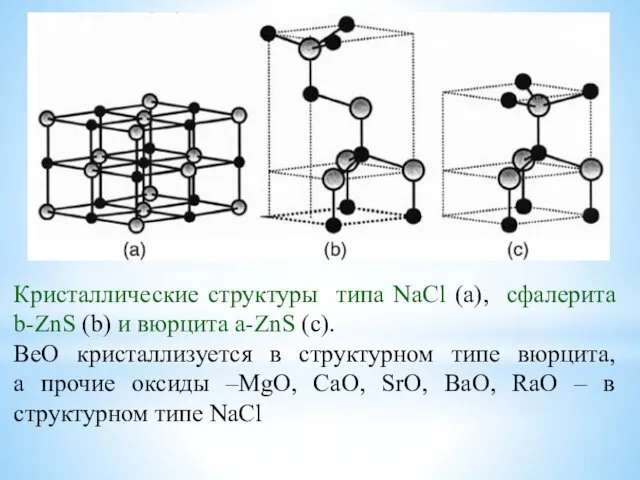
- 20. Кристаллические структуры типа NaCl (а), сфалерита b-ZnS (b) и вюрцита a-ZnS (c). BeO кристаллизуется в структурном
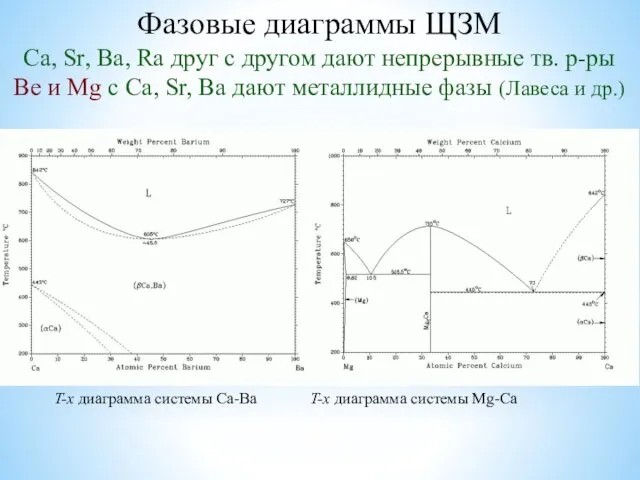
- 21. Фазовые диаграммы ЩЗМ Ca, Sr, Ba, Ra друг с другом дают непрерывные тв. р-ры Be и
- 22. Важнейшие соединения кальция и других ЩЗМ В действительности все не так, как в очевидности... CaCl2(водн. р-р)
- 23. Важнейшие соединения кальция и других ЩЗМ Флюорит CaF2 и другие фториды ЩЗМ Квазихимические реакции: EuF3→CaF2 =
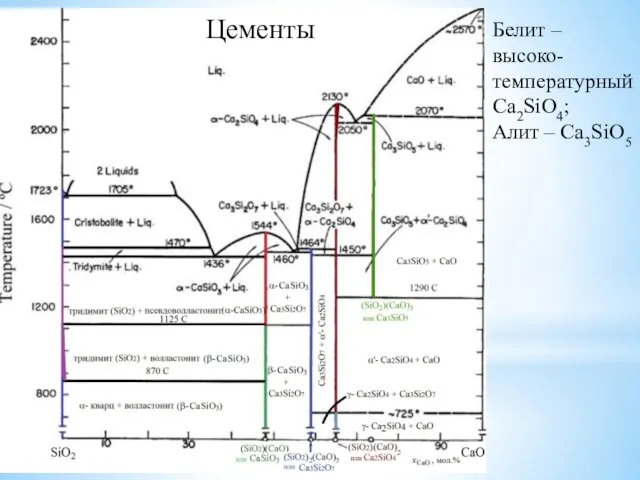
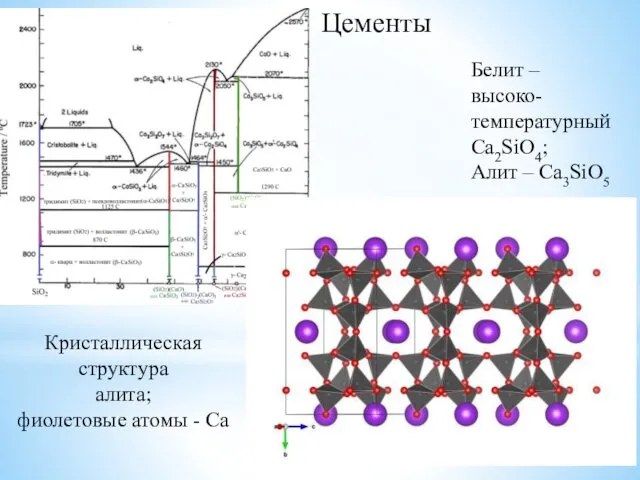
- 24. Цементы Белит – высоко-температурный Ca2SiO4; Алит – Ca3SiO5
- 25. Цементы Белит – высоко-температурный Ca2SiO4; Алит – Ca3SiO5 Кристаллическая структура алита; фиолетовые атомы - Ca
- 27. Скачать презентацию











 Кислоты. Классификация кислот
Кислоты. Классификация кислот Презентация по Химии "Все о пищевых добавках класса Е" - скачать смотреть
Презентация по Химии "Все о пищевых добавках класса Е" - скачать смотреть  Металлическая химическая связь. Тема 2.5
Металлическая химическая связь. Тема 2.5 Каучук и резина
Каучук и резина Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) Насыпная плотность, методы определения, примеры
Насыпная плотность, методы определения, примеры Физиологические эффекты активных форм кислорода
Физиологические эффекты активных форм кислорода Классификация методов исследования поверхности, основанных на взаимодействии излучения с веществом
Классификация методов исследования поверхности, основанных на взаимодействии излучения с веществом Презентация по Химии "Методическая тема учителя химии и биологии" - скачать смотреть
Презентация по Химии "Методическая тема учителя химии и биологии" - скачать смотреть  Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Литосфера. Физико-химические процессы в литосфере
Литосфера. Физико-химические процессы в литосфере Пространственное строение молекул органических соединений
Пространственное строение молекул органических соединений Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н
Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н Азот. Кислородные соединения
Азот. Кислородные соединения Основные классы неорганических соединений
Основные классы неорганических соединений Актуальные проблемы газовой отрасли России
Актуальные проблемы газовой отрасли России  Теплова теорія припинення горіння. Вогнегасні засоби
Теплова теорія припинення горіння. Вогнегасні засоби Метаболизм липидов
Метаболизм липидов Углерод. Физические свойства
Углерод. Физические свойства Хімічна кінетика
Хімічна кінетика Математическое моделирование. Контурно-графический анализ
Математическое моделирование. Контурно-графический анализ Индивидуальные задания для самостоятельной работы студентов нехимических специальностей
Индивидуальные задания для самостоятельной работы студентов нехимических специальностей Гидролиз
Гидролиз 20141105_otkrytyy_urok_v_7-m_klasse_spetsialnoy_korrektsionnoy_shkoly_viii_vida_po_teme_khranenie_mineralnykh_udobreniy
20141105_otkrytyy_urok_v_7-m_klasse_spetsialnoy_korrektsionnoy_shkoly_viii_vida_po_teme_khranenie_mineralnykh_udobreniy Классификация неорганических веществ
Классификация неорганических веществ Окислительное фосфорилирование
Окислительное фосфорилирование Металлы. Общая характеристика металлов и их свойства
Металлы. Общая характеристика металлов и их свойства Алканы. Циклоалканы
Алканы. Циклоалканы