Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу
Содержание
- 2. Содержание 1.Определение 2.Номенклатура алкенов 3.Изомерия алкенов 4.Строение алкенов 5.Получение алкенов 6.Физические свойства 7.Химические свойства 8.Применение алкенов
- 3. Определение Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная связь. Общая
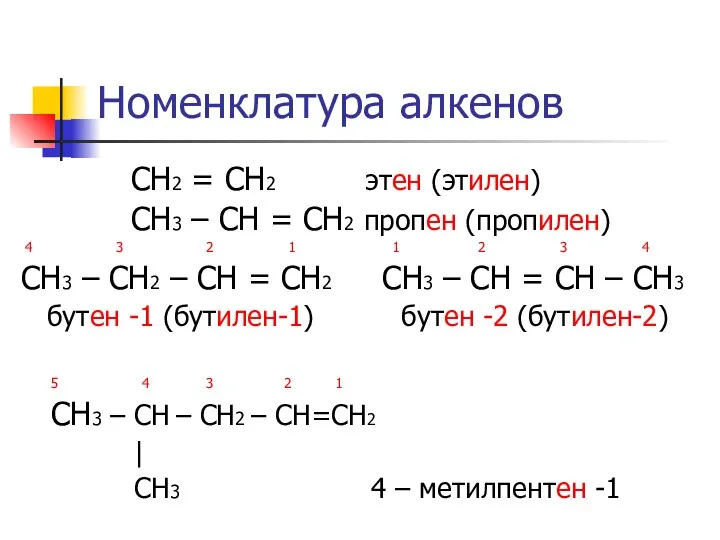
- 4. Номенклатура алкенов СН2 = СН2 этен (этилен) СН3 – СН = СН2 пропен (пропилен) 4 3
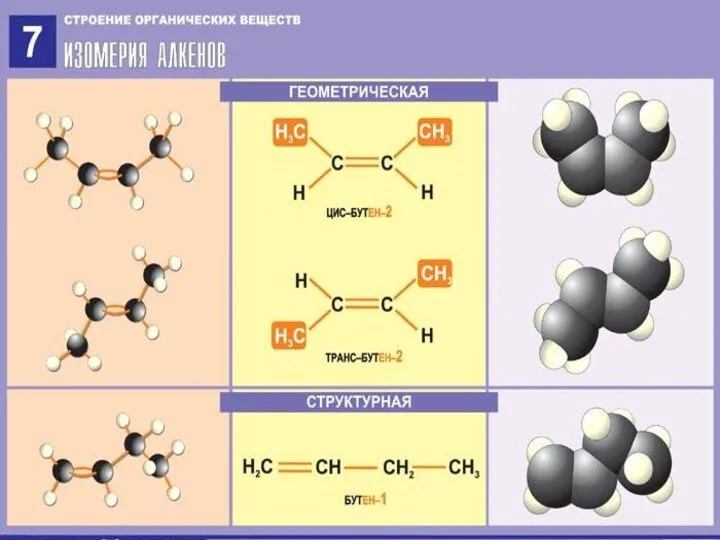
- 5. Изомерия алкенов
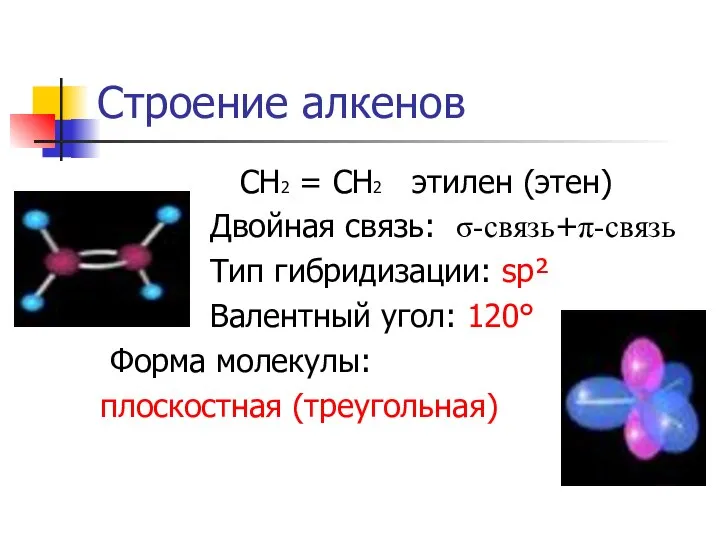
- 6. Строение алкенов СН2 = СН2 этилен (этен) Двойная связь: σ-связь+π-связь Тип гибридизации: sp² Валентный угол: 120°
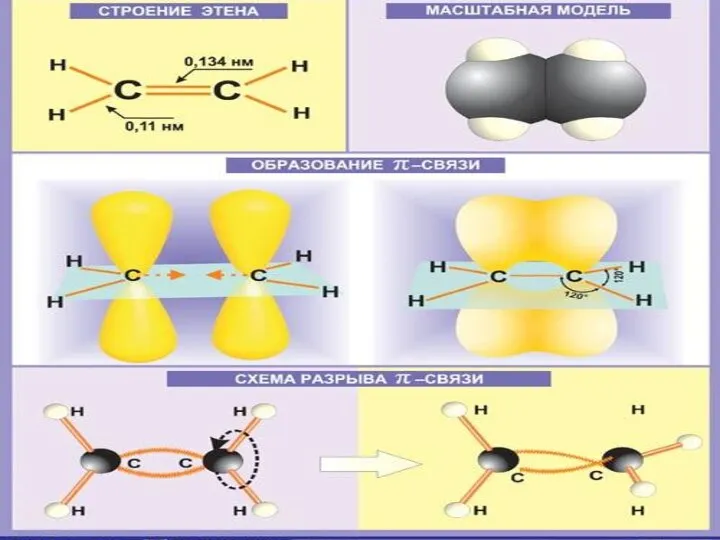
- 7. Строение алкенов
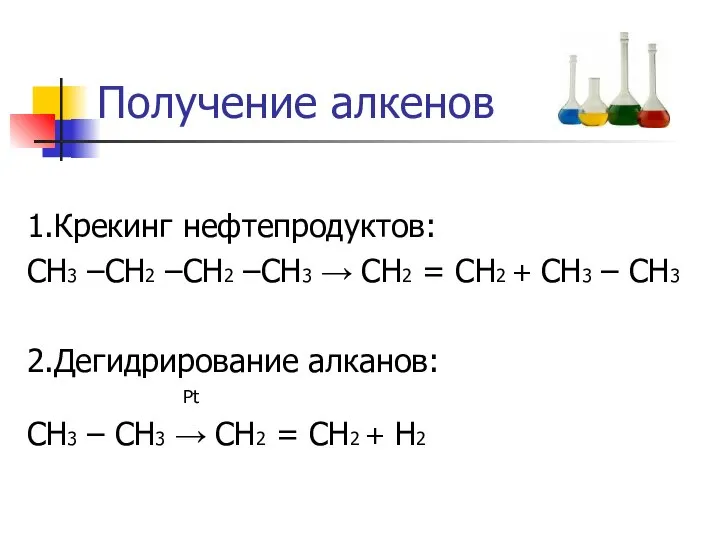
- 8. Получение алкенов 1.Крекинг нефтепродуктов: СН3 –СН2 –СН2 –СН3 → СН2 = СН2 + СН3 – СН3
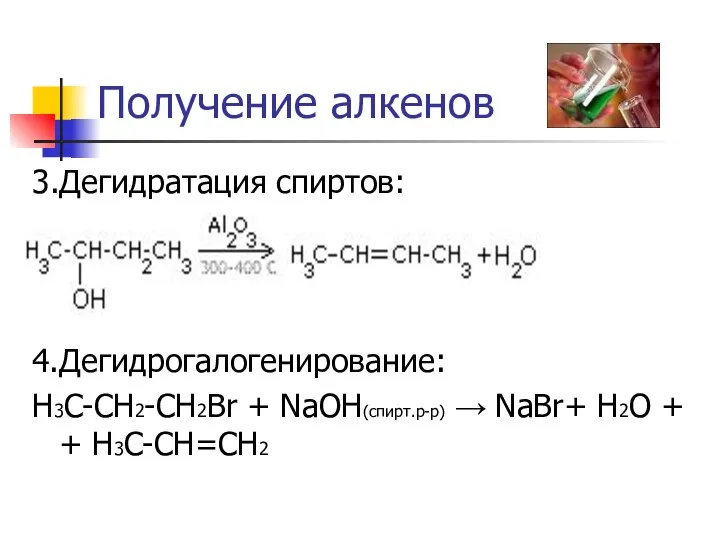
- 9. Получение алкенов 3.Дегидратация спиртов: 4.Дегидрогалогенирование: H3C-CH2-CH2Br + NaOH(спирт.р-р) → NaBr+ H2O + + H3C-CH=CH2
- 10. Получение алкенов 5.Дегалогенирование:
- 11. Физические свойства Этен,пропен, бутен – газы С5Н10 – С16Н32 - жидкости Высшие алкены – тв.вещества
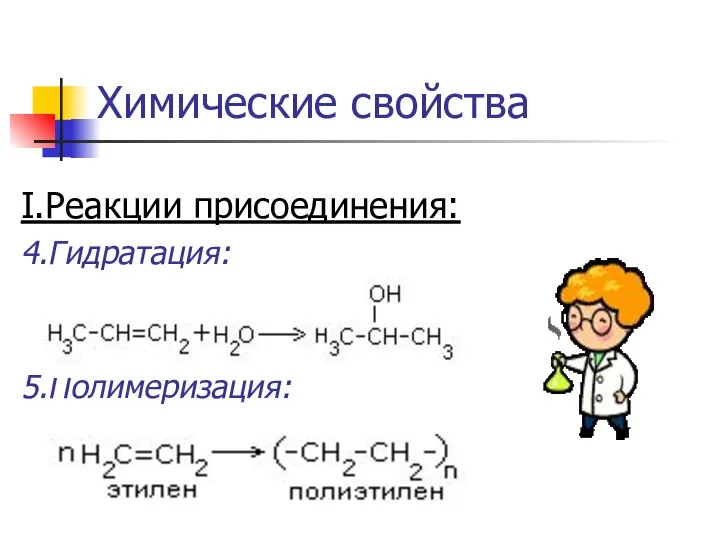
- 12. Химические свойства I.Реакции присоединения: 1.Гидрирование : CH2=CH-CH3+Н2 → CH3-CH2-CH3 2.Галогенирование: CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3 3.Гидрогалогенирование: CH2=CH-CH3+НCl →
- 13. Химические свойства I.Реакции присоединения: 4.Гидратация: 5.Полимеризация:
- 14. Химические свойства II.Реакции окисления: 1.Полное окисление (горение): С2Н4 + 3О2 → 2СО2 + 2Н2О 2.Неполное окисление:
- 15. Применение алкенов
- 17. Скачать презентацию







 Строение атома. Периодический закон. Периодическая система
Строение атома. Периодический закон. Периодическая система Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан
Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан Периодический закон и ПСХЭ Д.И. Менделеева
Периодический закон и ПСХЭ Д.И. Менделеева Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Органическая химия
Органическая химия Алкины
Алкины Францій БІОЛОГІЧНА РОЛЬ
Францій БІОЛОГІЧНА РОЛЬ  Биологически активные низкомолекулярные вещества
Биологически активные низкомолекулярные вещества Нефть
Нефть Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ Презентация по Химии "Металлическая химическая связь" - скачать смотреть
Презентация по Химии "Металлическая химическая связь" - скачать смотреть  Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть
Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть  Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Алкадиены. Физические свойства
Алкадиены. Физические свойства Кривые титрования. (Лекция 6)
Кривые титрования. (Лекция 6) Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц
Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц Элементы-металлы. Викторина. 9 класс
Элементы-металлы. Викторина. 9 класс Минеральные удобрения
Минеральные удобрения Химическое загрязнение почвы
Химическое загрязнение почвы Презентация по Химии "Задания на соответствие" - скачать смотреть
Презентация по Химии "Задания на соответствие" - скачать смотреть  ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Менделєєв Дмитро Іванович
Менделєєв Дмитро Іванович  Химическая связь
Химическая связь s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Химия и сельское хозяйство
Химия и сельское хозяйство