Содержание
- 2. УДК 546.04 ББК 24.1 Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ) Рекомендовано к изданию кафедрой неорганической
- 3. Рекомендуемая литература
- 4. Введение Классификация и номенклатура неорганических веществ
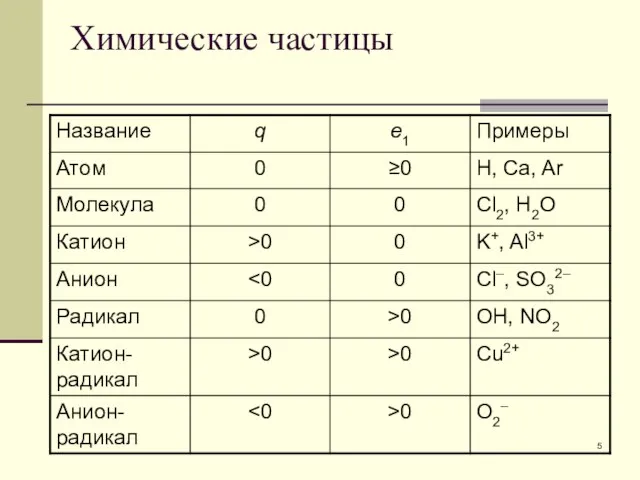
- 5. Химические частицы
- 6. Вещество ансамбль любых химических частиц или их совокупностей 1 частица = 1 формульная единица Ar –
- 7. Формульные единицы H2SO4 серная кислота NO2 диоксид азота CuSO4.5H2O пентагидрат сульфата меди H2SO4.2H2O, или (H3O)2SO4 сульфат
- 8. Обменные реакции в растворе Правило Бертолле: Обменные реакции в растворе протекают практически до конца, если один
- 9. Уравнения реакций: молекулярное BaCO3(т) + H2SO4(разб.) = BaSO4↓ + CO2↑ + H2O CuSO4 + K2S =
- 10. Составление уравнений AlCl3 + Na2S + H2O → Al(OH)3 + H2S + NaCl Al3+ + S2–
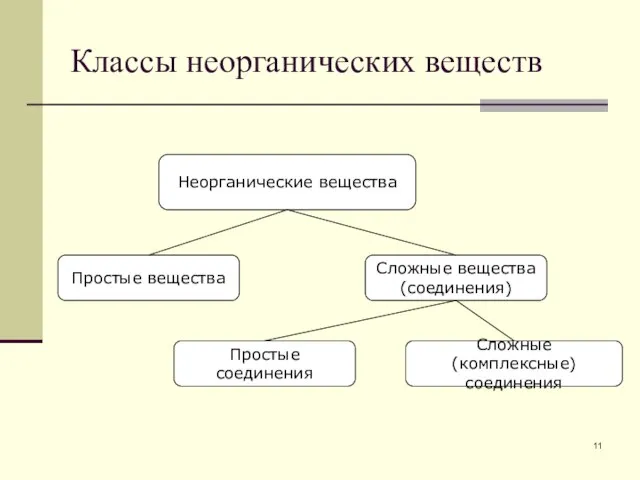
- 11. Классы неорганических веществ Неорганические вещества Простые вещества Простые соединения Сложные вещества (соединения) Сложные (комплексные) соединения
- 12. Простые вещества Неметаллы 22, включая 6 благородных газов Имеют высокие значения электроотрица-тельности (χ): F 4,1; O
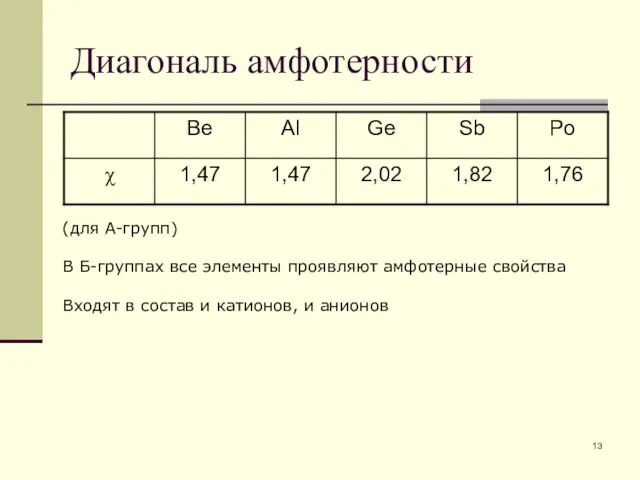
- 13. Диагональ амфотерности (для А-групп) В Б-группах все элементы проявляют амфотерные свойства Входят в состав и катионов,
- 14. Классификация простых соединений (по составу) основана на отношении к кислороду самый распространенный элемент на Земле образует
- 15. Классы неорганических соединений Оксиды ЭхО–IIу Na2O, CO2, ZnO (OF2, H2O2 к оксидам не относятся) Гидроксиды ЭхОу.nH2O
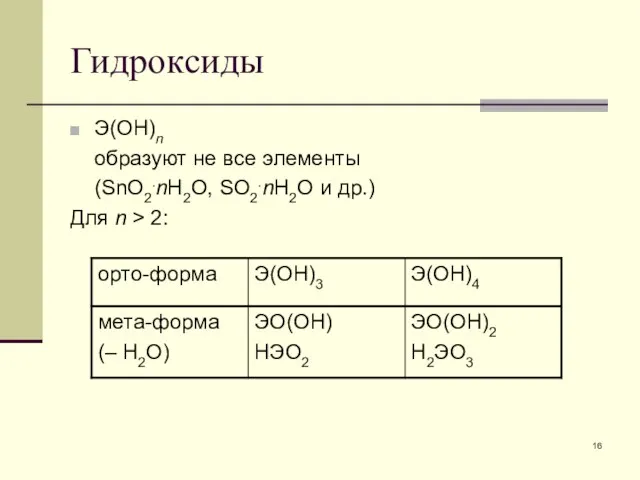
- 16. Гидроксиды Э(ОН)n образуют не все элементы (SnO2.nH2O, SO2.nH2O и др.) Для n > 2:
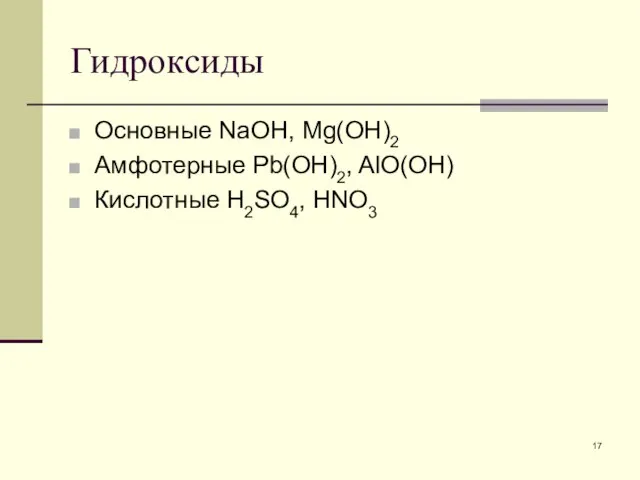
- 17. Гидроксиды Основные NaOH, Mg(OH)2 Амфотерные Pb(OH)2, AlO(OH) Кислотные H2SO4, HNO3
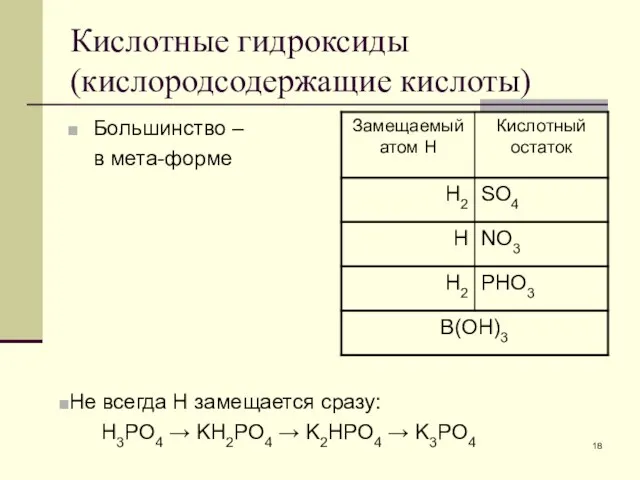
- 18. Кислотные гидроксиды (кислородсодержащие кислоты) Большинство – в мета-форме Не всегда Н замещается сразу: H3PO4 → KH2PO4
- 19. Номенклатура кислородсодержащих кислот Традиционные H2CO3 угольная кислота CO32– карбонат HCO3– гидрокарбонат и т.д. Систематические НхЭОу "у"-оксо-Э(лат.корень)-ат(с.о.
- 20. Основные гидроксиды (основания) Содержат гидроксидные группы, способные замещаться на кислотные остатки Всегда в орто-форме Номенклатура: LiOH
- 21. Важнейшее химическое свойство кислотных и основных гидроксидов взаимодействие их между собой с образованием солей (реакция нейтрализации,
- 22. Амфотерные гидроксиды Проявляются свойства и кислотных, и основных гидроксидов Основные свойства 2Al(OH)3 + 3H2SO4 = Al2(SO4)3
- 23. Оксиды Продукты полной дегидратации гидроксидов (реальной или мысленной) Кислотные H2SO4 = H2O + SO3 триоксид серы
- 24. Соли Средние Ba3(PO4)2 ортофосфат бария Кислые (содержат Н) Ba(H2PO4)2 дигидроортофосфат бария Основные (содержат ОН или О)
- 25. Бинарные соединения LiH гидрид лития Mg3P2 дифосфид тримагния NF3 трифторид азота CS2 дисульфид углерода HBr бромоводород
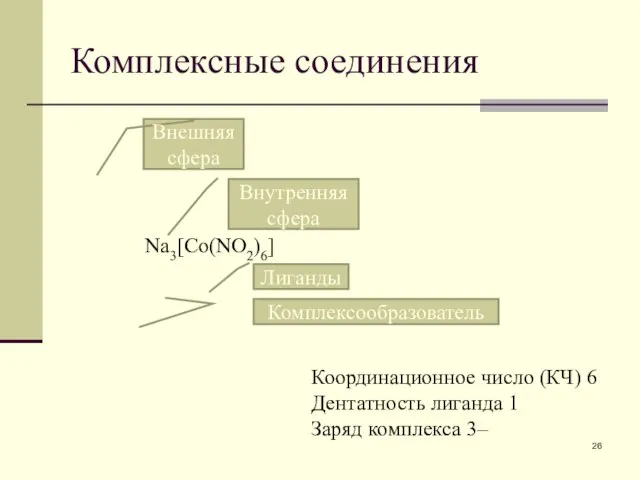
- 26. Комплексные соединения Координационное число (КЧ) 6 Дентатность лиганда 1 Заряд комплекса 3– Внешняя сфера Внутренняя сфера
- 27. Комплексные соединения сложные частицы, образованные из реально существующих более простых Включают внутреннюю сферу (ковалентные связи) и
- 28. Номенклатура комплексных соединений Число лигандов моно, ди, три, тетра, пента и т.д. Названия лигандов Анионные Cl–
- 29. Примеры [Cu(H2O)4]2+ катион тетрааквамеди(II) [Zn(OH)4]2– тетрагидроксоцинкат-ион [Cr(H2O)5OH]2+ катион гидроксопентааквахрома(III) K[BF4] тетрафтороборат калия
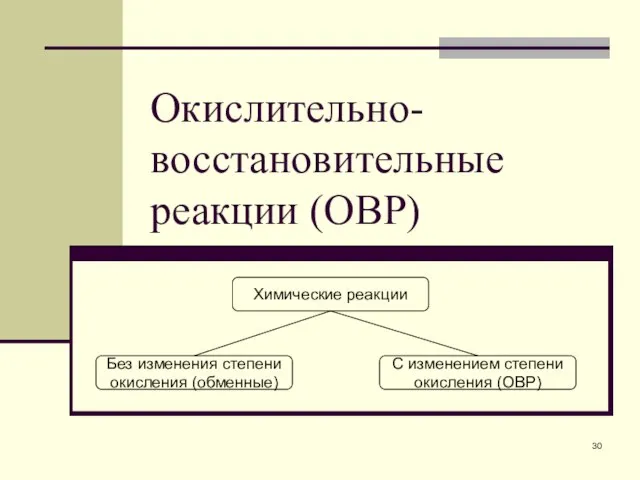
- 30. Окислительно-восстановительные реакции (ОВР)
- 31. Степень окисления формальный (условный) заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из
- 32. Степень окисления не совпадает с истинным зарядом атома в соединении H+0,17Cl–0,17 не совпадает с валентностью (числом
- 33. Изменение степени окисления = перераспределение электронной плотности ("передача электронов") HClO + H2S = HCl + S
- 34. Подбор коэффициентов в уравнениях ОВР Метод электронного баланса 1. Записывают формулы реагентов и продуктов, находят элементы,
- 35. Подбор коэффициентов в уравнениях ОВР Метод электронного баланса FeS2 + O2 → Fe2O3 + SO2 FeII
- 36. Подбор коэффициентов в уравнениях ОВР Метод электронно-ионных полуреакций 1. Записывают формулы реагентов и продуктов, находят окислитель,
- 37. Подбор числа атомов водорода и кислорода Кислотная среда [HI] = H+ [O–II] + 2H+ = H2O
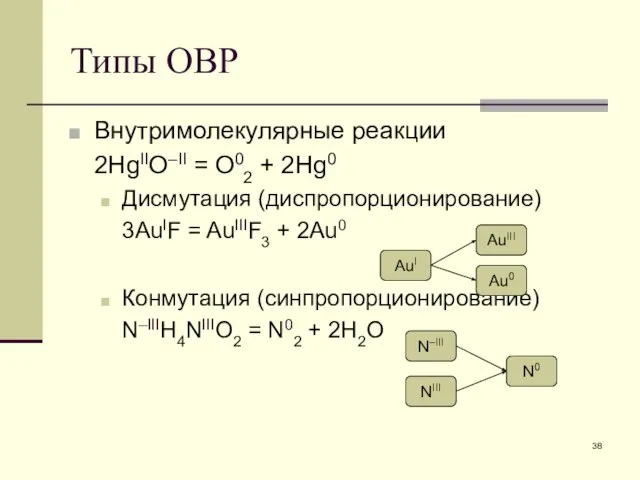
- 38. Типы ОВР Внутримолекулярные реакции 2HgIIO–II = O02 + 2Hg0 Дисмутация (диспропорционирование) 3AuIF = AuIIIF3 + 2Au0
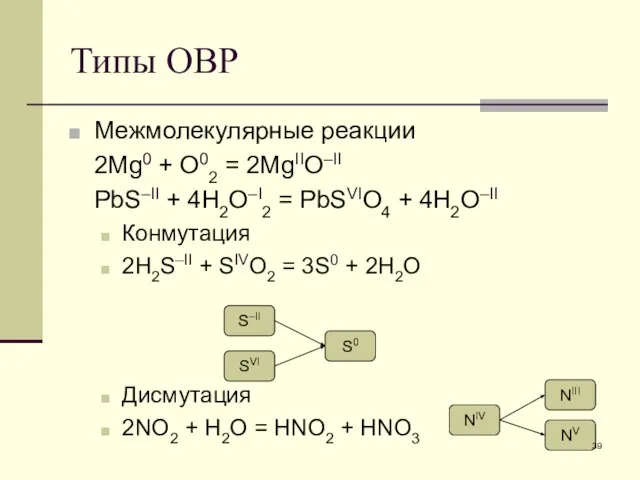
- 39. Типы ОВР Межмолекулярные реакции 2Mg0 + O02 = 2MgIIO–II PbS–II + 4H2O–I2 = PbSVIO4 + 4H2O–II
- 40. Типичные окислители и восстановители Окислители: Простые вещества – элементы с высокой электроотрицатель-ностью (F2, O2, Cl2 и
- 41. Влияние среды Продукты реакции Формы соединений Cr(VI)/Cr(III): кисл. Cr2O72–/Cr3+ щел. CrO42–/[Cr(OH)6]3– Направление реакции кисл. IO3– +
- 42. Направление ОВР Br– + PbO2 + H+ → Br2 + Pb2+ + H2O Br– + Fe3+
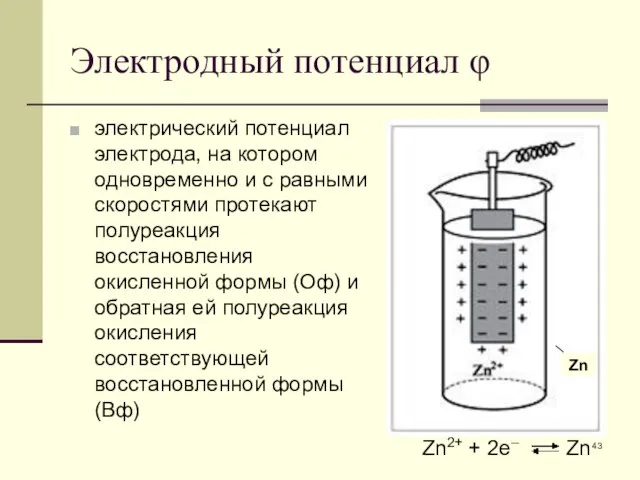
- 43. Электродный потенциал φ электрический потенциал электрода, на котором одновременно и с равными скоростями протекают полуреакция восстановления
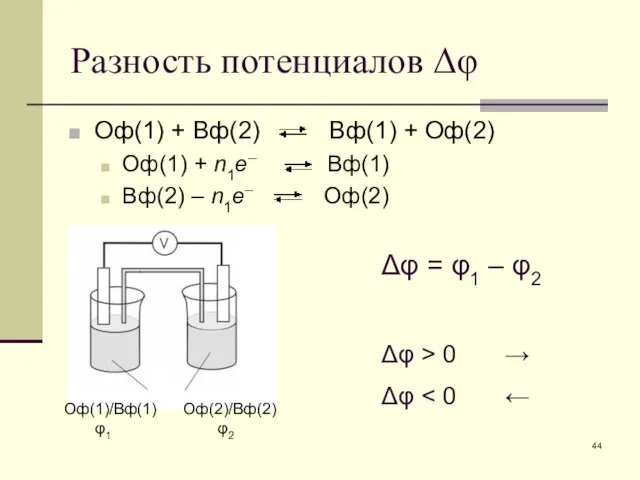
- 44. Разность потенциалов Δφ Оф(1) + Вф(2) Вф(1) + Оф(2) Оф(1) + n1e– Вф(1) Вф(2) – n1e–
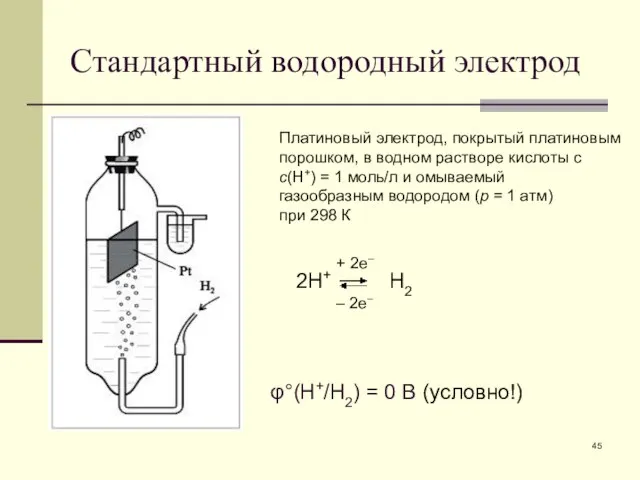
- 45. Стандартный водородный электрод Платиновый электрод, покрытый платиновым порошком, в водном растворе кислоты с с(Н+) = 1
- 46. Стандартный потенциал полуреакции восстановления φ° Оф + Н2 Вф + 2Н+ Δφ° = φ°(Оф/Вф) – φ°(Н+/Н2)
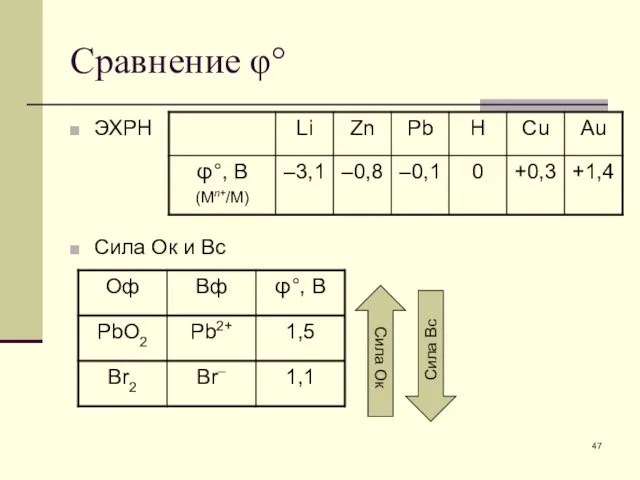
- 47. Сравнение φ° ЭХРН Сила Ок и Вс Сила Вс Сила Ок
- 48. Критерий протекания ОВР в стандартных условиях ОВР протекает в прямом направлении в стандартных условиях, если Δφ°
- 49. Уравнение Нернста На практике стандартные условия не используются Оф + ne– = Вф MnO4– + 8H+
- 50. Критерий полноты протекания ОВР ОВР протекает в прямом направлении до конца при любых начальных условиях, если
- 51. Пример Cu(т) + 2H2SO4 = CuSO4 + SO2(г) + 2H2O Δφ° = –0,179 В В стандартных
- 52. Кинетические затруднения Обычно ОВР идут быстро, но не всегда Fe3+ + NH4+ ≠ N2 + Fe2+
- 53. Пример Какие галогениды могут быть окислены катионом Fe3+ в стандартных условиях? 2Г– + 2Fe3+ = Г2
- 54. Диаграмма Латимера Fe3+ Fe Fe2+ 0,77 –0,44 1e– 2e–
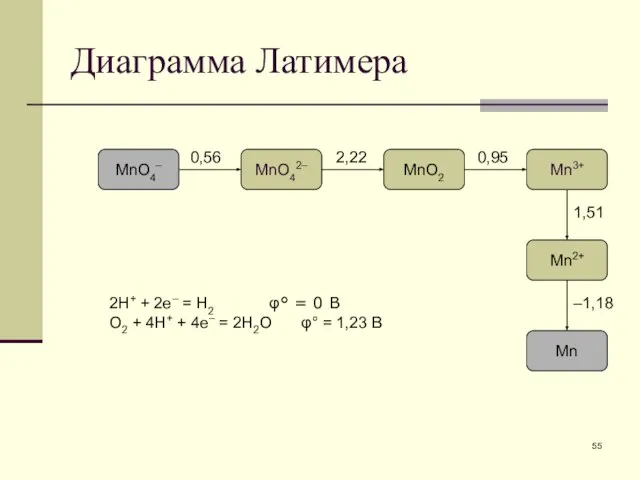
- 55. Диаграмма Латимера MnO4– MnO42– MnO2 Mn3+ Mn2+ Mn 0,56 2,22 0,95 1,51 –1,18 2H+ + 2e–
- 56. Зависимость φ° от среды Оф + hH+ + ne– = Вф + H2O IO3– + I–
- 57. Зависимость φ° от среды I2 → I- + IO3- I- + IO3- → I2
- 58. Стехиометрические расчеты по уравнению реакции n, моль M, г/моль VM, л/моль с, моль/л (М) n =
- 59. Стехиометрические расчеты по уравнению реакции
- 60. Задача Смешали 0,2 л 0,25 М водного раствора KMnO4 и 0,2 л 0,25 М водного раствора
- 61. Задача n(KMnO4) = c(KMnO4)V(p.KMnO4) n(KMnO4) = 0,25 . 0,2 = 0,05 (моль) n(KI) = c(KI)V(p.KI) neq(KI)
- 62. Стехиометрические расчеты по закону эквивалентов Эквивалент – условная (реально не существующая) частица, в z раз меньшая,
- 63. Основные соотношения Формульная единица n, моль M, г/моль VM, л/моль с, моль/л (М) Эквивалент neq =
- 64. Задача (решение по закону эквивалентов) Смешали 0,2 л 0,25 М водного раствора KMnO4 и 0,2 л
- 65. Задача (решение по закону эквивалентов) neq(KMnO4) = z(KMnO4)c(KMnO4)V(p.KMnO4) neq(KMnO4) = 3 . 0,25 . 0,2 =
- 66. Химическое равновесие Основные положения Закон действующих масс Смещение равновесия
- 67. Обратимые A + B D + E 1 – прямая реакция 2 – обратная реакция H2
- 68. Система Произвольно выбранная часть пространства, содержащая одно или несколько веществ и отделенная от окружающей среды поверхностью
- 69. Системы Гомогенные (состоят из одной фазы) Гетерогенные (состоят из двух или более фаз) Фаза – часть
- 70. Равновесное состояние Такое состояние системы, когда при постоянных внешних условиях параметры системы не изменяются во времени
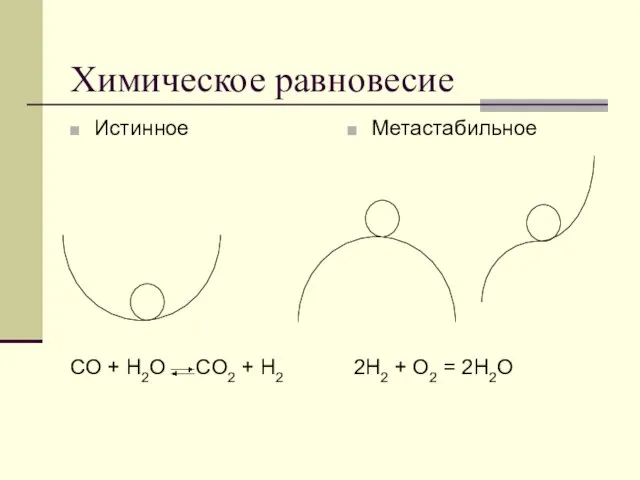
- 71. Химическое равновесие Истинное CO + H2O CO2 + H2 Метастабильное 2H2 + O2 = 2H2O
- 72. Признаки истинного химического равновесия Признаки 1. В отсутствие внешних воздействий состояние системы остается неизменным. 2. При
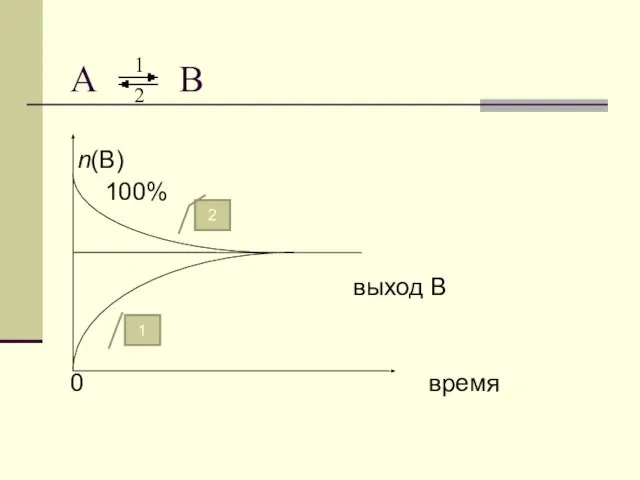
- 73. A B n(В) 100% выход В 0 время 1 2
- 74. Като Максимилиан Гульдберг и Петер Вааге (1864–1867): В условиях химического равновесия при постоянной температуре отношение произведения
- 75. Закон действующих масс (гомогенные системы) aA + bB dD + eE c(A) = [A] = const
- 76. Закон действующих масс (гетерогенные системы) aA(ж) + bB(г) dD(т) + eE(г) const n(A) – количество вещества
- 77. Константы гетерогенных равновесий BaSO4(т) Ba2+ + SO42– Kc = [Ba2+][SO42–] Hg(ж) Hg(г) Kc = [Hg] CaCO3(т)
- 78. Константа равновесия При постоянной температуре является величиной постоянной Не зависит от концентраций участников реакции Kc =
- 79. Сложные химические реакции Известны константы равновесия для реакций (I) 2 CO2 2 CO + O2; Kc(I)
- 80. Сложные химические реакции (I) 2 CO2 2 CO + O2 (II) 2 SO2 + O2 2
- 81. Задача Константа равновесия для реакции PCl5(г) PCl3(г) + Cl2(г) при некоторой температуре Kc = 0,04. Рассчитайте
- 82. Задача PCl5 PCl3 + Cl2 Концентрация, моль/л с0 1,2 0 0 Δс х х х [В]
- 83. Задача Константа равновесия для реакции 2 NO2(г) 2 NO(г) + O2(г) при некоторой температуре Kc =
- 84. Задача 2NO2 2NO + O2 Концентрация, моль/л с0 ? 0 0 Δс 2х 2х х [В]
- 85. Сдвиг химического равновесия Анри Луи Ле Шателье (1884): Любое воздействие на систему, находящуюся в состоянии химического
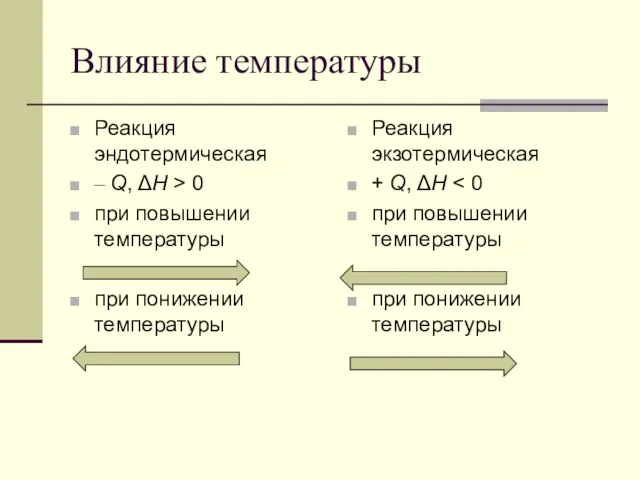
- 86. Влияние температуры Реакция эндотермическая – Q, ΔH > 0 при повышении температуры при понижении температуры Реакция
- 87. Влияние температуры CaCO3 CaO + CO2 – Q (ΔH > 0) при повышении температуры 2NO N2
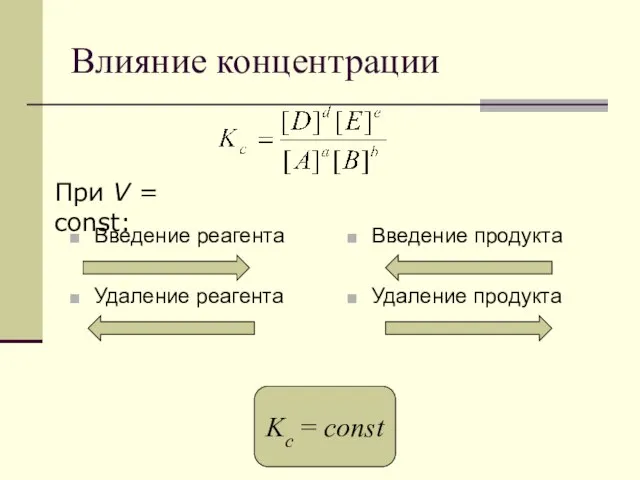
- 88. Влияние концентрации Введение реагента Удаление реагента Введение продукта Удаление продукта Kc = const При V =
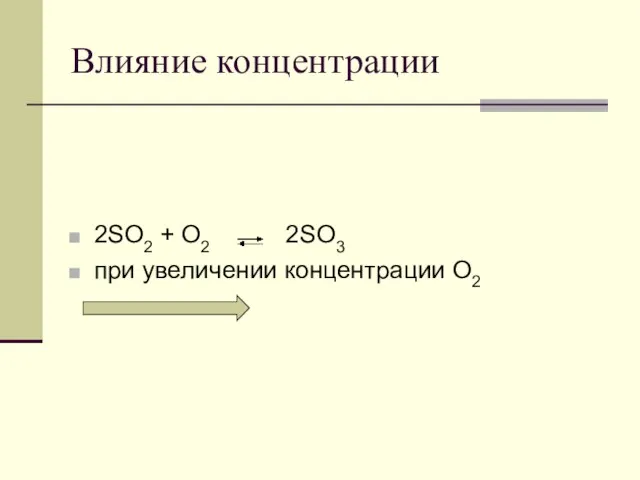
- 89. Влияние концентрации 2SO2 + O2 2SO3 при увеличении концентрации О2
- 90. Влияние давления aA + bB dD + eE если d + e = a + b
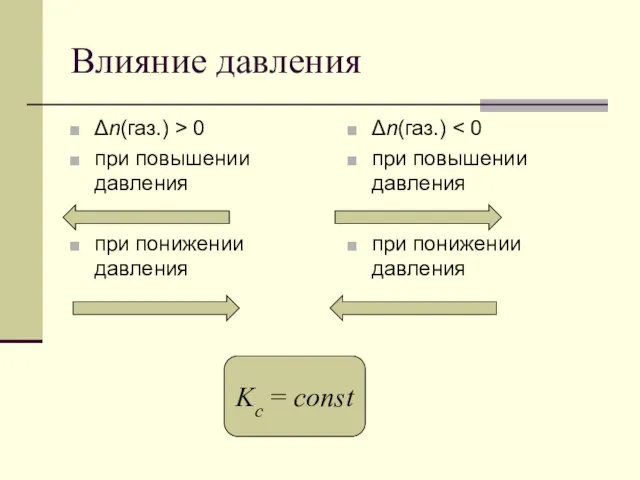
- 91. Влияние давления Δn(газ.) > 0 при повышении давления при понижении давления Δn(газ.) при повышении давления при
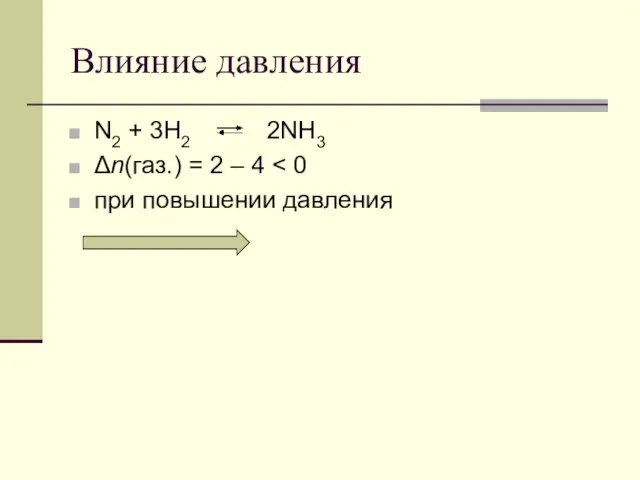
- 92. Влияние давления N2 + 3H2 2NH3 Δn(газ.) = 2 – 4 при повышении давления
- 93. Введение инертного газа при V = const концентрации постоянны не влияет при p = const объем
- 95. Скачать презентацию




















![Примеры [Cu(H2O)4]2+ катион тетрааквамеди(II) [Zn(OH)4]2– тетрагидроксоцинкат-ион [Cr(H2O)5OH]2+ катион гидроксопентааквахрома(III) K[BF4] тетрафтороборат калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537791/slide-28.jpg)






![Подбор числа атомов водорода и кислорода Кислотная среда [HI] = H+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537791/slide-36.jpg)

![Влияние среды Продукты реакции Формы соединений Cr(VI)/Cr(III): кисл. Cr2O72–/Cr3+ щел. CrO42–/[Cr(OH)6]3–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537791/slide-40.jpg)




























![Константы гетерогенных равновесий BaSO4(т) Ba2+ + SO42– Kc = [Ba2+][SO42–] Hg(ж)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537791/slide-76.jpg)











 Полімери
Полімери Презентация Химия и русский язык
Презентация Химия и русский язык Геохимические классификации химических элементов
Геохимические классификации химических элементов Гидрокаталитические процессы
Гидрокаталитические процессы Су қоймасындағы тіршілік үшін темірдің рөлі
Су қоймасындағы тіршілік үшін темірдің рөлі Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электродные системы
Электродные системы Классификация полимеров
Классификация полимеров Тепловой баланс котла
Тепловой баланс котла Броуновское движение
Броуновское движение Нуклеиновые кислоты: структура и функции
Нуклеиновые кислоты: структура и функции соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.
соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.  Нуклеиновые кислоты
Нуклеиновые кислоты Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием
Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием Химия полимерных материалов для буровых растворов. Лекция 3. Технологические жидкости для бурения скважин
Химия полимерных материалов для буровых растворов. Лекция 3. Технологические жидкости для бурения скважин Презентация по Химии "Очистка воды в домашних условиях как жизненная необходимость" - скачать смотреть
Презентация по Химии "Очистка воды в домашних условиях как жизненная необходимость" - скачать смотреть  ХИМИЯ В КОСМЕТИКЕ
ХИМИЯ В КОСМЕТИКЕ Презентация по Химии "Консерви: користь та шкода" - скачать смотреть бесплатно
Презентация по Химии "Консерви: користь та шкода" - скачать смотреть бесплатно Решение задач по химической формуле
Решение задач по химической формуле Получение азотной кислоты
Получение азотной кислоты Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Химическая кинетика и катализ
Химическая кинетика и катализ Строение атома
Строение атома Профессии связанные с химией Выполнила ученица 9 «Б»кл. МОУ СОШ №9 Ивановой Марии
Профессии связанные с химией Выполнила ученица 9 «Б»кл. МОУ СОШ №9 Ивановой Марии Поверхностно-активные вещества
Поверхностно-активные вещества