Содержание
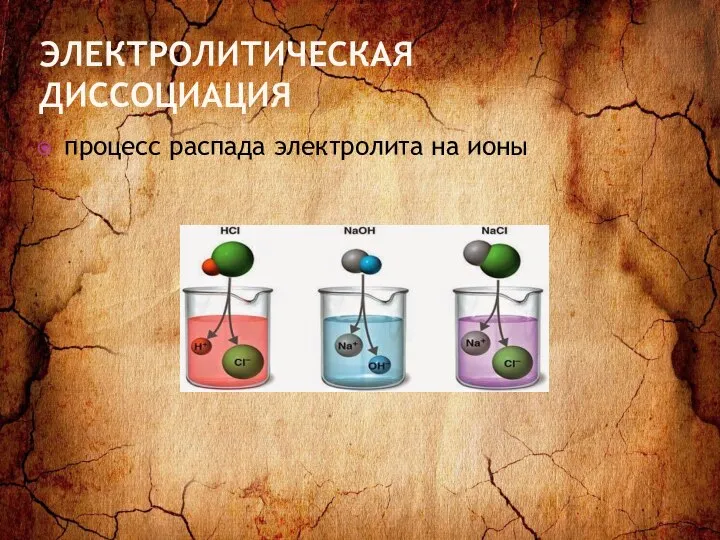
- 2. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ процесс распада электролита на ионы
- 3. Теория электролитической диссоциации ( С. Аррениус, 1887 г.) – вещества-электролиты в растворах распадаются на ионы. Вещества-электролиты,
- 4. ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ Сильные электролиты – при растворении полностью распадаются на ионы (растворимые соли, сильные кислоты,
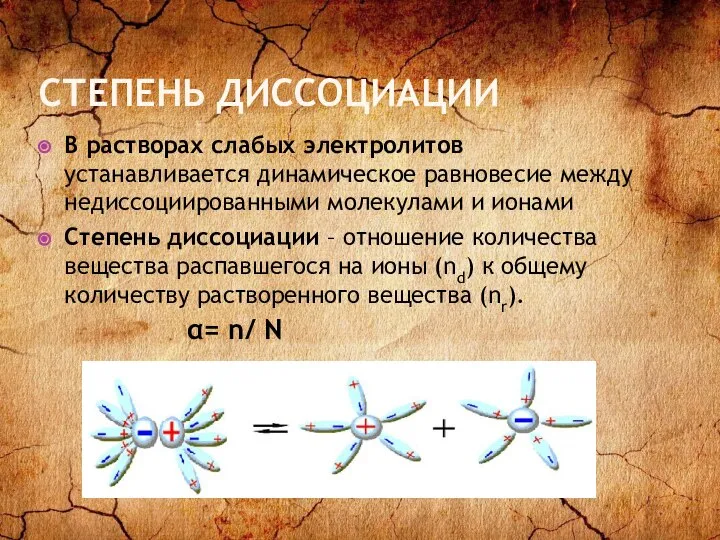
- 5. СТЕПЕНЬ ДИССОЦИАЦИИ В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами Степень диссоциации
- 6. КОНСТАНТА ДИССОЦИАЦИИ Константа диссоциации – показывает отношение концентрации ионов к концентрации недиссоциированных молекул Константа диссоциации зависит
- 7. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД Электролиты при растворении гидратируются и распадаются на ионы (катионы+ и анионы-). Под действием
- 8. ОСНОВАНИЯ В СВЕТЕ ТЭД Основаниями называются вещества, в которых атомы металла связаны с гидроксильными группами Me(ОН)n
- 9. ВИДЫ ОСНОВАНИЙ 1. Щелочи - растворимые в воде основания (гидроксиды металлов I и II групп). Кристаллические
- 10. КИСЛОТНОСТЬ ОСНОВАНИЙ Кислотность основания определяется числом гидроксильных групп (равно количеству молекул кислоты, необходимой для нейтрализации). NН4ОН
- 11. СИЛЬНЫЕ И СЛАБЫЕ ОСНОВАНИЯ
- 12. КИСЛОТЫ В СВЕТЕ ТЭД Кислота – это сложное вещество, в молекуле которого имеется один или несколько
- 13. ВИДЫ КИСЛОТ Безкислородные кислоты: HCl, HBr, HF, H2S и др. (образуют сильные неметаллы VI и VII
- 14. ОСНОВНОСТЬ КИСЛОТ Основность кислот определяется количеством ионов водорода Н+, равно количеству молекул простого основания необходимого для
- 15. СИЛЬНЫЕ И СЛАБЫЕ КИСЛОТЫ
- 16. СОЛИ В СВЕТЕ ТЭД Соли – это сложные вещества, образованные атомами металлов и кислотных остатков МеnАс.
- 17. ВИДЫ СОЛЕЙ Средние соли – все атомы кислорода замещены металлом. KCl, FeSO4, Na3PO4 Кислые соли –
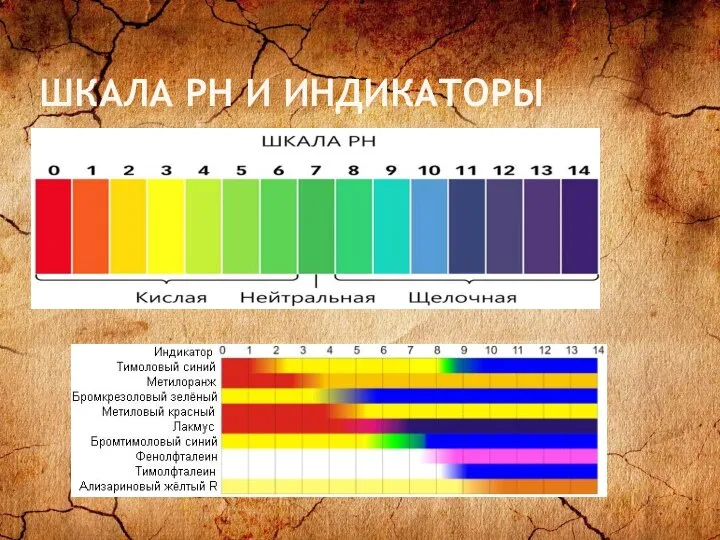
- 18. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ Водородный показатель – характеризует концентрацию свободных ионов водорода в воде или водном растворе: pH
- 19. ШКАЛА PH И ИНДИКАТОРЫ
- 21. КИСЛОТНО-ЩЕЛОЧНОЙ БАЛАНС И РН КРОВИ
- 22. Проверьте свой кислотно-щелочной баланс с помощью pH тест-полосок С помощью pH тест-полосок можно легко, быстро и
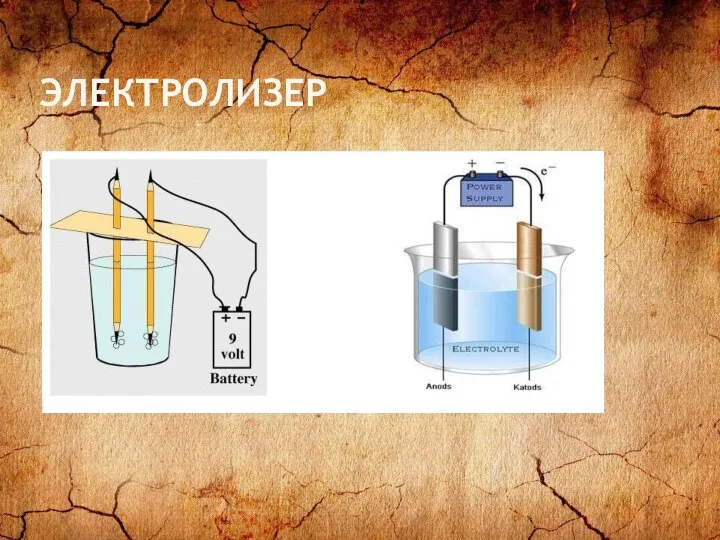
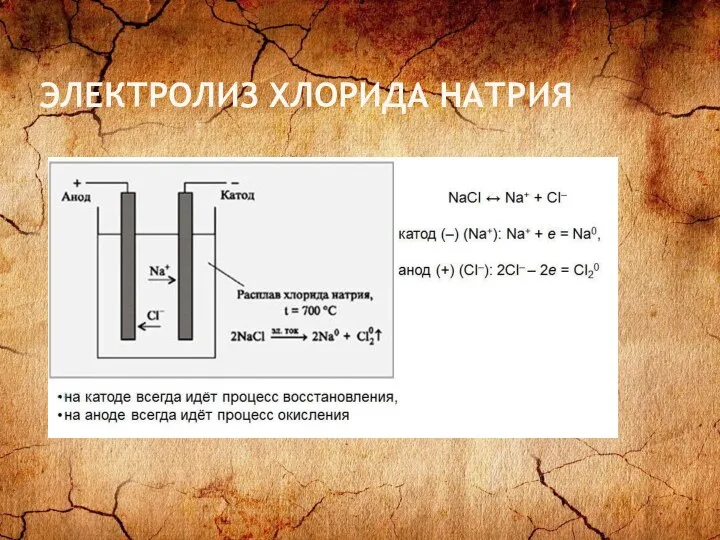
- 24. ЭЛЕКТРОЛИЗ Электролиз – окислительно-восстановительные реакции, которые протекают на электродах при прохождении электрического тока через расплав или
- 25. ЭЛЕКТРОЛИЗЕР
- 26. ЭЛЕКТРОЛИЗ ХЛОРИДА НАТРИЯ
- 27. ЭЛЕКТРОЛИЗ ВОДЫ Видеотека: Электролиз воды
- 28. ЭЛЕКТРОЛИЗ РАСТВОРА СУЛЬФАТА МЕДИ Видеотека: Электролиз сульфата меди
- 30. Скачать презентацию






















 Строение атома. Периодический закон. Периодическая система
Строение атома. Периодический закон. Периодическая система Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан
Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан Периодический закон и ПСХЭ Д.И. Менделеева
Периодический закон и ПСХЭ Д.И. Менделеева Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Органическая химия
Органическая химия Алкины
Алкины Францій БІОЛОГІЧНА РОЛЬ
Францій БІОЛОГІЧНА РОЛЬ  Биологически активные низкомолекулярные вещества
Биологически активные низкомолекулярные вещества Нефть
Нефть Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ Презентация по Химии "Металлическая химическая связь" - скачать смотреть
Презентация по Химии "Металлическая химическая связь" - скачать смотреть  Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть
Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть  Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Алкадиены. Физические свойства
Алкадиены. Физические свойства Кривые титрования. (Лекция 6)
Кривые титрования. (Лекция 6) Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц
Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц Элементы-металлы. Викторина. 9 класс
Элементы-металлы. Викторина. 9 класс Минеральные удобрения
Минеральные удобрения Химическое загрязнение почвы
Химическое загрязнение почвы Презентация по Химии "Задания на соответствие" - скачать смотреть
Презентация по Химии "Задания на соответствие" - скачать смотреть  ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Менделєєв Дмитро Іванович
Менделєєв Дмитро Іванович  Химическая связь
Химическая связь s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Химия и сельское хозяйство
Химия и сельское хозяйство