Содержание
- 2. Спирты (алканолы)– органические вещества, в молекулах которых содержится одна или несколько гидроксильных групп (-ОН) соединенных с
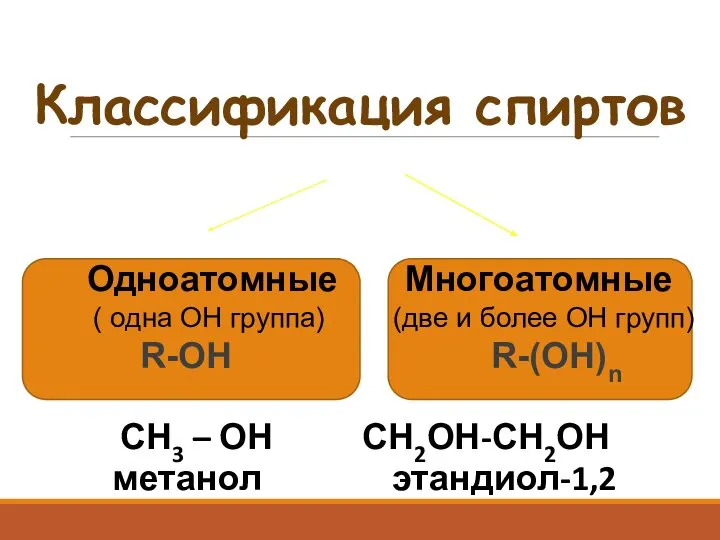
- 3. Классификация спиртов Одноатомные Многоатомные ( одна ОН группа) (две и более ОН групп) R-OH R-(OH)n СН3
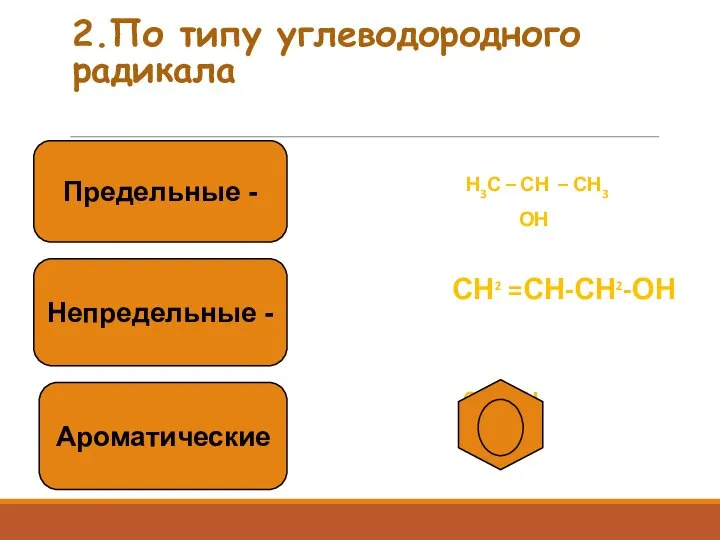
- 4. 2.По типу углеводородного радикала Н3С – СН – СН3 ОН СН2 =СН-СН2-ОН СН2-ОН Предельные - Непредельные
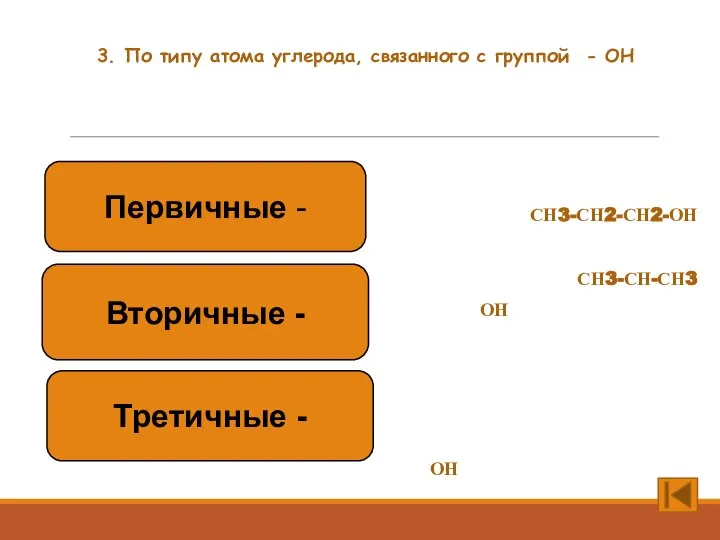
- 5. 3. По типу атома углерода, связанного с группой - ОН СН3-СН2-СН2-ОН СН3-СН-СН3 ОН СН3 СН3-С-СН3 ОН
- 6. Номенклатура и изомерия При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс –
- 7. ВИДЫ ИЗОМЕРИИ: 1. Изомерия положения функциональной группы (пропанол–1 и пропанол–2) 2.Изомерия углеродного скелета CH3-CH2-CH2-CH2-OH CH3-CH-CH2-OH CH3
- 8. Физические свойства Низшие и средние спирты (С1-C11)-летучие, бесцветные жидкости с резким, характерным алкогольным запахом, жгучим вкусом.
- 9. Способы получения Лабораторные: Гидролиз галогеналканов: R-CL+NaOH R-OH+NaCL Гидратация алкенов: CH2=CH2+H2O C2H5OH Гидрирование карбонильных соединений Промышленные: Синтез
- 10. Химические свойства 1. Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. 2СH3CH2CH2OH
- 11. Химические свойства 2. Спирты горят: 2С3H7ОH + 9O2 6СO2 + 8H2O Дегидратация CH3–CH2–OH CH2=CH2
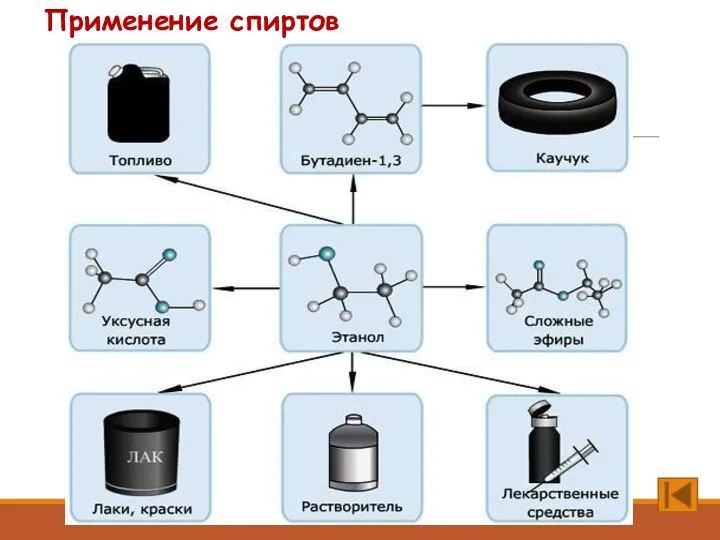
- 12. Применение спиртов
- 13. Дружить или не дружить со спиртом. Спирт относится к ксенобиотикам – веществам, не содержащимся в человеческом
- 15. Скачать презентацию








 Торий
Торий Состав, строение и свойства белков
Состав, строение и свойства белков Використання натуральних та штучних добавок при виготовленні харчових продукцій
Використання натуральних та штучних добавок при виготовленні харчових продукцій Аттестационная работа. «Образовательная программа внеурочной деятельности по химии «Занимательная химия»
Аттестационная работа. «Образовательная программа внеурочной деятельности по химии «Занимательная химия» Дыхательная функция крови
Дыхательная функция крови Типы химических реакций
Типы химических реакций Химическая лаборатория
Химическая лаборатория Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound CО2 sequestration in mining residues – probing heat effects associated to carbonation
CО2 sequestration in mining residues – probing heat effects associated to carbonation Скорость химической реакции. Порядок и молекулярность реакции. Катализ
Скорость химической реакции. Порядок и молекулярность реакции. Катализ Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В.
Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В. “TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі
“TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі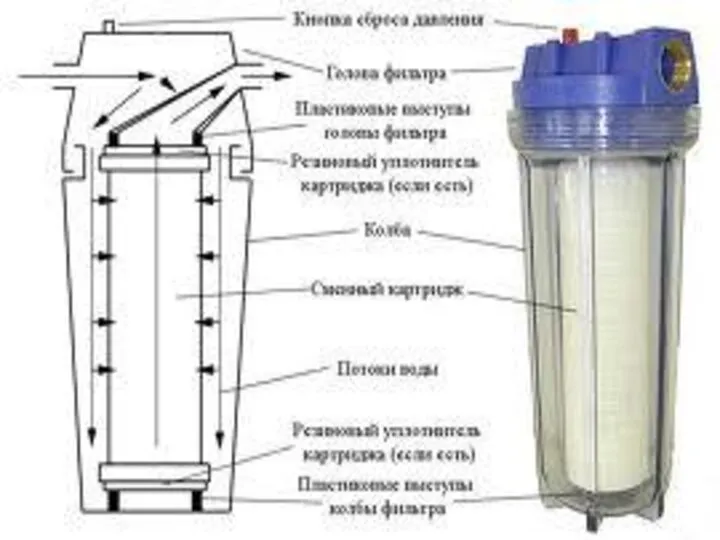 Суды тазарту әдістері
Суды тазарту әдістері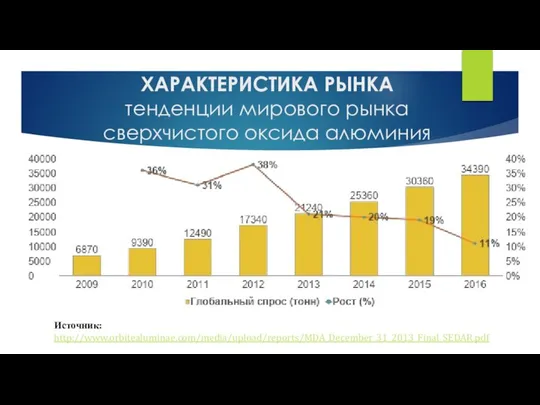 Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия
Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки
Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки Первоначальные химические понятия (обобщающий урок)
Первоначальные химические понятия (обобщающий урок) Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Презентация по Химии "Знаки химических элементов" - скачать смотреть
Презентация по Химии "Знаки химических элементов" - скачать смотреть  Основания. Гидроксид лития
Основания. Гидроксид лития Вещества преимущественно удушающего действия (пульмонотоксиканты)
Вещества преимущественно удушающего действия (пульмонотоксиканты) Презентация по Химии "Соединения кальция" - скачать смотреть
Презентация по Химии "Соединения кальция" - скачать смотреть  Водородный электрод
Водородный электрод Аммиак
Аммиак Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Відносна молекулярна маса. Масова частка елемента в складній речовині
Відносна молекулярна маса. Масова частка елемента в складній речовині Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов Темір туралы
Темір туралы Природные и синтетические красители
Природные и синтетические красители