Содержание
- 2. Сопоставление подходов для p и d P-элементы D-элементы Теория валентных связей (правило октета, Гиллеспи) Правило Сиджвика
- 3. Правило Сиджвика Комплексные соединения d-элементов в малых или отрицательных степенях окисления предпочитают лигандное окружение, обеспечивающее 18-электронное
- 4. Основные принципы Типы электронов в комплексных соединениях: Собственные электроны центральных атомов (d-металлов), не задействованные в связях
- 5. Характеристики лигандов 3) Формальный заряд – заряд лиганда в свободном состоянии 4) Мостиковость – количество атомов
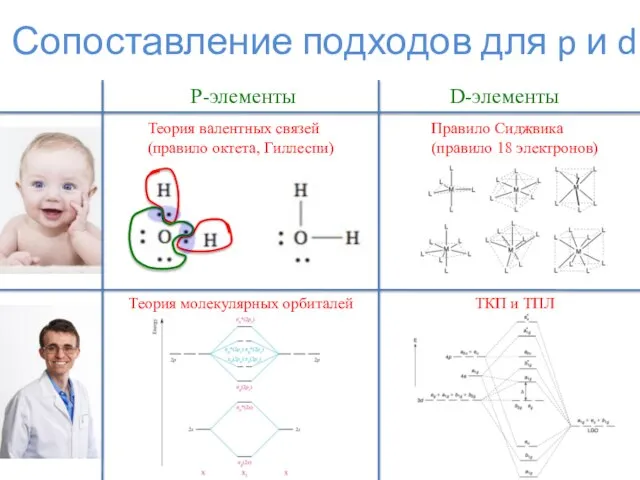
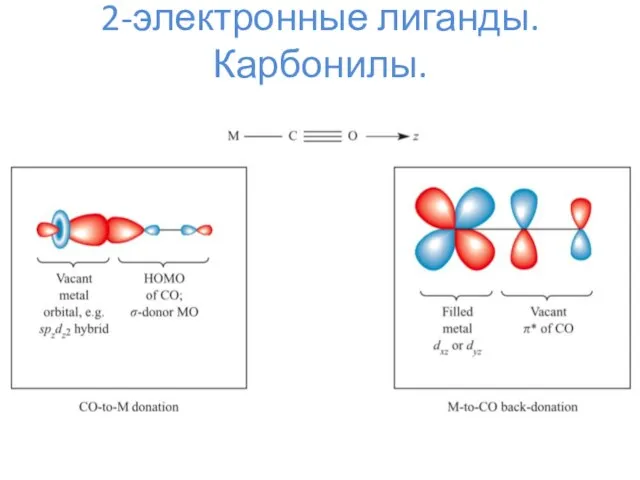
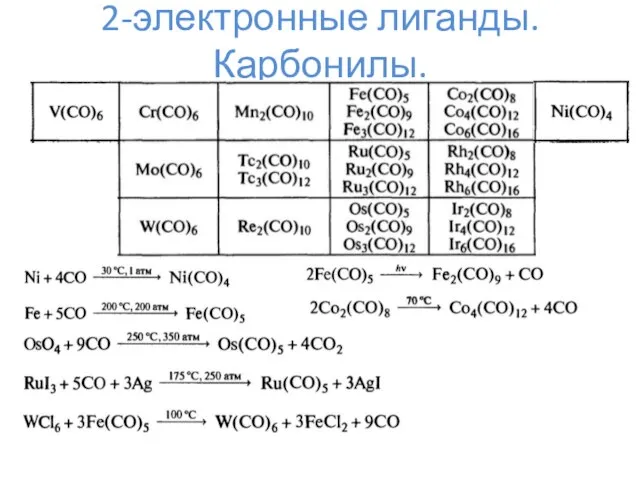
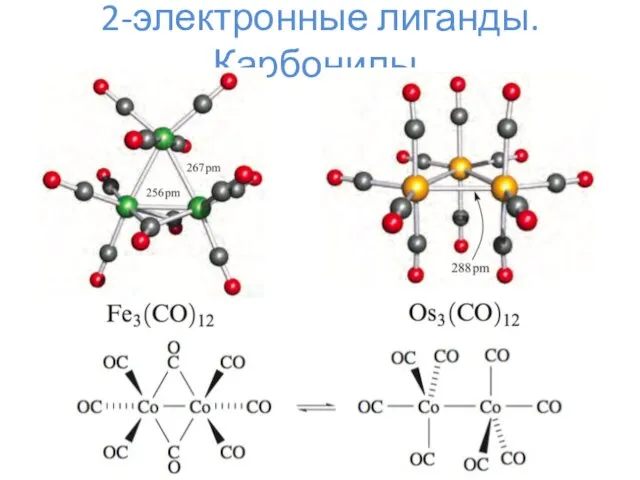
- 6. 2-электронные лиганды. Карбонилы.
- 7. 2-электронные лиганды. Карбонилы.
- 8. 2-электронные лиганды. Карбонилы. Mm(CO)n L = 2*n K = 18*m – L – N
- 9. 2-электронные лиганды. Карбонилы.
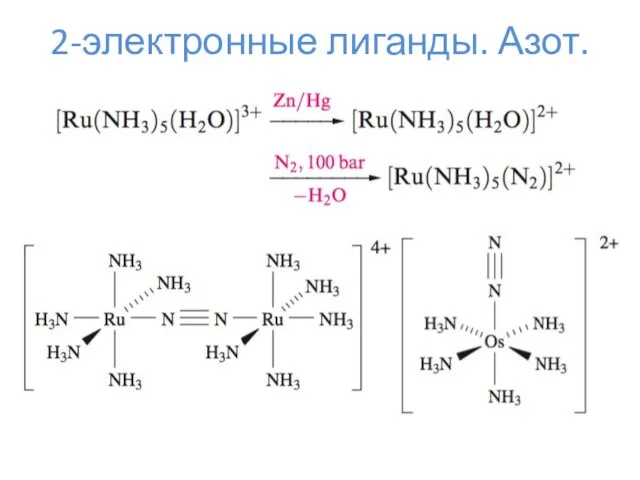
- 10. 2-электронные лиганды. Азот.
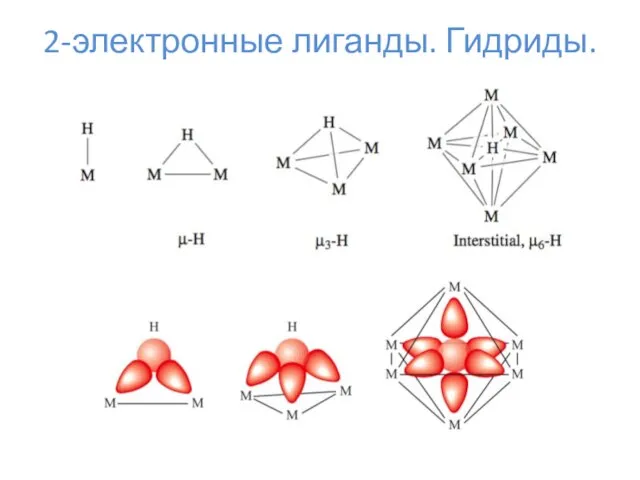
- 11. 2-электронные лиганды. Гидриды.
- 12. 2-электронные лиганды. Гидриды.
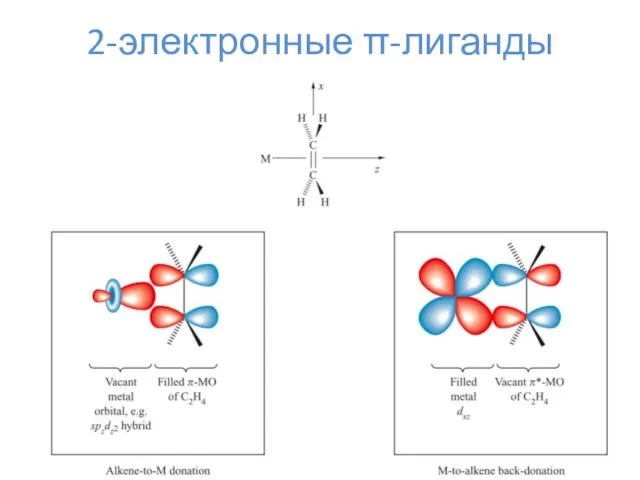
- 13. 2-электронные π-лиганды
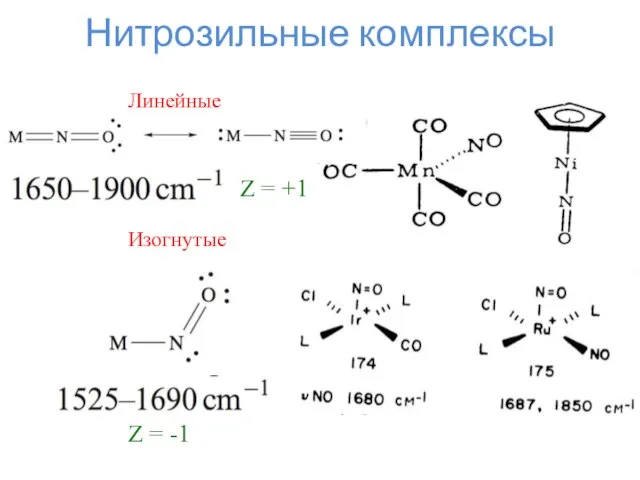
- 14. Нитрозильные комплексы Линейные Изогнутые Z = +1 Z = -1
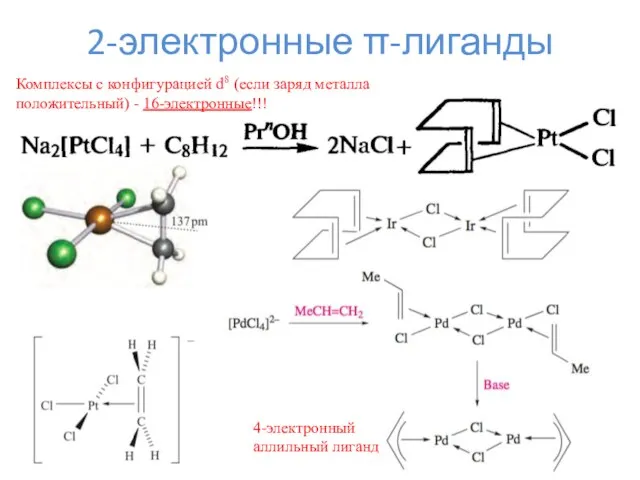
- 15. 2-электронные π-лиганды 4-электронный аллильный лиганд Комплексы с конфигурацией d8 (если заряд металла положительный) - 16-электронные!!!
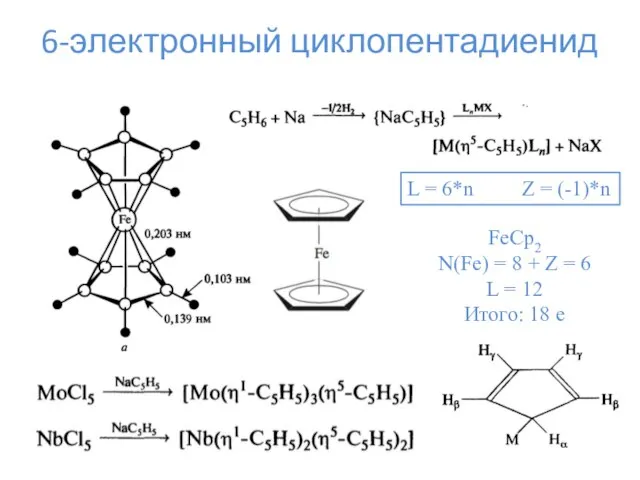
- 16. 6-электронный циклопентадиенид L = 6*n Z = (-1)*n FeCp2 N(Fe) = 8 + Z = 6
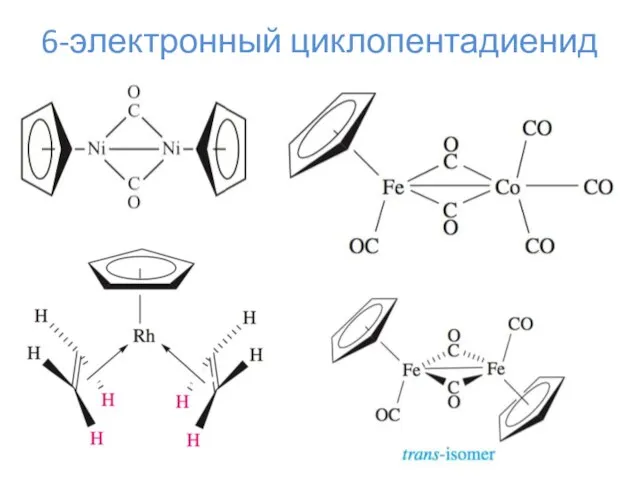
- 17. 6-электронный циклопентадиенид
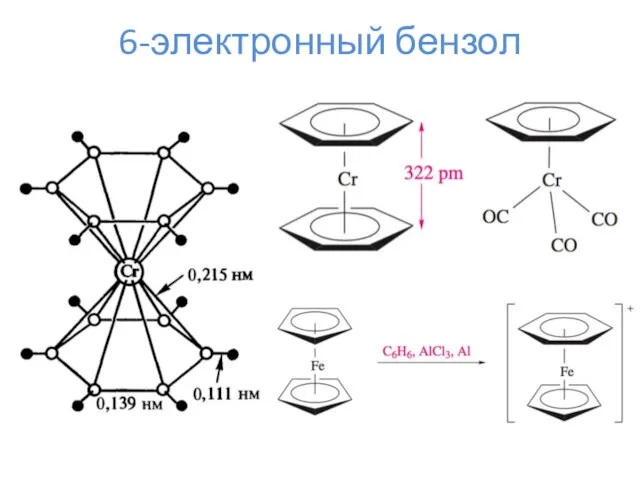
- 18. 6-электронный бензол
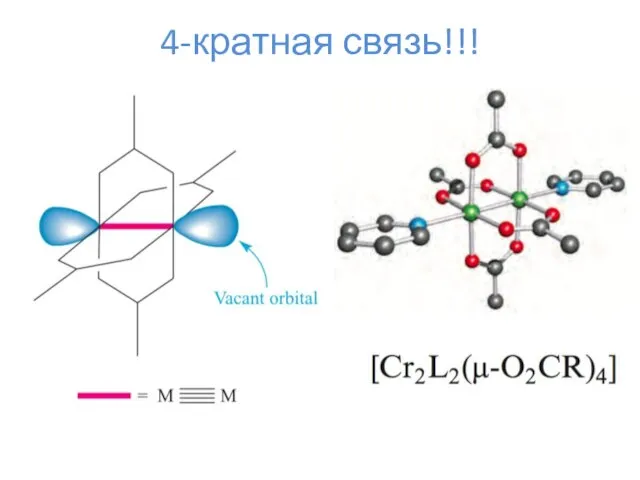
- 19. 4-кратная связь!!!
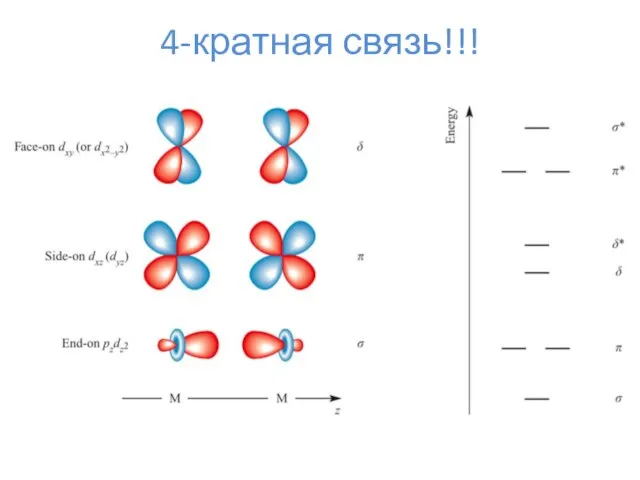
- 20. 4-кратная связь!!!
- 21. Давайте посчитаем HRe3(CO)14 Mn2(CO)7(NO)3 [H2Re4(CO)12]2- [HCr2(CO)10]- MoCp2H2 [Fe(CN)5(NO)]2- [VCp(CO)4] [Co3(CO)10]-
- 22. Позволяет предсказать магнитные свойства (число неспаренных электронов) Позволяет оценить устойчивость комплекса и его реакционноспособность Позволяет сравнить
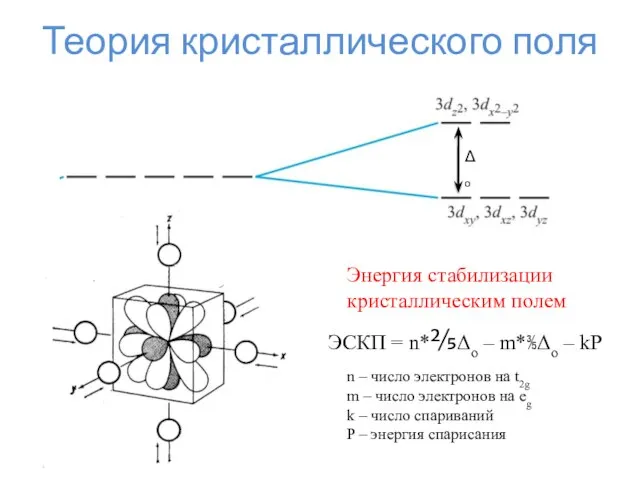
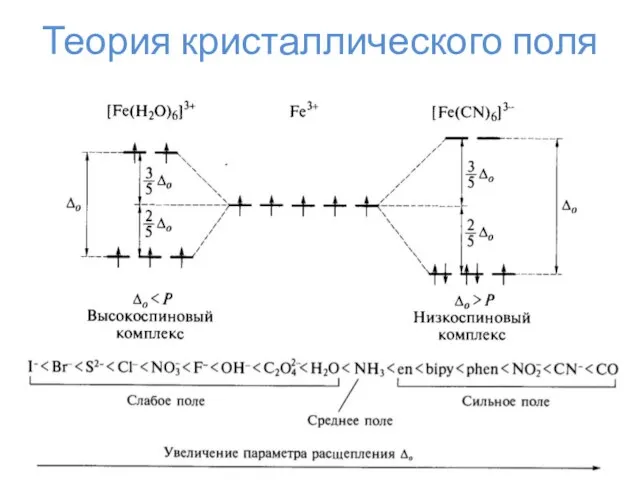
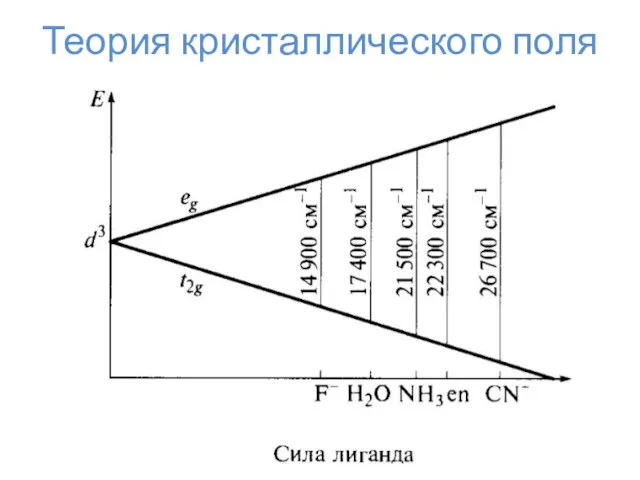
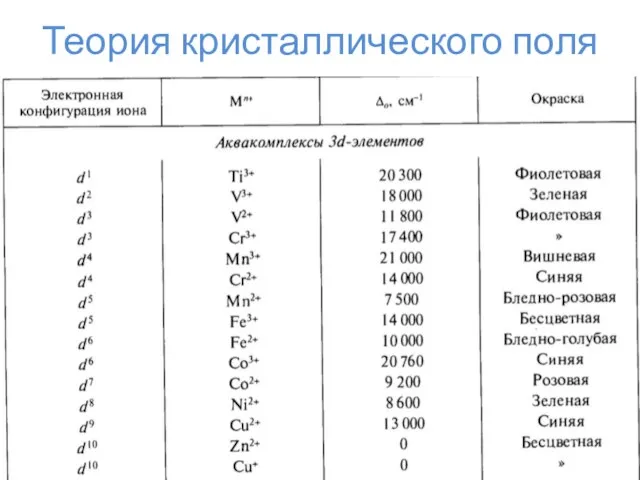
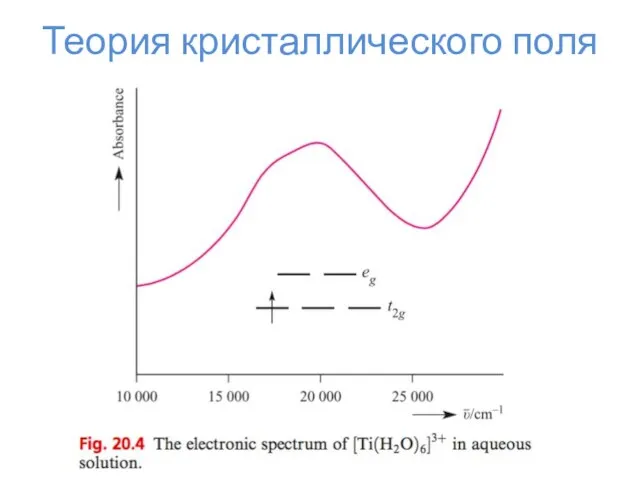
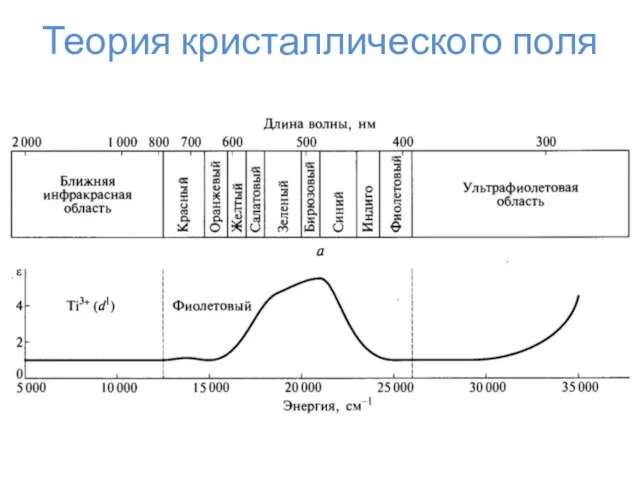
- 23. Теория кристаллического поля
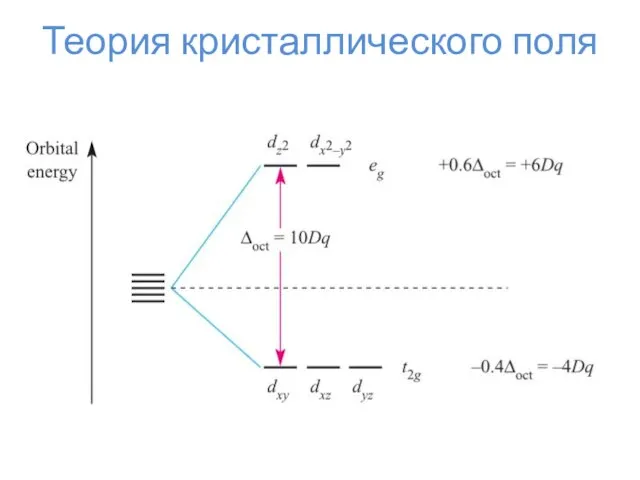
- 24. Теория кристаллического поля Δо Энергия стабилизации кристаллическим полем ЭСКП = n*⅖Δо – m*⅗Δо – kP n
- 25. Теория кристаллического поля
- 26. Теория кристаллического поля
- 27. Теория кристаллического поля
- 28. Теория кристаллического поля
- 29. Теория кристаллического поля
- 30. Теория кристаллического поля
- 31. Теория кристаллического поля
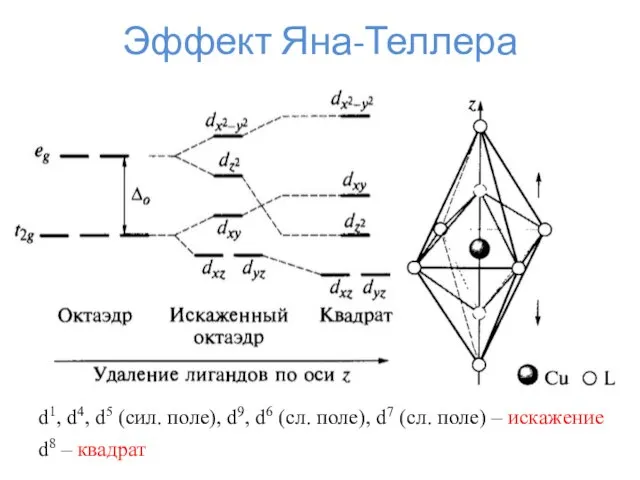
- 32. Эффект Яна-Теллера d1, d4, d5 (сил. поле), d9, d6 (сл. поле), d7 (сл. поле) – искажение
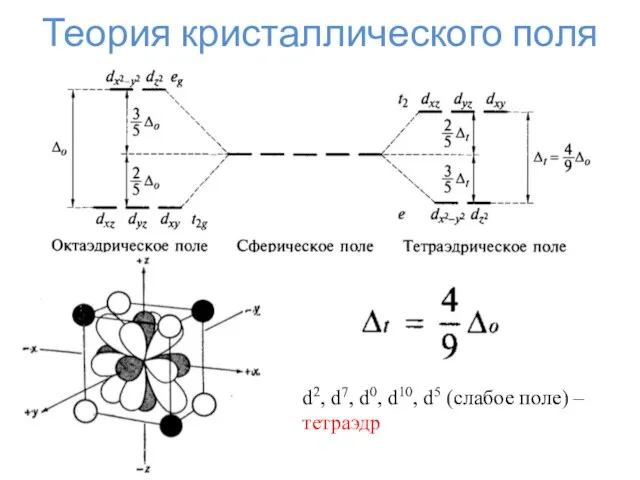
- 33. Теория кристаллического поля d2, d7, d0, d10, d5 (слабое поле) – тетраэдр
- 35. Скачать презентацию





![Давайте посчитаем HRe3(CO)14 Mn2(CO)7(NO)3 [H2Re4(CO)12]2- [HCr2(CO)10]- MoCp2H2 [Fe(CN)5(NO)]2- [VCp(CO)4] [Co3(CO)10]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/529031/slide-20.jpg)



 Презентация по Химии "Закон сохранения массы вещества" - скачать смотреть
Презентация по Химии "Закон сохранения массы вещества" - скачать смотреть  Флюорит
Флюорит Презентация по Химии "Апатит" - скачать смотреть
Презентация по Химии "Апатит" - скачать смотреть  Природный газ
Природный газ Коллоидная химия
Коллоидная химия Органические производные трехвалентного фосфора
Органические производные трехвалентного фосфора Нефть и способы её переработки
Нефть и способы её переработки Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу
Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу Общая химия, понятия
Общая химия, понятия Сульфиды. Занятие 7
Сульфиды. Занятие 7 Типы, состав, структура, свойства РНК. (Лекция 5)
Типы, состав, структура, свойства РНК. (Лекция 5) Устойчивость дисперсных систем
Устойчивость дисперсных систем Основания. Гидроксид железа (II)
Основания. Гидроксид железа (II) Щелочные металлы
Щелочные металлы Презентация по Химии "Закон збереження маси" - скачать смотреть
Презентация по Химии "Закон збереження маси" - скачать смотреть  Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет
Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет Ցեմենտի արտադրություն
Ցեմենտի արտադրություն Альдоль-кротоновая конденсация альдегидов и кетонов
Альдоль-кротоновая конденсация альдегидов и кетонов Презентация Строение Бензола
Презентация Строение Бензола Химические элементы в нашем организме. Автор: Георгиева Татьяна Григорьевна Учитель химии и экологии МОУ «Благ
Химические элементы в нашем организме. Автор: Георгиева Татьяна Григорьевна Учитель химии и экологии МОУ «Благ Получение азотной кислоты
Получение азотной кислоты Оксиди, їх склад, назви.
Оксиди, їх склад, назви.  Программа HyperChem
Программа HyperChem Органикалық химия
Органикалық химия Обобщение сведений о важнейших классах неорганических соединений
Обобщение сведений о важнейших классах неорганических соединений Мило та його склад
Мило та його склад