Содержание
- 2. Углерод и кремний являются химическими элементами IVA-группы периодической системы. Находятся во 2 и 3 периоде соответственно.
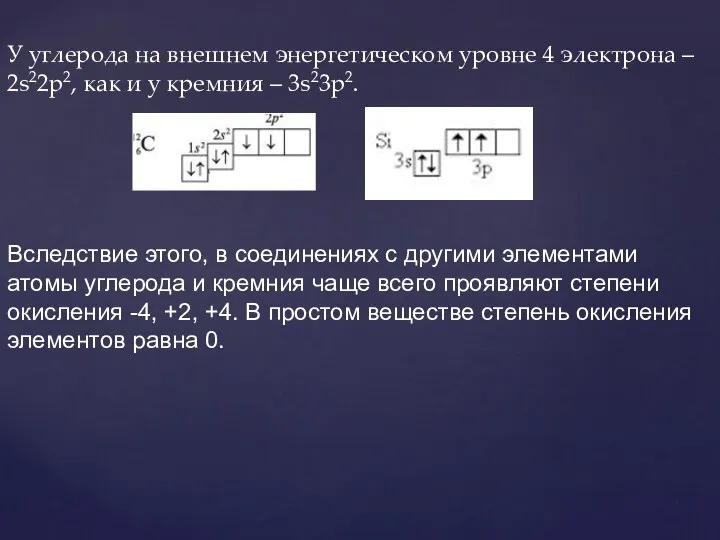
- 3. У углерода на внешнем энергетическом уровне 4 электрона – 2s22p2, как и у кремния – 3s23p2.
- 4. История открытия C В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары
- 5. Происхождение названия C В начале XIX века в русской химической литературе иногда применялся термин «углетвор» (Шерер,
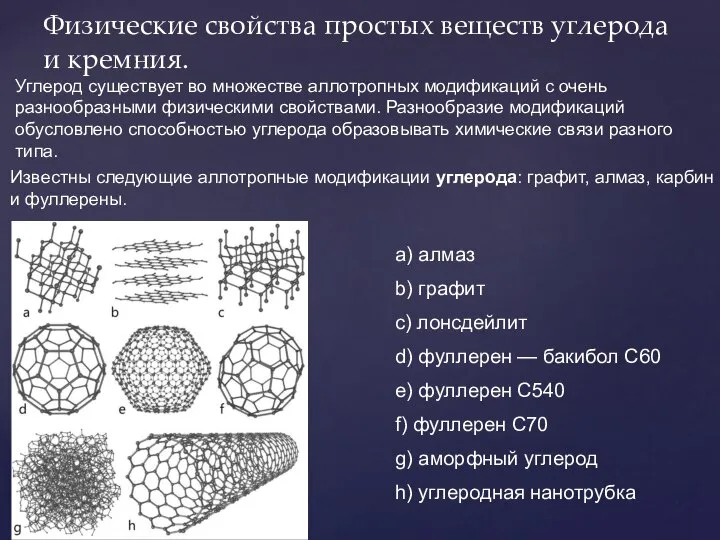
- 6. Физические свойства простых веществ углерода и кремния. Углерод существует во множестве аллотропных модификаций с очень разнообразными
- 7. Алмаз –бесцветное (иногда желтоватое, коричневатое, зеленое, черное, синее, красноватое) прозрачное вещество, очень сильно преломляющее лучи света.
- 8. Карбин –синтетическая модификация углерода. Черный мелкокристаллический порошок. Плотность 1,9–2 г/см3. Полупроводник.
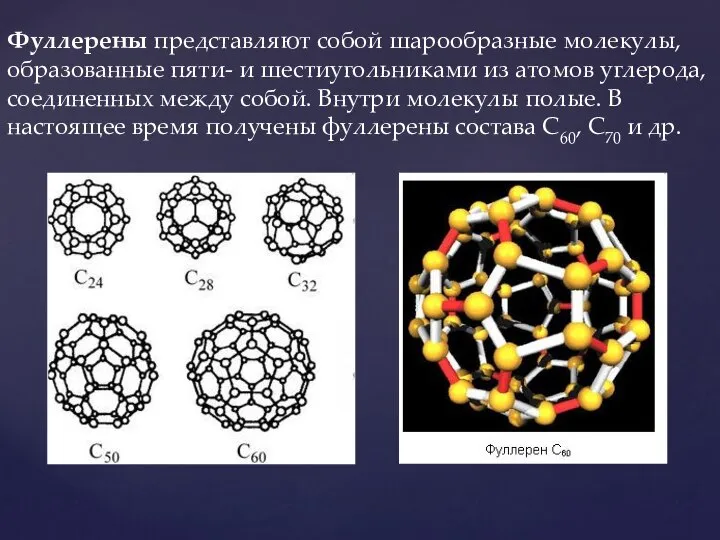
- 9. Фуллерены представляют собой шарообразные молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединенных между собой. Внутри
- 10. Кремний. Кристаллический кремний – вещество темно-серого цвета с металлическим блеском, имеет кубическую структуру алмаза, но значительно
- 11. С Взаимодействие с неметаллами С + 2S = CS2. С + О2 = СО2, С +
- 12. Si Взаимодействие с неметаллами Si + 2F2 = SiF4. Si + 2Cl2 = SiCl4. Si +
- 13. Нахождение в природе В виде углекислого газа углерод входит в состав атмосферы (0,03% по объему). Уголь,
- 14. Древесный уголь Кокс Природные неорганические соединения углерода – карбонаты. Минерал кальцит CaCO3 является основой осадочных горных
- 15. Кремний в природе Он широко распространен в виде кремнезема SiO2 и различных силикатов. Например, гранит содержит
- 16. Применение углерода Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких
- 18. Скачать презентацию












 Металлы. Физические и химические свойства
Металлы. Физические и химические свойства Кругообіг води в природі
Кругообіг води в природі  Оксид кремния
Оксид кремния Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер 10 самых смертельно опасных камней и минералов
10 самых смертельно опасных камней и минералов Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Учитель химии МОУ «Сатламышевская СОШ» Салахова Г.Ф.
Учитель химии МОУ «Сатламышевская СОШ» Салахова Г.Ф.  Хімія в житті людини
Хімія в житті людини Сырье для химической промышленности
Сырье для химической промышленности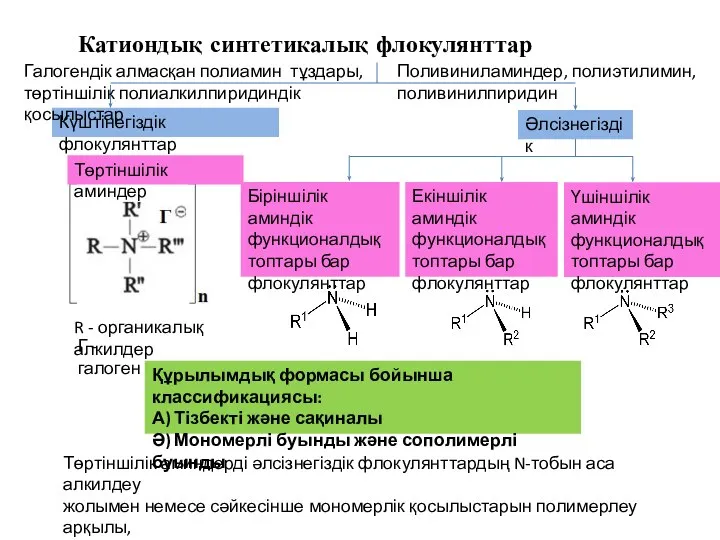 Катиондық синтетикалық флокулянттар
Катиондық синтетикалық флокулянттар Углехимическое сырьё К нему относят: торф, бурые угли, антрацит, горючие сланцы – ископаемые твердые топлива.
Углехимическое сырьё К нему относят: торф, бурые угли, антрацит, горючие сланцы – ископаемые твердые топлива.  Кислородсодержащие органические соединения. Предельные одноатомные спирты
Кислородсодержащие органические соединения. Предельные одноатомные спирты Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Применение s-, p-, d- элементов в медицине
Применение s-, p-, d- элементов в медицине Цікаві факти про хімію
Цікаві факти про хімію Алюминиевые сплавы
Алюминиевые сплавы Растворы. Способы выражения концентрации растворов
Растворы. Способы выражения концентрации растворов Презентация по химии Переработка нефти
Презентация по химии Переработка нефти Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) (
Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) ( Химическая термодинамика
Химическая термодинамика Классификация минералов. Описание физических свойств
Классификация минералов. Описание физических свойств Ауыр металдар
Ауыр металдар Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС
Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС Цветки Арники
Цветки Арники Металловедение. Теория сплавов
Металловедение. Теория сплавов Компоненты химического производства
Компоненты химического производства Энергетика химических процессов
Энергетика химических процессов Классификация полимеров 11 класс Соловова Е.А., учитель химии высшей квалификационной категории, МОУ СОШ №15 г.Балашов, 2010
Классификация полимеров 11 класс Соловова Е.А., учитель химии высшей квалификационной категории, МОУ СОШ №15 г.Балашов, 2010