Содержание
- 2. План лекции Углеводы. Классификация. Биологическая роль. Моносахариды. Стереоизомерия. Цикло-оксотаутомерия моносахаридов. Химические свойства моносахаридов. Биологическая роль. Сложные
- 3. Общая характеристика углеводов ● входят в состав клеток и тканей всех растительных и животных организмов; ●
- 4. Основные функции углеводов ● источник энергии в метаболических процессах (в растениях – крахмал, в животных организмах
- 5. Основные функции углеводов ● структурные компоненты клеточных стенок растений (целлюлоза), бактерий (мурамин), грибов (хитин); ● составные
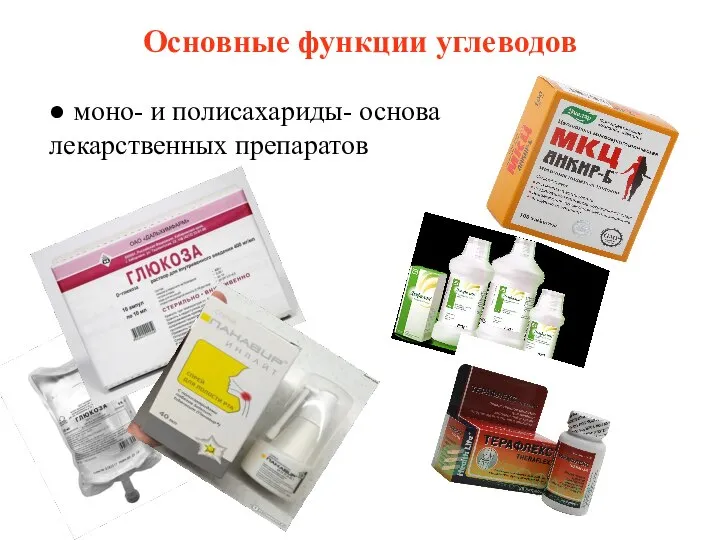
- 6. Основные функции углеводов ● моно- и полисахариды- основа лекарственных препаратов
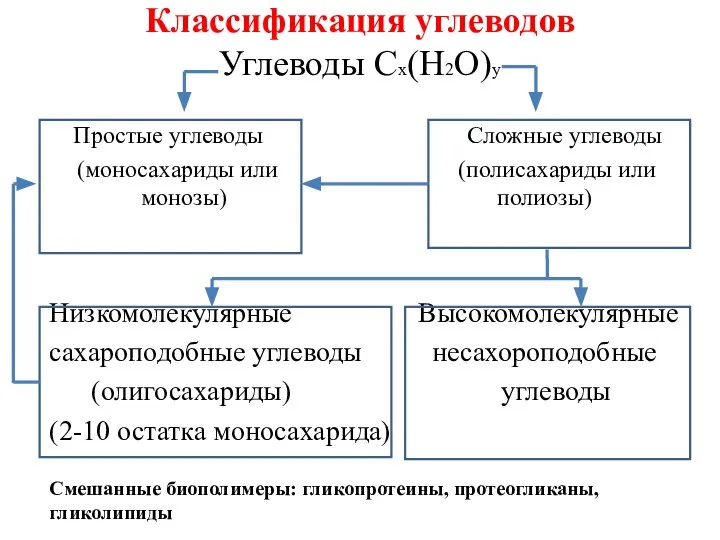
- 7. Классификация углеводов Углеводы Сх(Н2О)у Простые углеводы Сложные углеводы (моносахариды или (полисахариды или монозы) полиозы) Низкомолекулярные Высокомолекулярные
- 8. Моносахариды (монозы) CnH2nOn , где n > 3 – это полигидроксикарбонильные соединения, в которых каждый атом
- 9. Классификация моносахаридов– открытые формы: ● По числу атомов углерода в цепи (триозы С3, тетрозы С4, пентозы
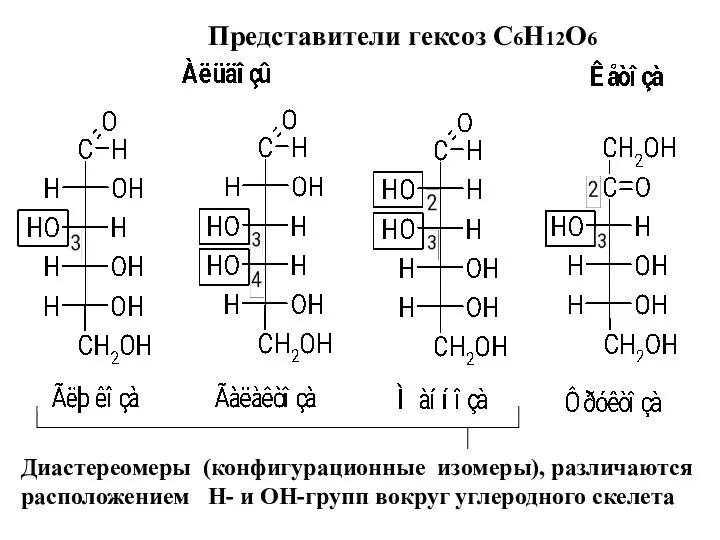
- 10. Представители гексоз С6Н12О6 Диастереомеры (конфигурационные изомеры), различаются расположением Н- и ОН-групп вокруг углеродного скелета
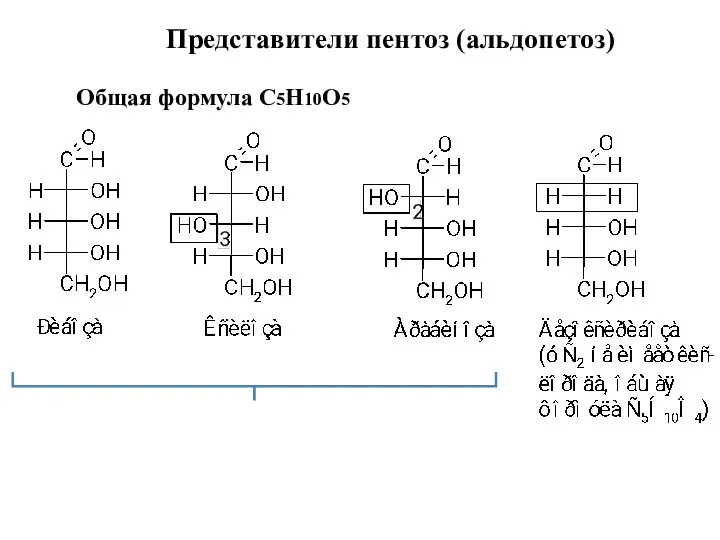
- 11. Представители пентоз (альдопетоз) Общая формула С5Н10О5
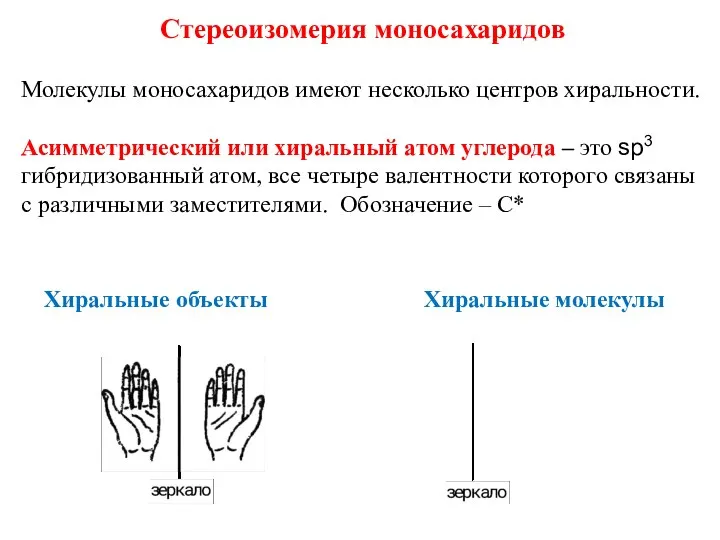
- 12. Стереоизомерия моносахаридов Молекулы моносахаридов имеют несколько центров хиральности. Асимметрический или хиральный атом углерода – это sp3
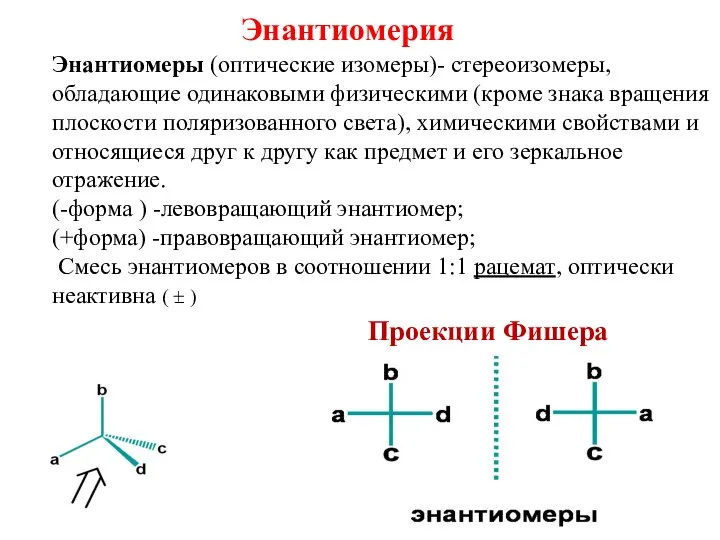
- 13. Энантиомерия Энантиомеры (оптические изомеры)- стереоизомеры, обладающие одинаковыми физическими (кроме знака вращения плоскости поляризованного света), химическими свойствами
- 14. Абсолютная и относительная конфигурация Абсолютная конфигурация — это истинное расположение в пространстве заместителей при каждом асимметрическом
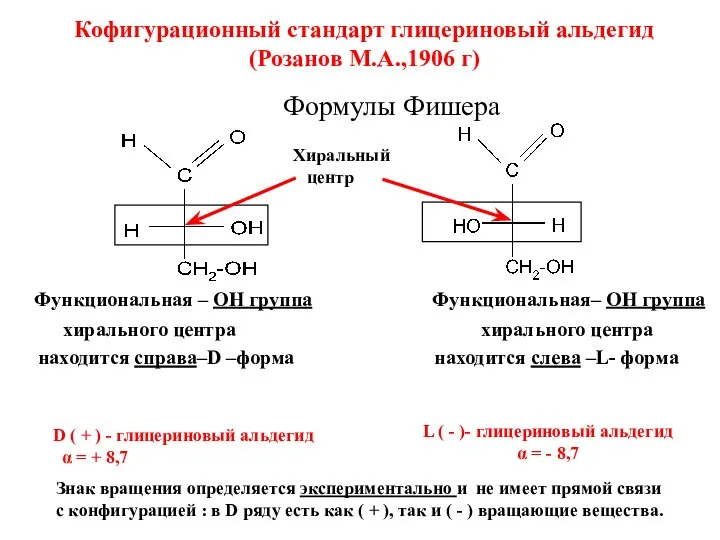
- 15. Формулы Фишера Функциональная – ОН группа Функциональная– ОН группа хирального центра хирального центра находится справа–D –форма
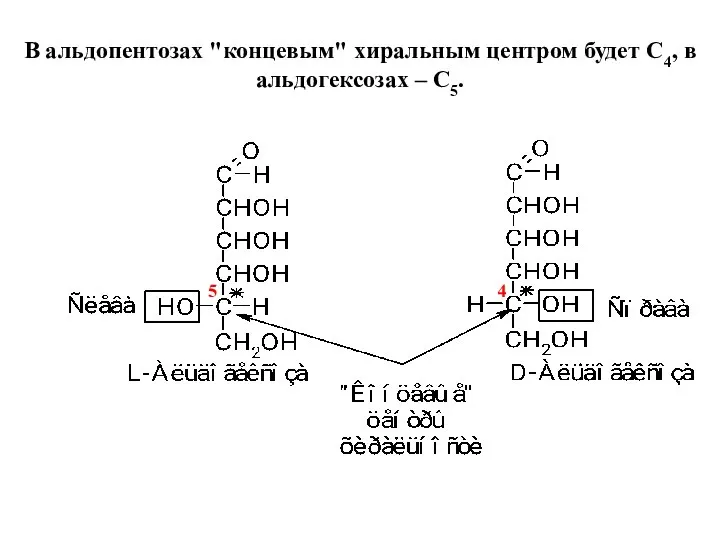
- 16. В альдопентозах "концевым" хиральным центром будет С4, в альдогексозах – С5. 4 5
- 17. Подавляющее большинство природных моносахаридов принадлежит к D-ряду. Живые организмы не "узнают" и не умеют использовать L-глюкозу.
- 18. Формула Фишера: N =2n , где где N-число стереоизомеров, n-число центров хиральности Диастереомерия углеводов Диастереоизомеры- пространственные
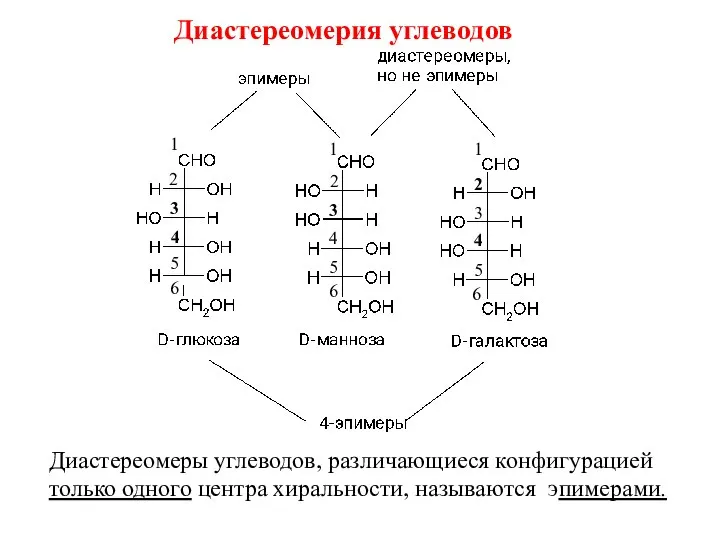
- 19. Диастереомерия углеводов Диастереомеры углеводов, различающиеся конфигурацией только одного центра хиральности, называются эпимерами. 3 3 3 4
- 20. Цикло-оксо (цикло-цепная) таутомерия и аномерные формы глюкозы Моносахариды могут существовать в циклической форме. Впервые предположение о
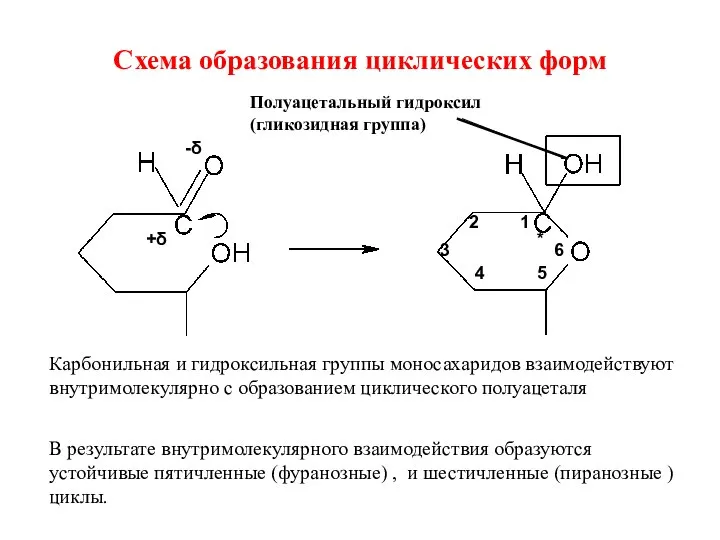
- 21. Схема образования циклических форм +δ -δ * 1 2 3 4 5 6 Полуацетальный гидроксил (гликозидная
- 22. Аномерный атом углерода. α-,β-аномеры В случае образования циклического полуацеталя возникает дополнительный центр хиральности у С1- аномерный
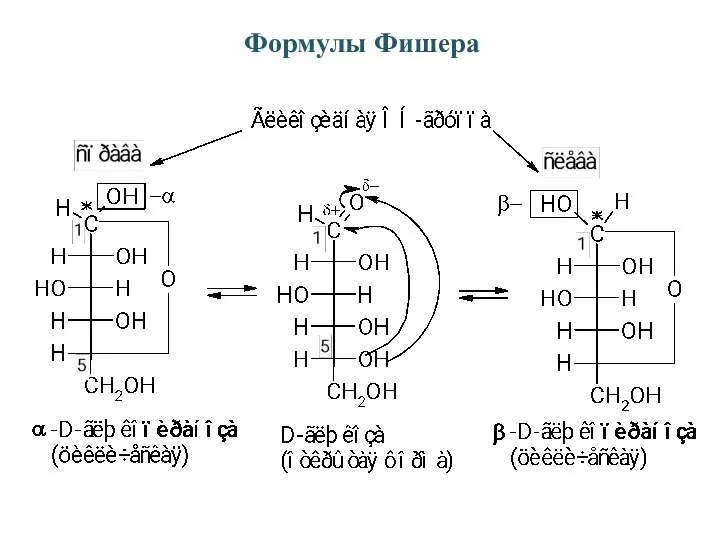
- 23. Формулы Фишера
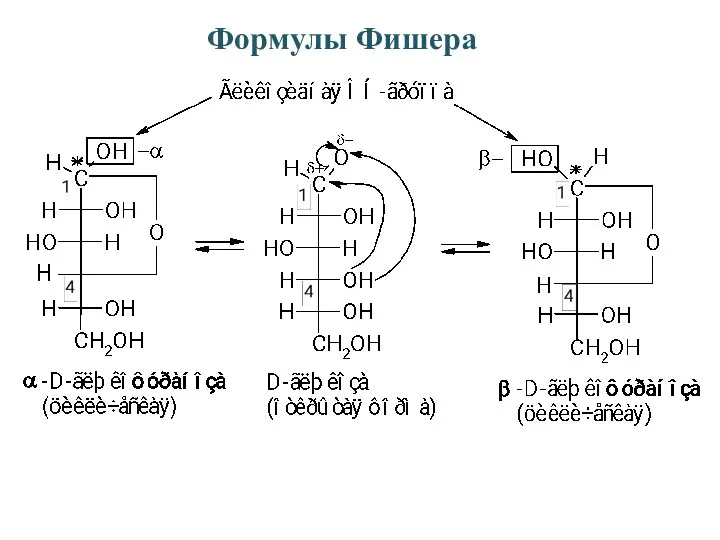
- 24. Формулы Фишера
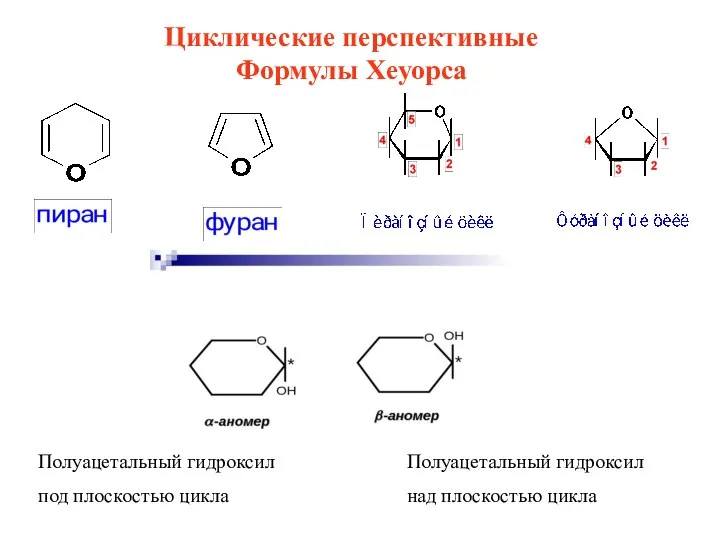
- 25. Циклические перспективные Формулы Хеуорса Полуацетальный гидроксил над плоскостью цикла Полуацетальный гидроксил под плоскостью цикла
- 26. атом кислорода располагается в дальнем правом углу (пиразнозн) и вверху по центру (фуран); заместители, находящиеся в
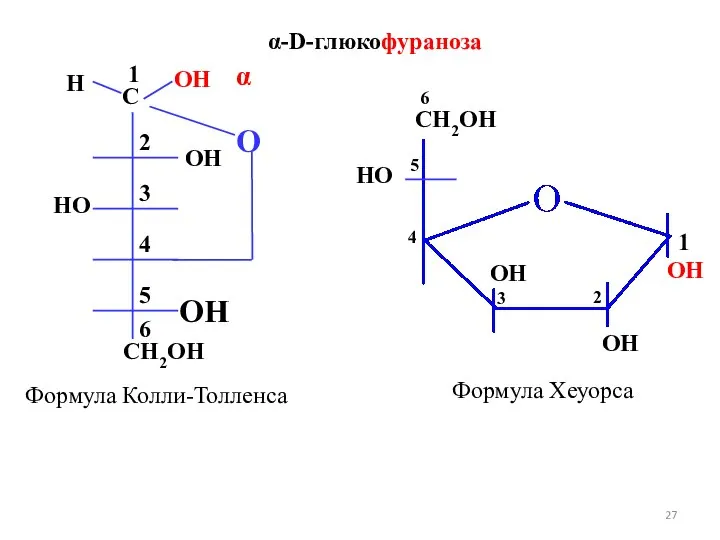
- 27. OH OH OH HO CH2OH Формула Колли-Толленса Формула Хеуорса 1 α-D-глюкофураноза 2 3 4 5 6
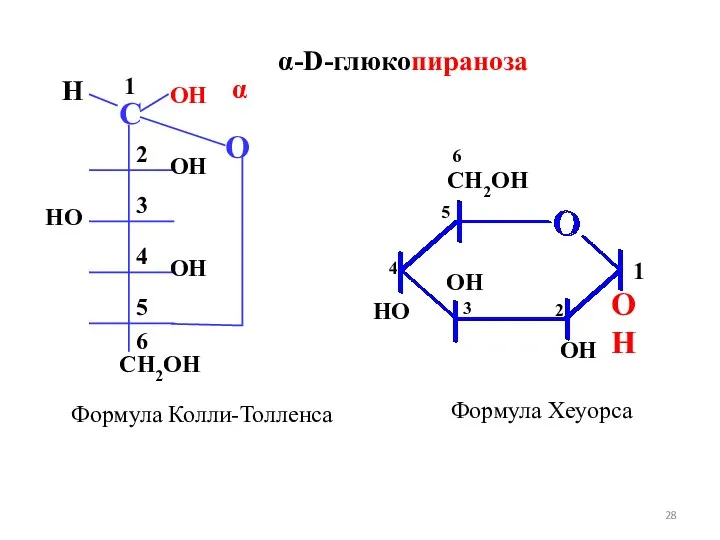
- 28. OH OH OH HO CH2OH Формула Колли-Толленса Формула Хеуорса 1 α-D-глюкопираноза 6 5 4 3 2
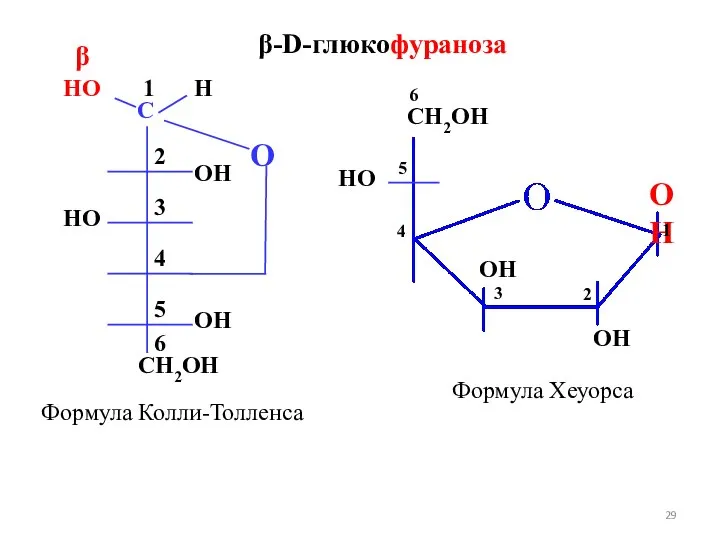
- 29. Формула Колли-Толленса Формула Хеуорса β-D-глюкофураноза 1 2 3 4 5 6
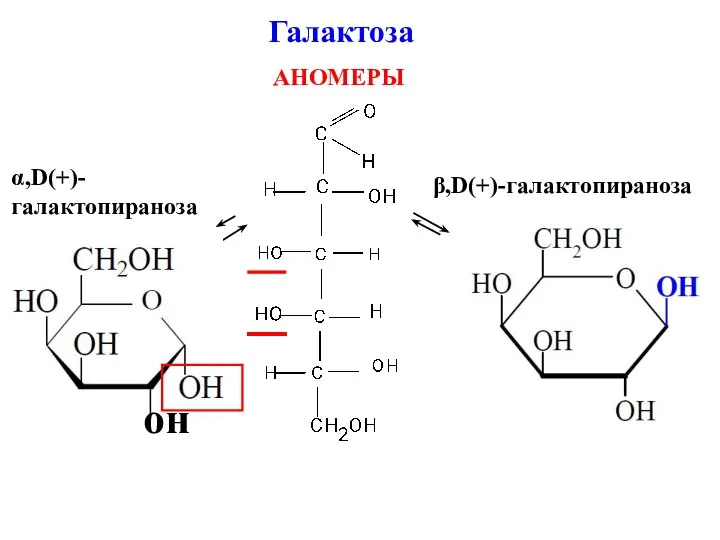
- 30. Галактоза АНОМЕРЫ он α,D(+)-галактопираноза β,D(+)-галактопираноза
- 31. Мутаротация Мутаротация – изменение удельного вращения растворов УВ во времени. При растворении моносахарид из одной циклической
- 32. Цикло-оксо-таутомерия моносахаридов Цикло-оксо-таутомерия (кольчато-цепная таутомерия)- явление существования циклических (окси-) и нециклических (оксо-) форм моносахаридов, способных свободно
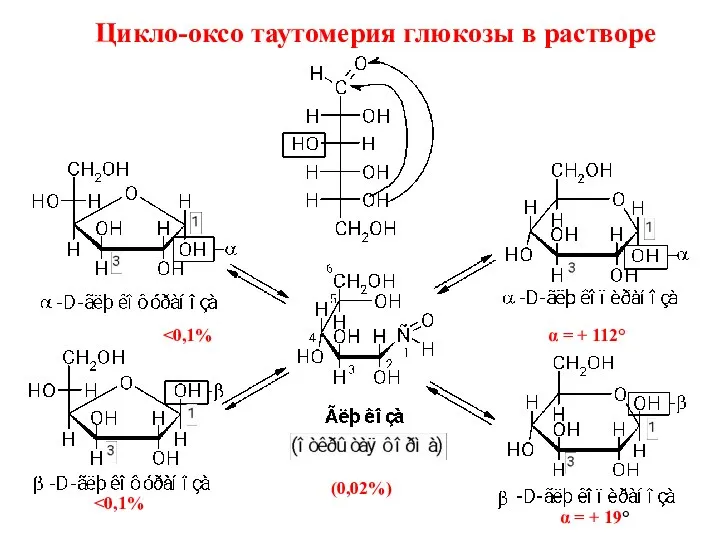
- 33. Цикло-оксо таутомерия глюкозы в растворе (0,02%) α = + 112° α = + 19°
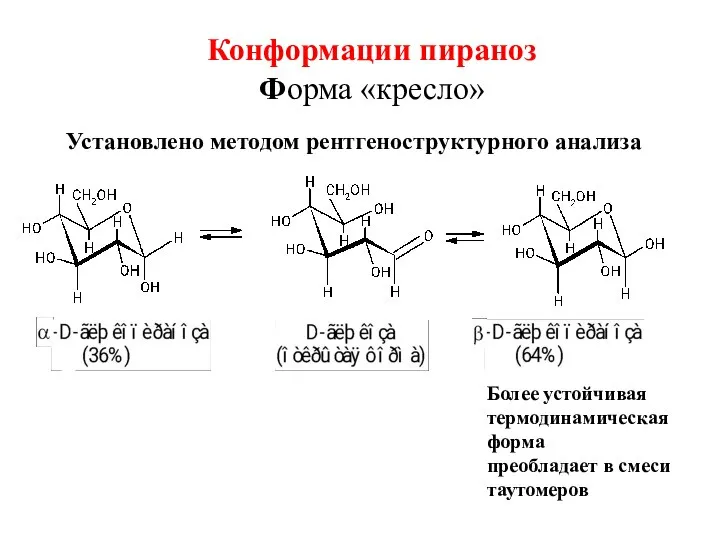
- 34. Конформации пираноз Форма «кресло» Более устойчивая термодинамическая форма преобладает в смеси таутомеров Установлено методом рентгеноструктурного анализа
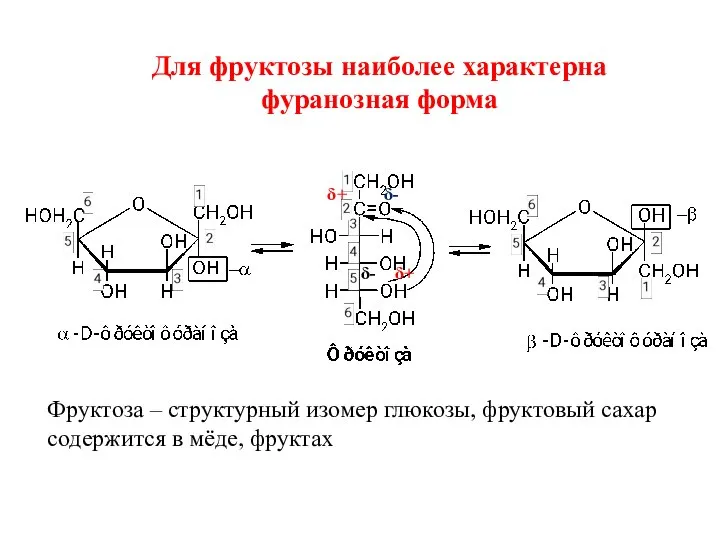
- 35. Для фруктозы наиболее характерна фуранозная форма δ- δ+ δ+ δ- Фруктоза – структурный изомер глюкозы, фруктовый
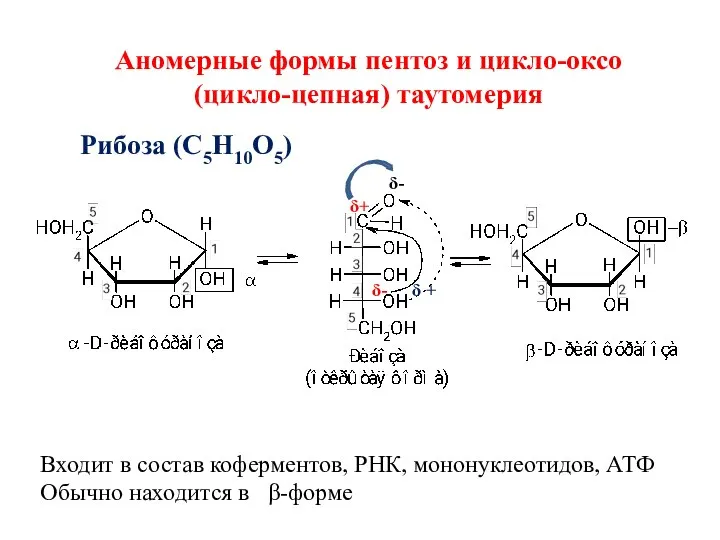
- 36. δ+ δ- δ + δ- Аномерные формы пентоз и цикло-оксо (цикло-цепная) таутомерия Рибоза (С5Н10О5) Входит в
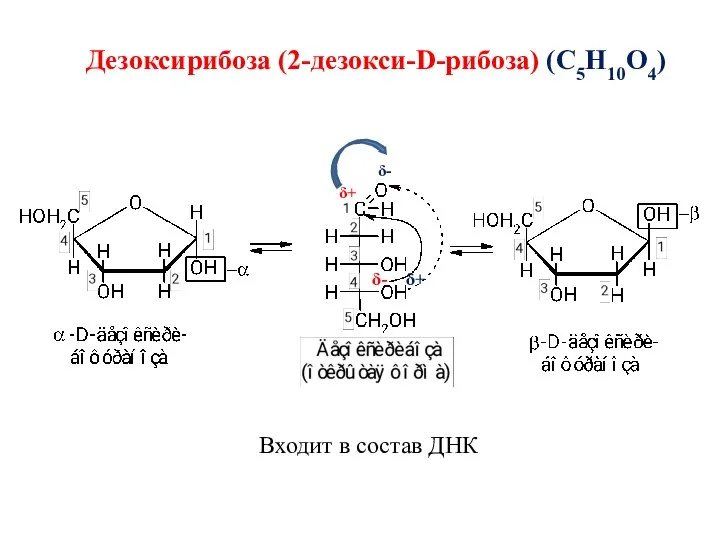
- 37. δ+ δ- Дезоксирибоза (2-дезокси-D-рибоза) (С5Н10О4) Входит в состав ДНК δ- δ+
- 38. Химические свойства моносахаридов Общие : ( > C = O , - OH ) а) на
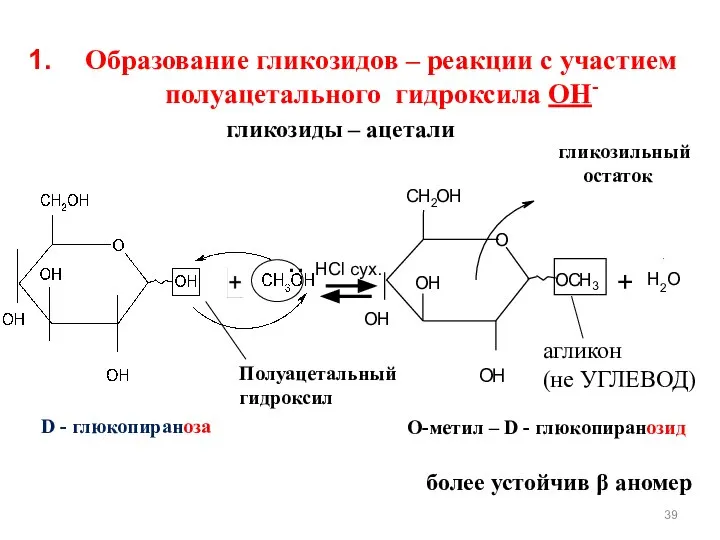
- 39. Образование гликозидов – реакции с участием полуацетального гидроксила ОН- гликозиды – ацетали Полуацетальный гидроксил D -
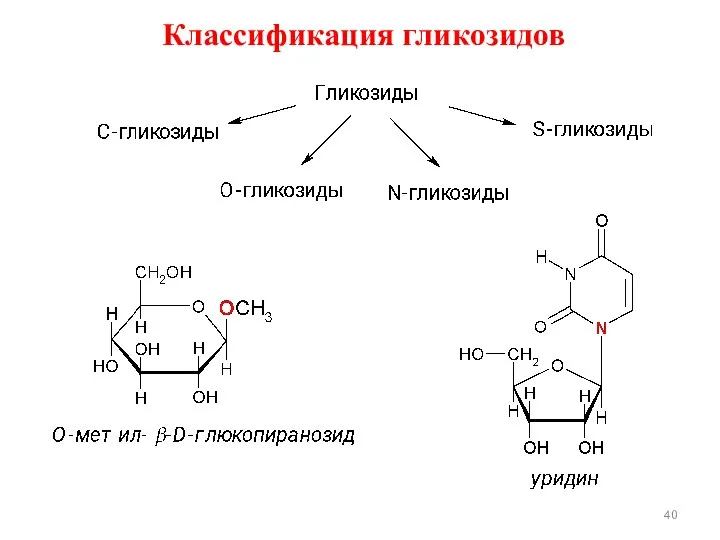
- 40. Классификация гликозидов
- 41. О - гликозиды: Витамины К, Р некоторые лекарственные препараты (стрептомицин), антибиотики, сердечные гликозиды. извлекаемые из ландыша
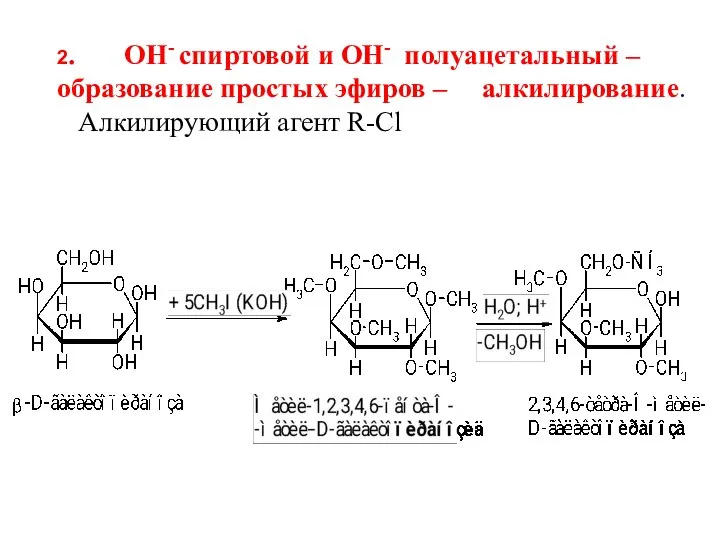
- 42. 2. ОН- спиртовой и ОН- полуацетальный – образование простых эфиров – алкилирование. Алкилирующий агент R-Cl
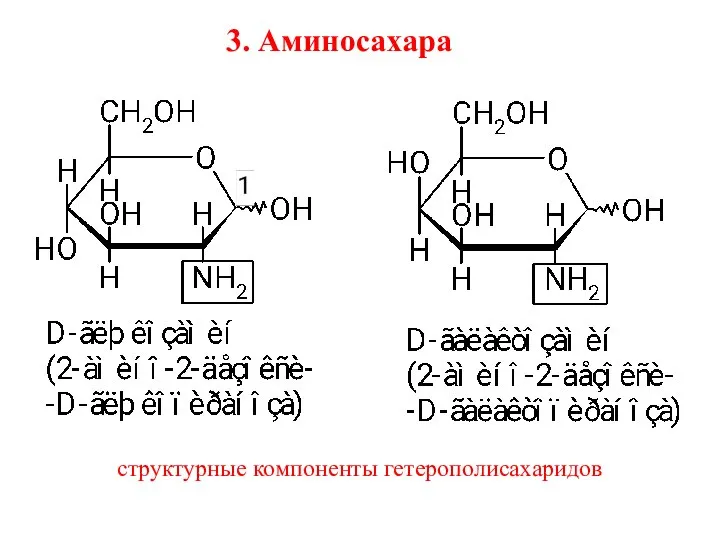
- 43. 3. Аминосахара структурные компоненты гетерополисахаридов
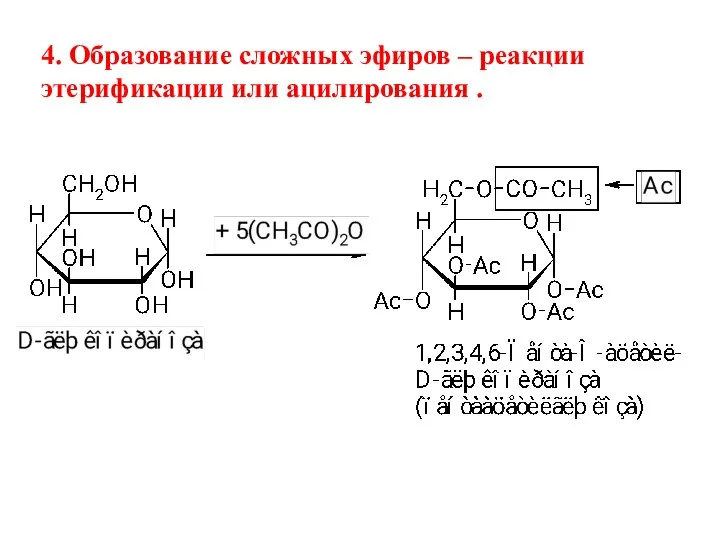
- 44. 4. Образование сложных эфиров – реакции этерификации или ацилирования .
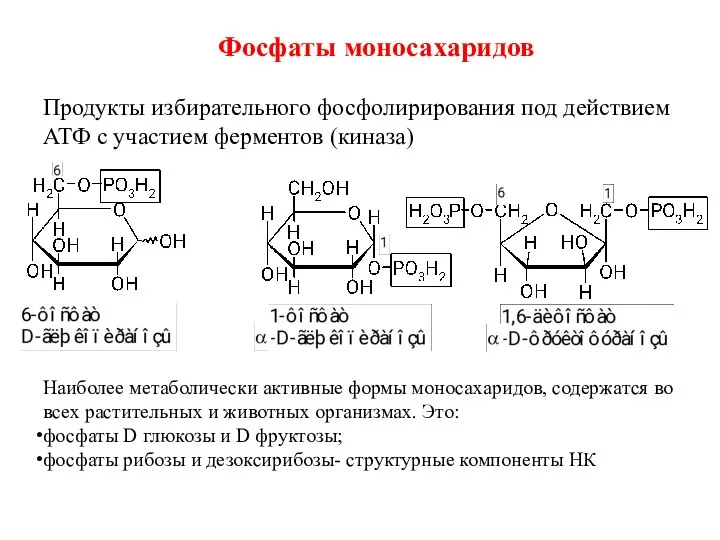
- 45. Фосфаты моносахаридов Продукты избирательного фосфолирирования под действием АТФ с участием ферментов (киназа) Наиболее метаболически активные формы
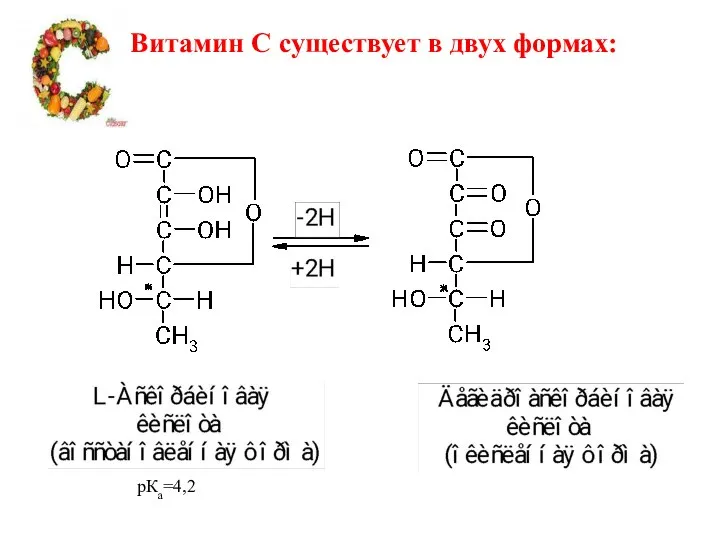
- 46. Витамин С существует в двух формах: рКа=4,2
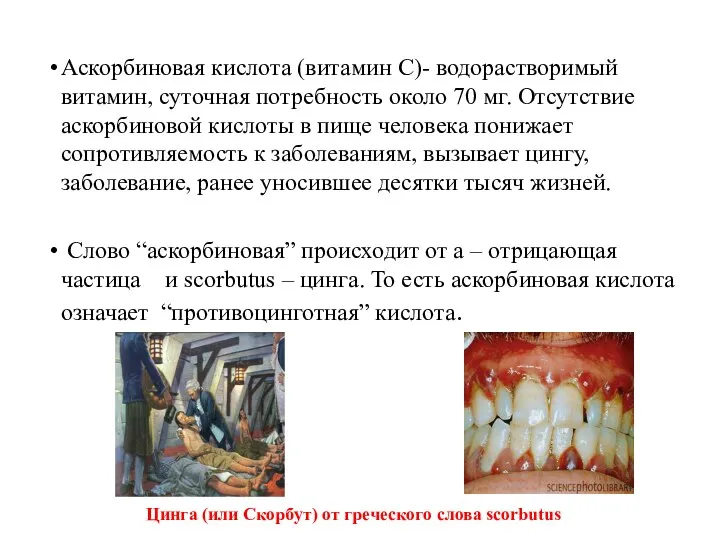
- 47. Аскорбиновая кислота (витамин С)- водорастворимый витамин, суточная потребность около 70 мг. Отсутствие аскорбиновой кислоты в пище
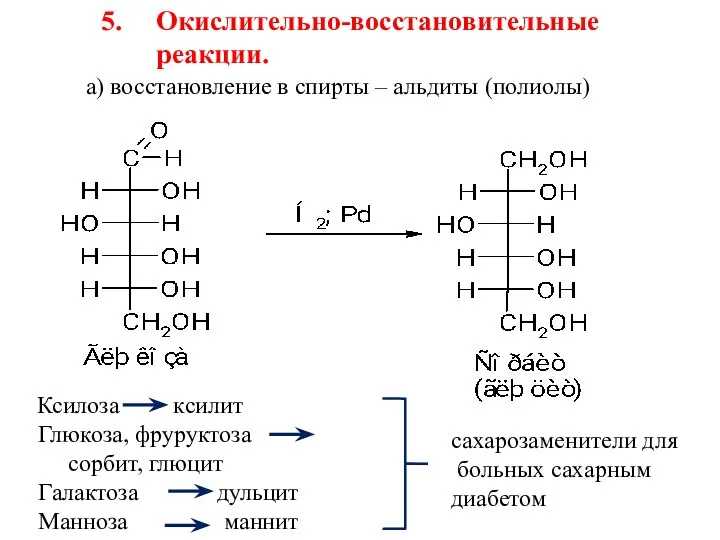
- 48. а) восстановление в спирты – альдиты (полиолы) Ксилоза ксилит Глюкоза, фруруктоза сорбит, глюцит Галактоза дульцит Манноза
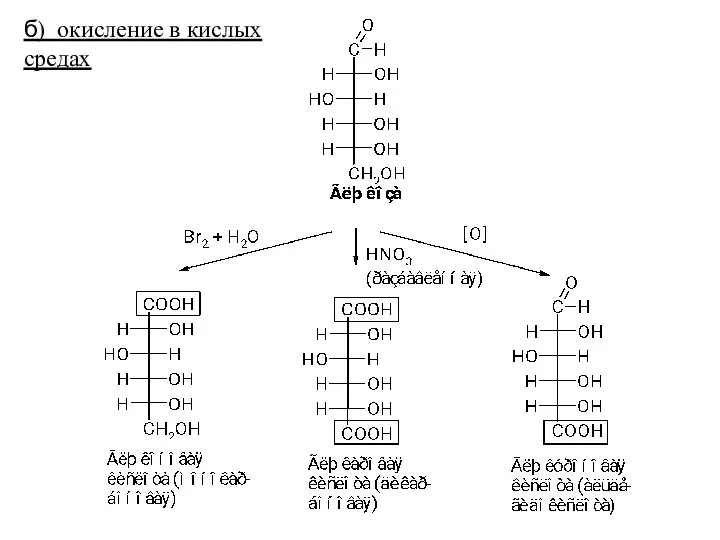
- 49. б) окисление в кислых средах
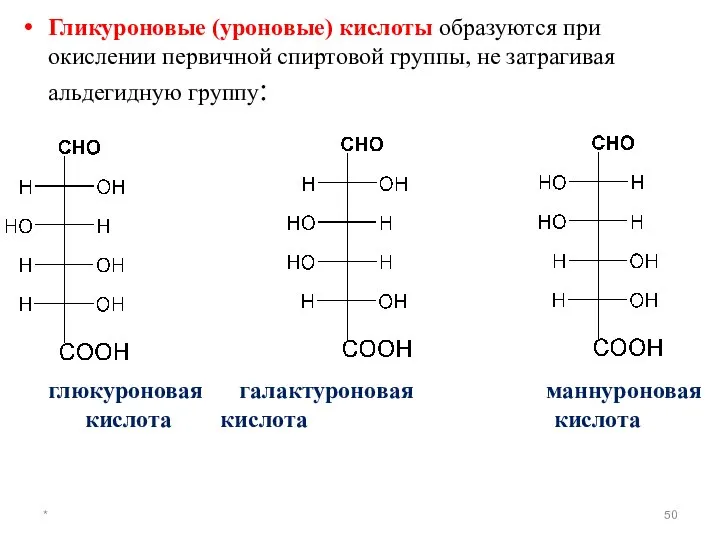
- 50. * Гликуроновые (уроновые) кислоты образуются при окислении первичной спиртовой группы, не затрагивая альдегидную группу: глюкуроновая галактуроновая
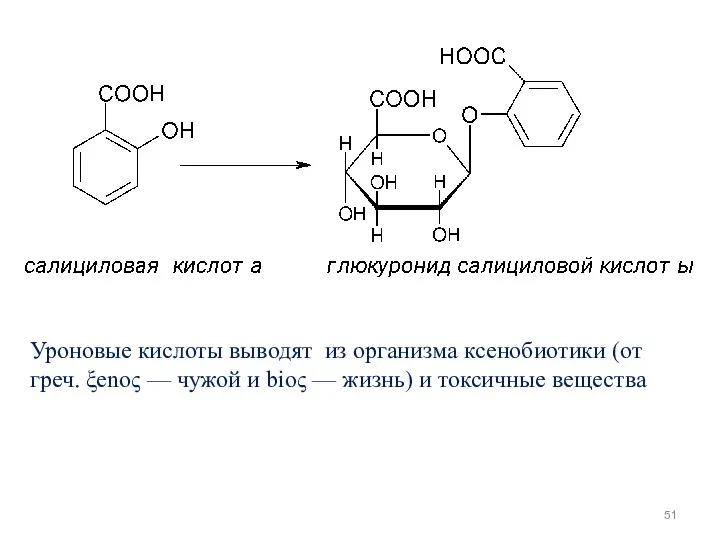
- 51. Уроновые кислоты выводят из организма ксенобиотики (от греч. ξenoς — чужой и bioς — жизнь) и
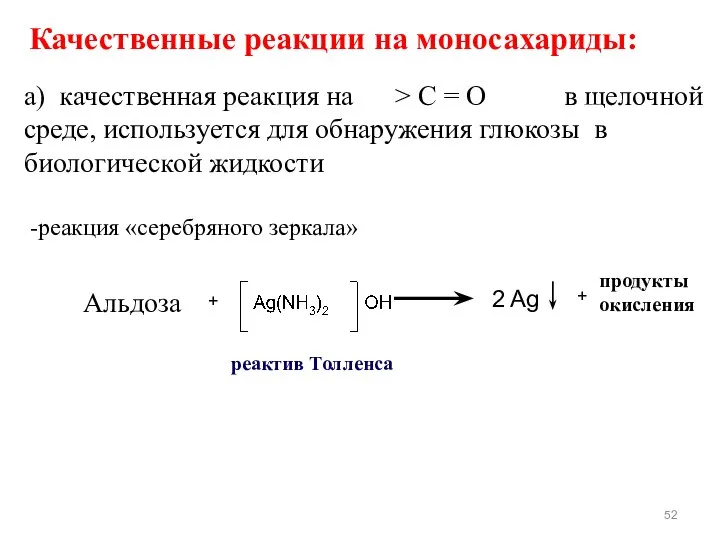
- 52. + 2 Ag продукты окисления + Качественные реакции на моносахариды: а) качественная реакция на > C
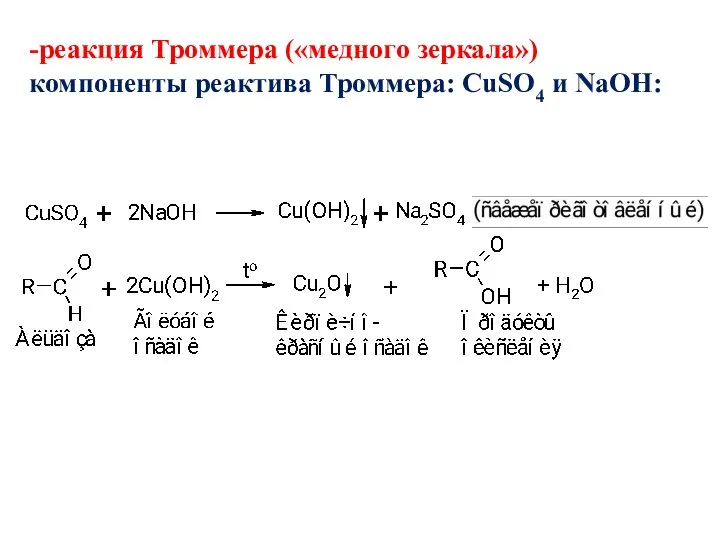
- 53. -реакция Троммера («медного зеркала») компоненты реактива Троммера: CuSO4 и NaOH:
- 54. Недостаток реакции Троммера:. затушевывает кирпично-красное окрашивание избыток
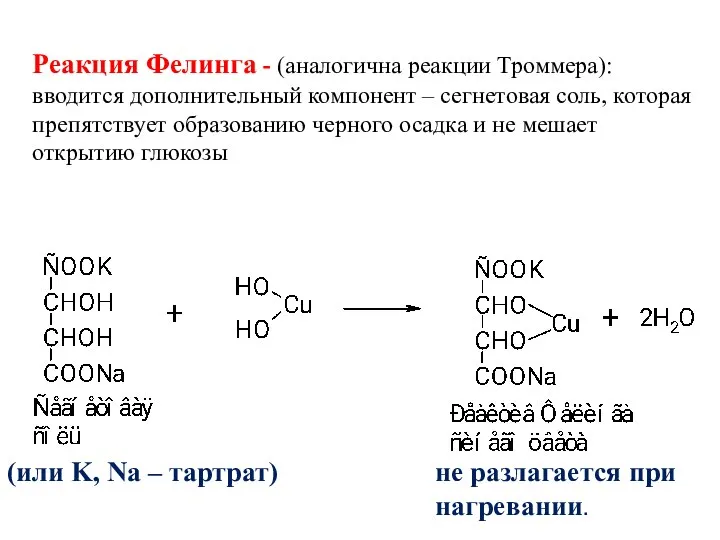
- 55. (или K, Na – тартрат) не разлагается при нагревании. Реакция Фелинга - (аналогична реакции Троммера): вводится
- 56. Реакция Гайнеса – аналогична реакции Фелинга, только в отличие от неё вместо сегнетовой соли введен глицерин,
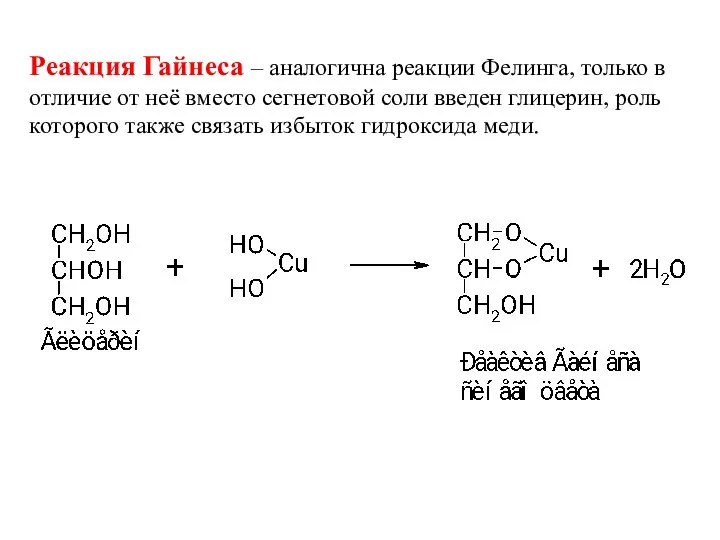
- 57. в) -ОН- спирт. + Cu(OH)2 ярко-синее окрашивание раствора (кач. реакция на диольный фрагмент) г) реакция Селиванова
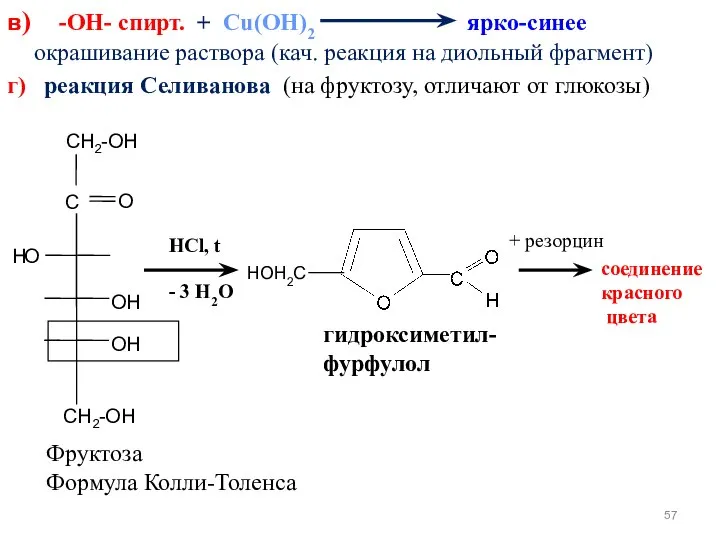
- 58. Содержание сахара в биологических жидкостях Содержание сахара в крови: 3,55-5,55 ммоль/л Гипергликемия > 5,55 ммоль/л Гипогликемия
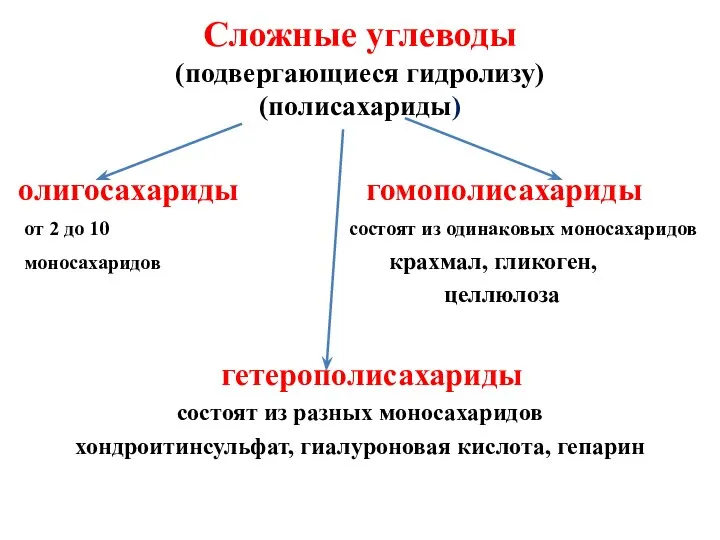
- 59. Сложные углеводы (подвергающиеся гидролизу) (полисахариды) олигосахариды гомополисахариды от 2 до 10 состоят из одинаковых моносахаридов моносахаридов
- 60. В природе наиболее распространены дисахариды: Дисахариды (биозы) – это олигосахариды с общей формулой С12Н22О11, состоящие из
- 61. Дисахариды (биозы) Восстанавливающие соединяются за счет полуацетальной (гликозидной) группы -ОН С-1 и С-4 спиртового гидроксила другого
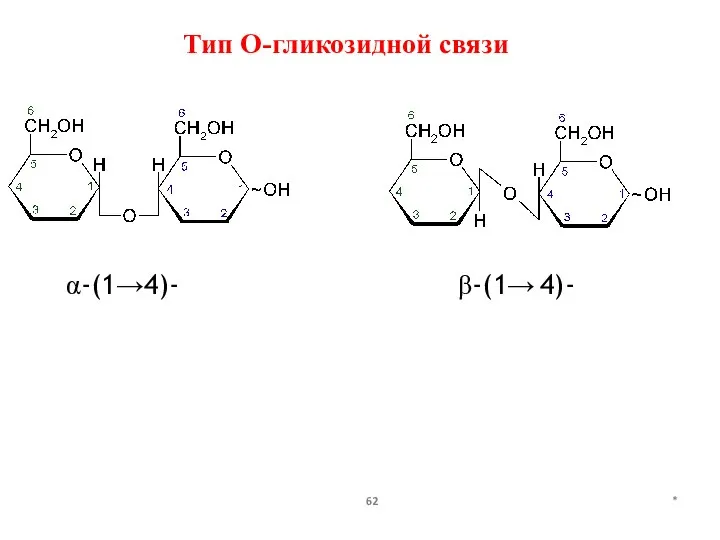
- 62. * Тип О-гликозидной связи α-(1→4)- β-(1→ 4)-
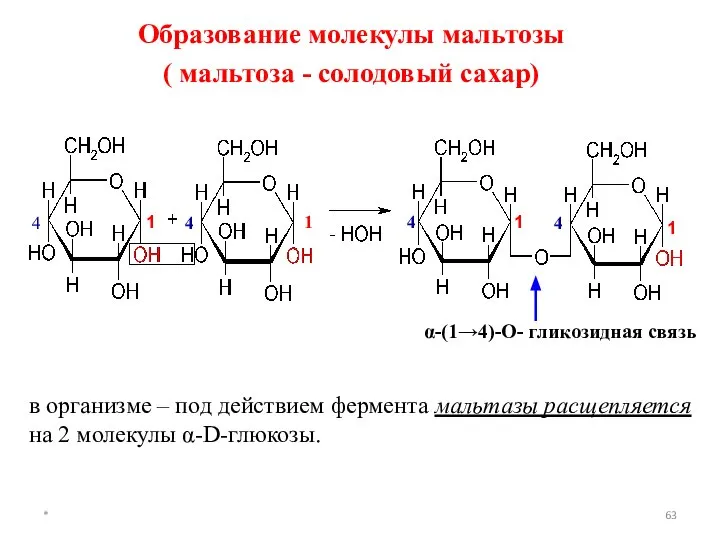
- 63. * 1 1 4 4 4 1 1 4 α-(1→4)-О- гликозидная связь Образование молекулы мальтозы (
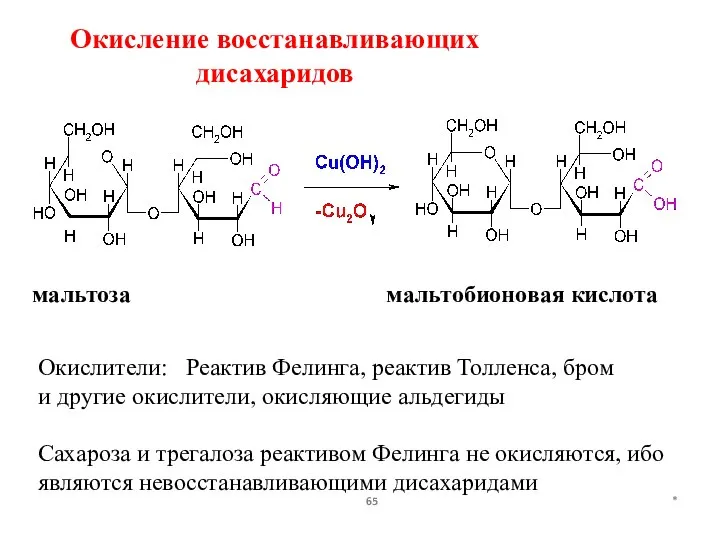
- 65. * Окисление восстанавливающих дисахаридов мальтоза мальтобионовая кислота Окислители: Реактив Фелинга, реактив Толленса, бром и другие окислители,
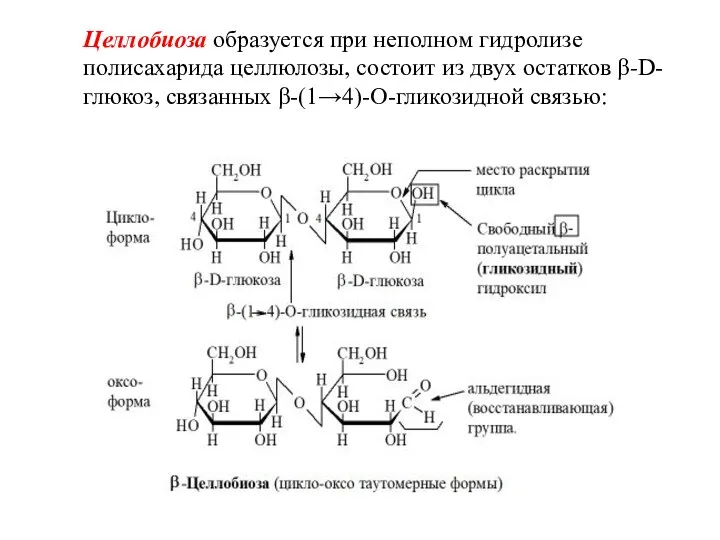
- 66. Целлобиоза образуется при неполном гидролизе полисахарида целлюлозы, состоит из двух остатков β-D-глюкоз, связанных β-(1→4)-O-гликозидной связью:
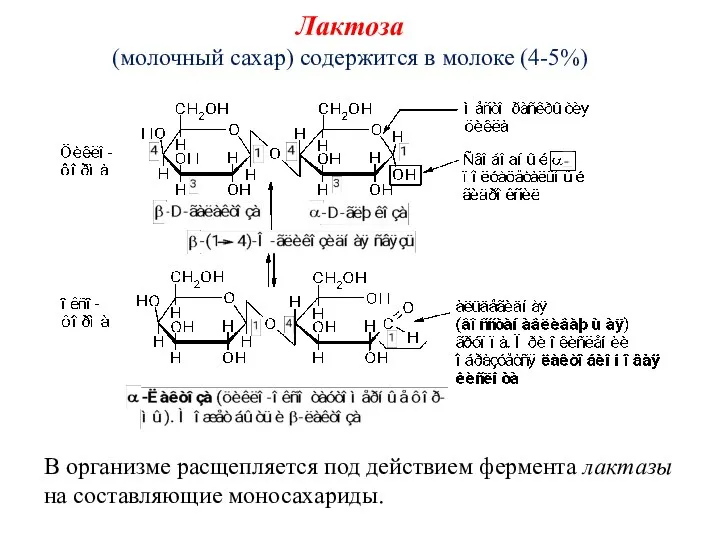
- 67. Лактоза (молочный сахар) содержится в молоке (4-5%) В организме расщепляется под действием фермента лактазы на составляющие
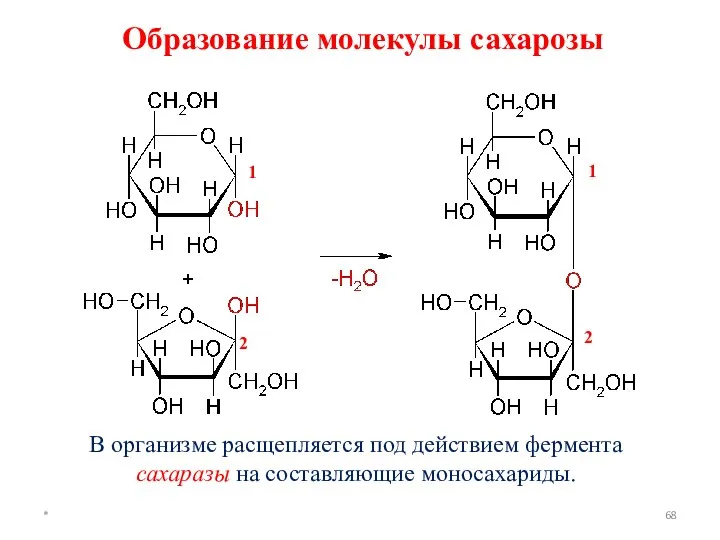
- 68. * В организме расщепляется под действием фермента сахаразы на составляющие моносахариды. Образование молекулы сахарозы 1 2
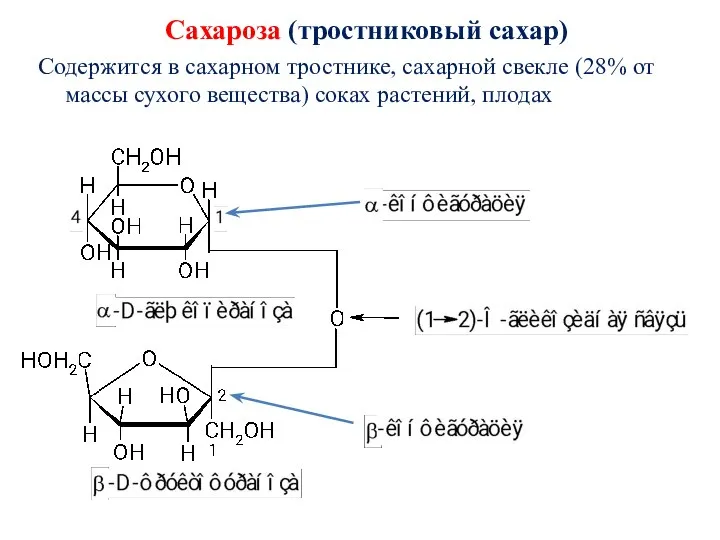
- 69. Сахароза (тростниковый сахар) Содержится в сахарном тростнике, сахарной свекле (28% от массы сухого вещества) соках растений,
- 70. Инверсия сахарозы- изменение угла вращения сахарозы после её гидролиза с D (+) 66,5° до D (-)
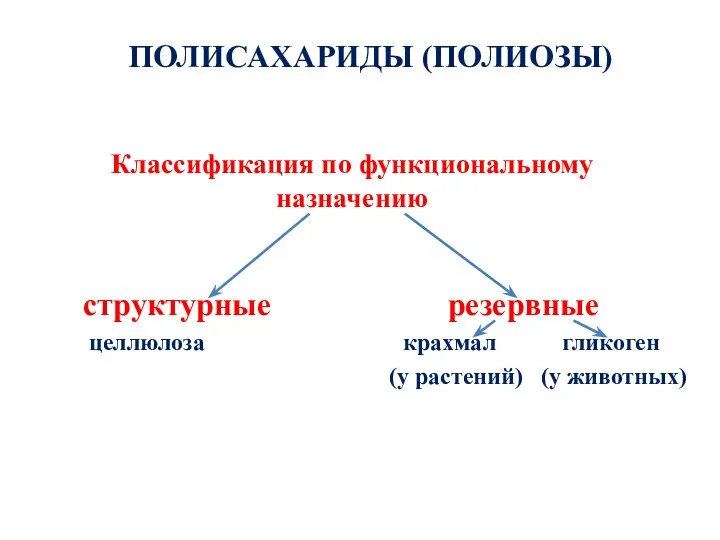
- 71. Классификация по функциональному назначению структурные резервные целлюлоза крахмал гликоген (у растений) (у животных) ПОЛИСАХАРИДЫ (ПОЛИОЗЫ)
- 72. Полисахариды легко гидролизуются в кислой среде, устойчивы в щелочных. In vivo гидролизуются ферментами: крахмал - амилазами,
- 73. Гомополисахариды (гликаны) первичная структура полисахаридов – это последовательность мономерных остатков вторичная структура –макромолекула, свёрнутая в спираль
- 74. Крахмал (С6Н10О5)n : биополимер, Mr-106-107 Состоит из моносахаридных звеньев α-D-глюкопиранозы. Продукт фотосинтеза в растениях, накапливается в
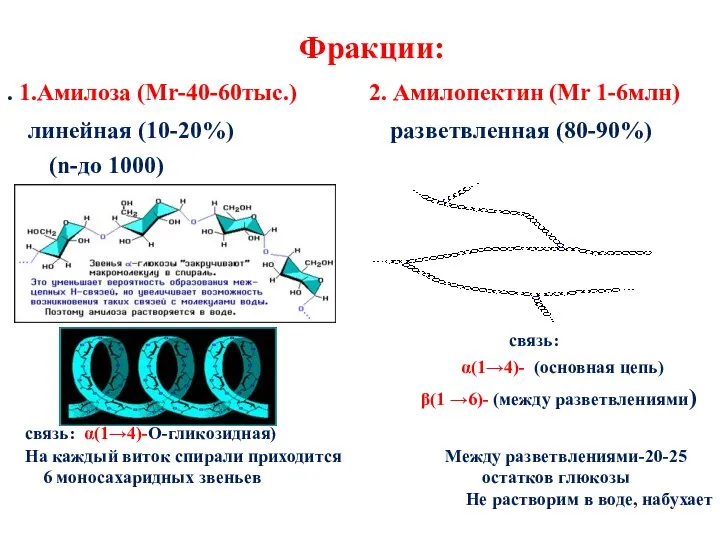
- 75. Фракции: . 1.Амилоза (Мr-40-60тыс.) 2. Амилопектин (Мr 1-6млн) линейная (10-20%) разветвленная (80-90%) (n-до 1000) связь: α(1→4)-
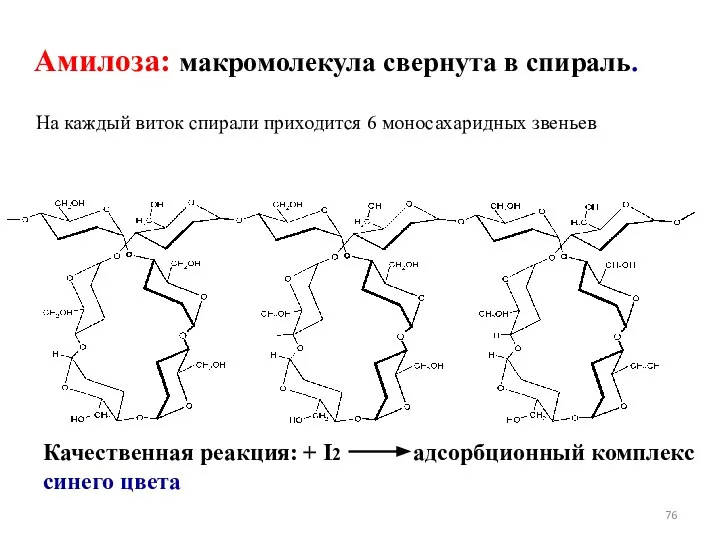
- 76. Амилоза: макромолекула свернута в спираль. На каждый виток спирали приходится 6 моносахаридных звеньев Качественная реакция: +
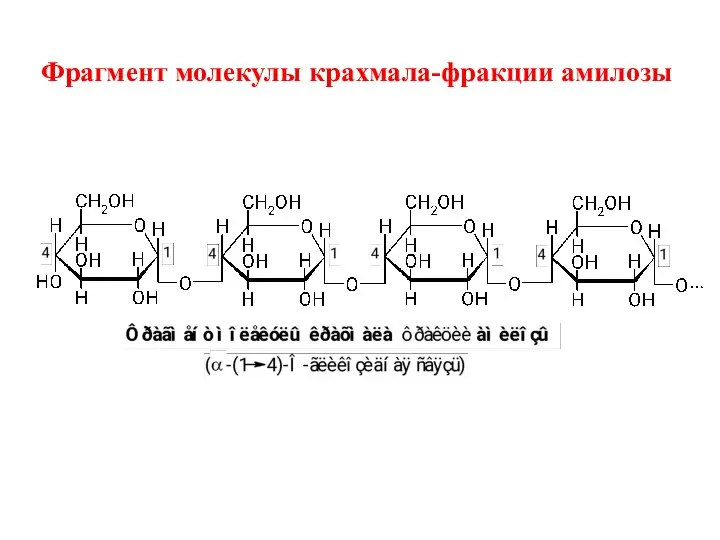
- 77. Фрагмент молекулы крахмала-фракции амилозы
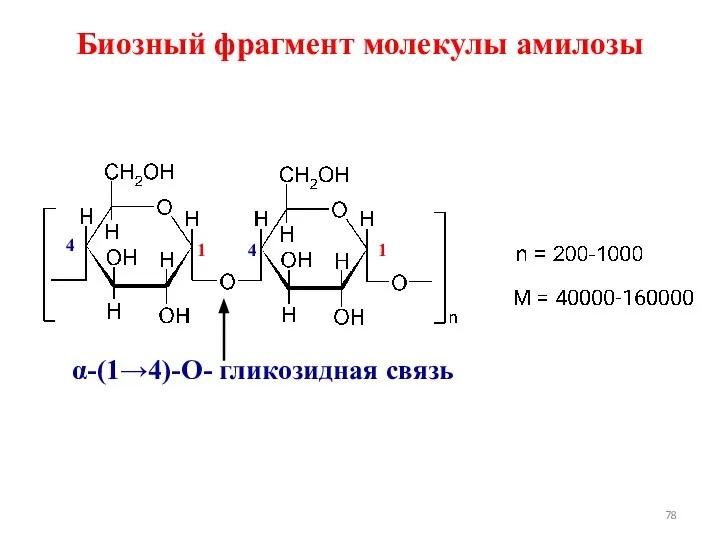
- 78. Биозный фрагмент молекулы амилозы α-(1→4)-О- гликозидная связь 1 4 4 1
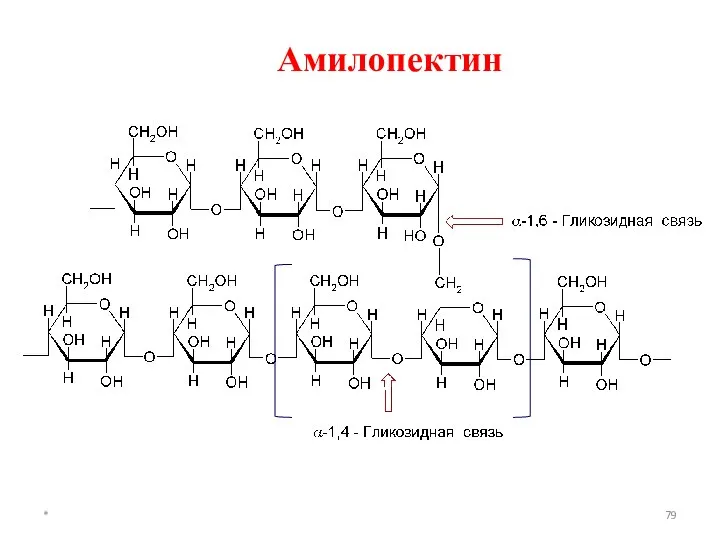
- 79. * Амилопектин
- 80. В пищеварительном тракте гидролизуется ферментами слюны и сока поджелудочной железы α- амилазой и α-(1→ 6)-глюкозидазой поэтапно
- 81. Гликоген (животный крахмал) Содержится в печени, мышцах, мозге. Структурный и функциональный аналог амилопектина. Основное отличие :
- 82. Пути расщепления в организме амилолитический (под действием амилазы) фосфоролитический (под действием Н3РО4) до мальтозы и глюкозы
- 83. Гетерополисахариды соединительной ткани (мукополисахариды) Составляющие компоненты: (уроновые кислоты аминосахариды ацетиламинопроизводные моносахаридов и др.) Связи: О-гликозидные Функции
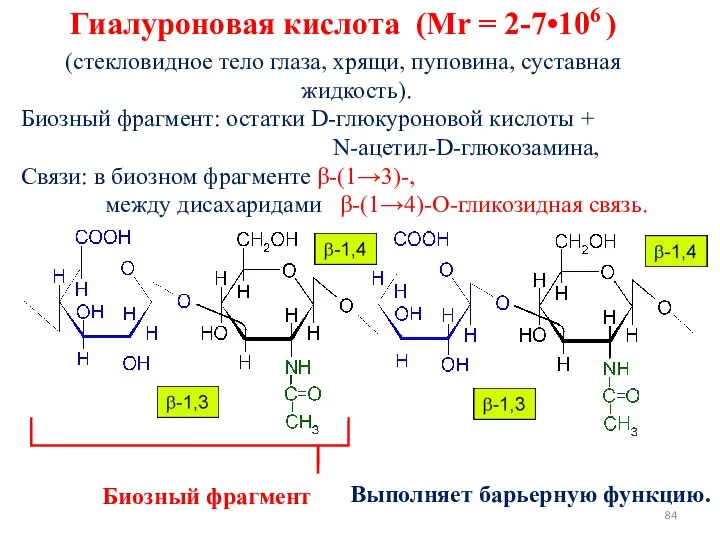
- 84. Гиалуроновая кислота (Mr = 2-7•106 ) (стекловидное тело глаза, хрящи, пуповина, суставная жидкость). Биозный фрагмент: остатки
- 85. Хондроитинсульфаты (Мr-10 тыс.-до 60 тыс.) (кожа, хрящи, сухожилия)
- 86. Состав: дисахаридные остатки + N-ацетилированный хондрозин Связь: β(1→4)-О- гликозидная связь. Хондрозин: β Д-глюкуроновая кислота + Д-галактозамин
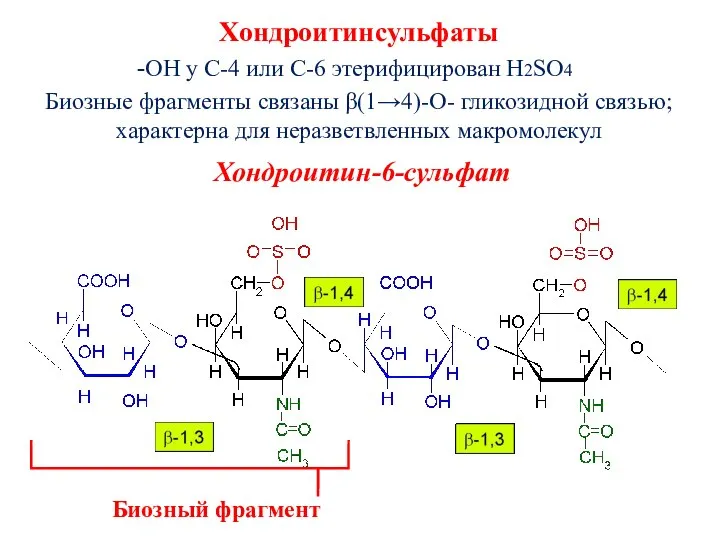
- 87. Хондроитинсульфаты ОН у С-4 или С-6 этерифицирован H2SO4 Биозные фрагменты связаны β(1→4)-О- гликозидной связью; характерна для
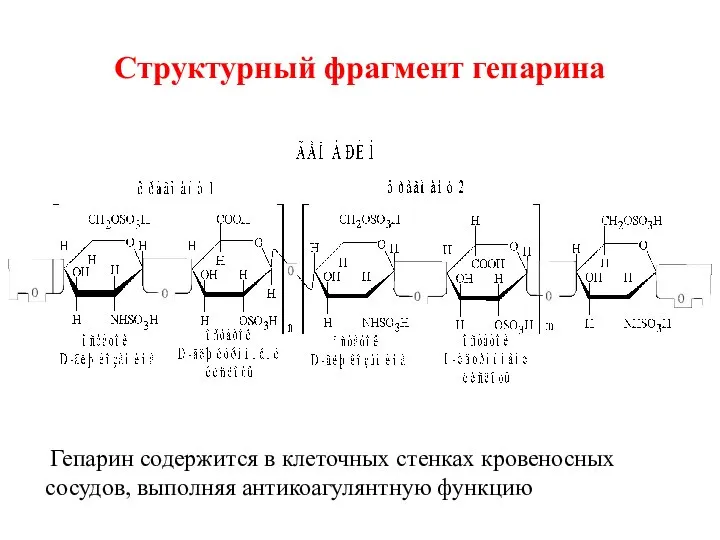
- 88. Гепарин (лат. hepar – печень) Мr = 16-20 тыс. биозный фрагмент содержит: 1) Д- глюкозамин или
- 89. Структурный фрагмент гепарина Гепарин содержится в клеточных стенках кровеносных сосудов, выполняя антикоагулянтную функцию
- 90. Биологическая роль углеводсодержащих мешанных биополимеров Составляют основу клеток и жидкостей животных организмов: пептидогликаны и протеогликаны- преобладает
- 92. Скачать презентацию
































 Полисилоксаны. Классификация полимеров
Полисилоксаны. Классификация полимеров ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна
ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна  Жидкие кристаллы и их свойства
Жидкие кристаллы и их свойства Пептиды. Тема 3
Пептиды. Тема 3 Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599
Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599 Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле»  Введение в биохимию. Строение и функции белков (часть 2)
Введение в биохимию. Строение и функции белков (часть 2) Липиды. Классификация, физические и химические свойства
Липиды. Классификация, физические и химические свойства Материаловедение для пирсера. Материалы, используемые в пирсинге
Материаловедение для пирсера. Материалы, используемые в пирсинге Азот. История открытия азота
Азот. История открытия азота Периодический закон. Периодическая система химических элементов
Периодический закон. Периодическая система химических элементов 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Wybrane sybstancje chemiczne i ich działanie
Wybrane sybstancje chemiczne i ich działanie Фенол. Получение и использование, физические и химические свойства. Биологическая роль
Фенол. Получение и использование, физические и химические свойства. Биологическая роль Аморфные тела
Аморфные тела Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.
Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.  Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Организация е-транспортной цепи
Организация е-транспортной цепи Общая фармакология
Общая фармакология Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Классификация химических реакций
Классификация химических реакций Формы представления петрохимических данных
Формы представления петрохимических данных Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Презентация по Химии "Химические элементы металлы и здоровье человека" - скачать смотреть бесплатно
Презентация по Химии "Химические элементы металлы и здоровье человека" - скачать смотреть бесплатно Оксиды, основания, кислоты
Оксиды, основания, кислоты Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией
Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов