Содержание
- 2. Натрия гидрокарбонат Natrii hydrocarbonas NaHCO3 Ф а р м а ц е в т и ч
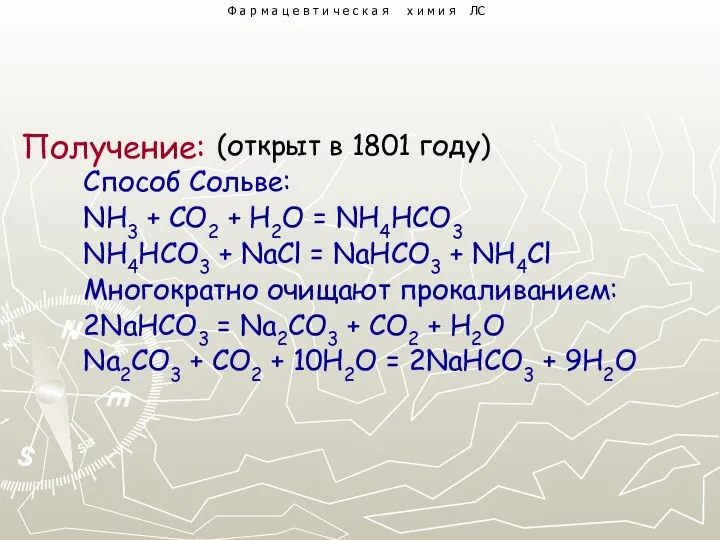
- 3. (открыт в 1801 году) Способ Сольве: NH3 + CO2 + H2O = NH4HCO3 NH4HCO3 + NaCl
- 4. Белый кристаллический порошок без запаха, солено-щелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном. Водные
- 5. Хорошо растворяется в воде, нерастворим в 95% спирте. Водный 0,1н раствор препарата не должен окрашиваться от
- 6. 1) Na+ - пирохимическая реакция 2) на карбонат - ион NaHCO3 + HCl = NaCl +
- 7. - прозрачность и цветность раствора - не допускается NH4+, тяжелые металлы - допустимое предельное содержание Cl-,
- 8. Метод нейтрализации, ацидиметрия Рабочий раствор- 0,1н HCl Ind - м/о NaHCO3 + HCl = NaCl +
- 9. в хорошо укупоренной таре Ф а р м а ц е в т и ч е
- 10. Кислота борная Acidum boricum H3BO3 М.м. 61,83 Ф а р м а ц е в т
- 11. В промышленности борную кислоту получают из борсодержащих минералов (ашарита Mg2OB2O5*H2O) действием концентрированной серной кислоты Ф а
- 12. Жирные на ощупь, бесцветные, прозрачные чешуйчатые кристаллы или мелкий белый кристаллический порошок без запаха. Ф а
- 13. В холодной воде растворяется плохо, в горячей – хорошо. Растворима в спирте 1/25, хуже в глицерине
- 14. 1) с этанолом в присутствии конц. H2SO4, при этом образуется борно-этиловый эфир, который дает пламя с
- 15. 2) с куркумовой бумажкой, одновременно добавляя несколько капель HCl – появляется розовый или буровато-красный цвет. Если
- 16. - прозрачность и цветность; - допускается присутствие примесей: кальция, железа, тяжелых металлов, мышьяка, сульфатов в количестве,
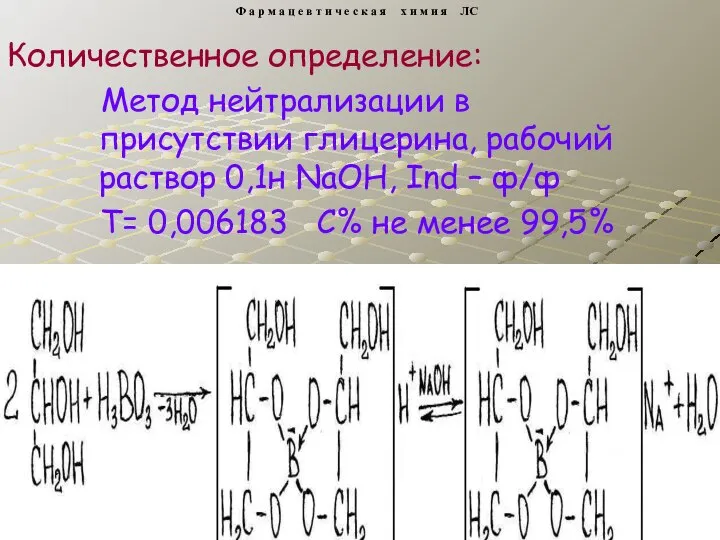
- 17. Метод нейтрализации в присутствии глицерина, рабочий раствор 0,1н NaOH, Ind – ф/ф Т= 0,006183 С% не
- 18. - как антисептическое средство в виде 2-3% растворов для полоскания горла, в мазях и присыпках; -
- 19. В хорошо укупоренной таре Ф а р м а ц е в т и ч е
- 20. Натрия тетроборат. Бура Natrii tetraboras Borax Na2B4O7*10H2O М.м. 381,37 Ф а р м а ц е
- 21. В природе встречается в свободном состоянии. В промышленности получают из борной кислоты действием водного раствора карбоната
- 22. бесцветные прозрачные легковыветривающиеся кристаллы или белый кристаллический порошок Ф а р м а ц е в
- 23. Хорошо растворяется в воде, лучше в горячей. Легко в глицерине, не растворяется в спирте Ф а
- 24. а) Na+: пирохимическая реакция -окрашивание пламени в желтый цвет б) бура дает все реакции, характерные для
- 25. - не должно быть примесей карбонатов; - допускаются примеси мышьяка, хлоридов, сульфатов, железа Ф а р
- 26. Метод нейтрализации (ацидиметрия) Рабочий раствор – 0,1N HCL Ind – м/о Na2B4O7 * 10H2O + 2HCl
- 27. Ф а р м а ц е в т и ч е с к а я
- 29. Скачать презентацию
























 Закон сохранения массы веществ
Закон сохранения массы веществ Презентация по Химии "Соединения кальция." - скачать смотреть бесплатно_
Презентация по Химии "Соединения кальция." - скачать смотреть бесплатно_ Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно
Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно Строение атома
Строение атома Кристаллография. История развития
Кристаллография. История развития Ковалентная химическая связь
Ковалентная химическая связь Кислоты вокруг нас
Кислоты вокруг нас Строение атома кремния
Строение атома кремния Материалы с особыми тепловыми свойствами
Материалы с особыми тепловыми свойствами Кислород
Кислород Витамины. (10 класс)
Витамины. (10 класс) Спирты (Алкоголи)
Спирты (Алкоголи) Роль химии в жизни человека
Роль химии в жизни человека Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Ароматические углеводороды Тесты
Ароматические углеводороды Тесты  Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Массовая доля
Массовая доля Состав обычной воды
Состав обычной воды Дизельное топливо. А также его преимущества и недостатки
Дизельное топливо. А также его преимущества и недостатки Транспорт веществ через биологические мембраны
Транспорт веществ через биологические мембраны Типы изомерии
Типы изомерии Презентация ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ
Презентация ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ  Спирты одноатомные предельные
Спирты одноатомные предельные Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж
Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки
Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение XIII конференция ИХТРЭМС Научно-практические проблемы в области химии и химических технологий
XIII конференция ИХТРЭМС Научно-практические проблемы в области химии и химических технологий