J.Chem.Educ 1990 V.67 p.280 J.F.Ogilvie “There Are No Such Things as
Orbitals”
Міллікен визначив орбіталь як математичну функцію, частково, як розв'язок рівняння Шредінгера для одноелектронної системи, таких як атом Н або молекула Н2+. (розв'язок є точним);
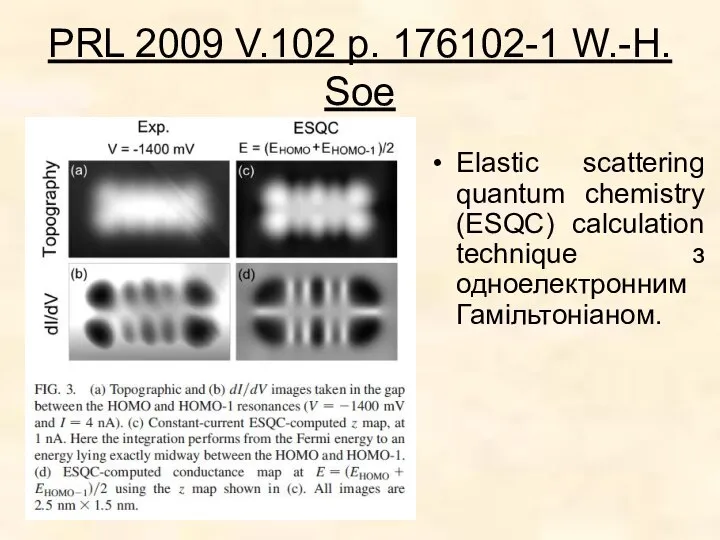
Рівняння для молекули не мають аналітичного розв'язку. (електрон не може мати динамічно незалежних станів);
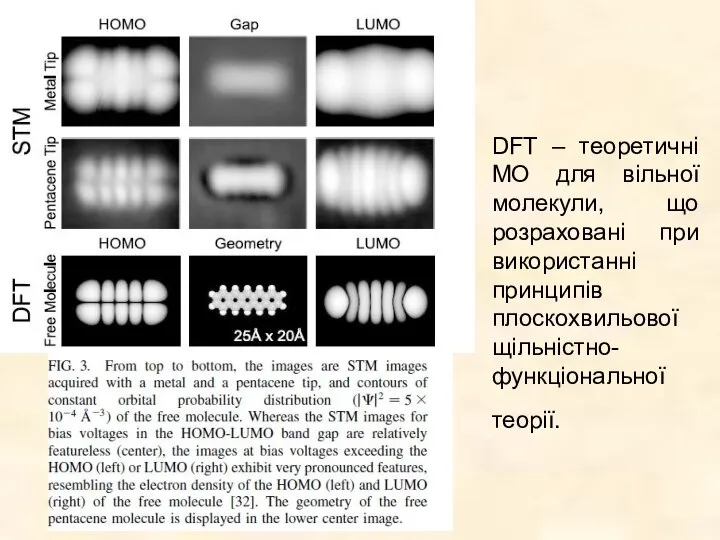
Опис молекулярної хвильовою функції як лінійна комбінація атомних – лише наближення. (немає врахування міжелектронної взаємодії);
Незалежно від гібридизації у методі ХФ отримуються однакові структурні та енергетичні значення. (залежність форми та типу гібридизації);
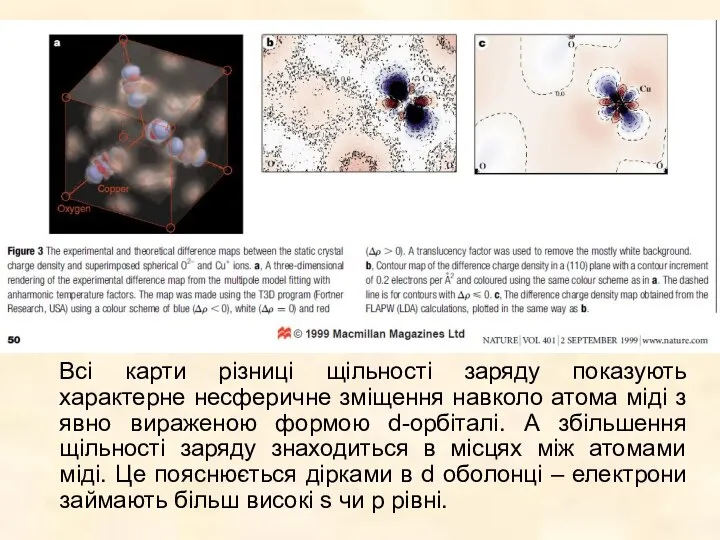
Розраховані зв'язки молекули НСl методом ХФ (з базисом атомних хвильових функцій) не співпадають з теорією.






 Строение атома. Периодический закон. Периодическая система
Строение атома. Периодический закон. Периодическая система Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан
Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан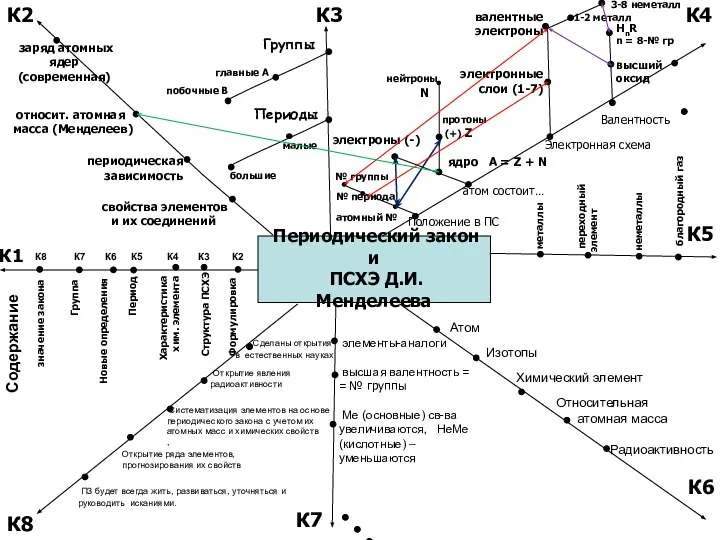 Периодический закон и ПСХЭ Д.И. Менделеева
Периодический закон и ПСХЭ Д.И. Менделеева Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Органическая химия
Органическая химия Алкины
Алкины Францій БІОЛОГІЧНА РОЛЬ
Францій БІОЛОГІЧНА РОЛЬ  Биологически активные низкомолекулярные вещества
Биологически активные низкомолекулярные вещества Нефть
Нефть Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ Презентация по Химии "Металлическая химическая связь" - скачать смотреть
Презентация по Химии "Металлическая химическая связь" - скачать смотреть  Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть
Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть  Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Алкадиены. Физические свойства
Алкадиены. Физические свойства Кривые титрования. (Лекция 6)
Кривые титрования. (Лекция 6) Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц
Аттестационная работа. Организация деятельности по изучению природных и искусственных красителей для пасхальных яиц Элементы-металлы. Викторина. 9 класс
Элементы-металлы. Викторина. 9 класс Минеральные удобрения
Минеральные удобрения Химическое загрязнение почвы
Химическое загрязнение почвы Презентация по Химии "Задания на соответствие" - скачать смотреть
Презентация по Химии "Задания на соответствие" - скачать смотреть  ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Менделєєв Дмитро Іванович
Менделєєв Дмитро Іванович  Химическая связь
Химическая связь s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Химия и сельское хозяйство
Химия и сельское хозяйство