Содержание
- 4. В работе решаются следующие задачи: изучение литературы о меди и ее соединениях; выявление новых для нас
- 5. Анализ свойств меди и наших представлений о них
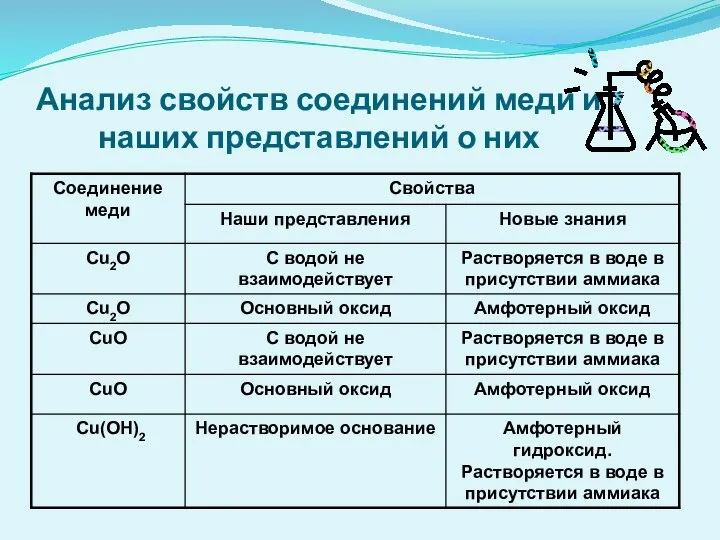
- 6. Анализ свойств соединений меди и наших представлений о них
- 7. В работе были выполнены следующие опыты : Растворение меди в растворе аммиака Взаимодействие меди с кислотами
- 8. Экспериментальная часть Получение реактивов
- 9. Получение свежеосажденной меди CuSO4 + Zn = ZnSO4 + Cu
- 10. Получение оксида меди(I) 2C6H12O6 + 2Cu(OH)2 → 2C6H12O7 + 2CuOH + H2O 2CuOH → Cu2O +
- 11. Получение бромоводородной кислоты Взаимодействие KBr с H2SO4 конц. ~96 % (1), ~65 % (2) и H3PO4
- 12. 2HBr + H2SO4 (конц.) = Br2 + SO2↑ + 2H2O в продуктах взаимодействия кислот с бромидом
- 13. Обнаружение бромид-иона в продуктах взаимодействия бромида калия с 65%-ной серной кислотой
- 14. Опыты с металлической медью
- 15. Взаимодействие меди с раствором аммиака 1, 2. – медь в растворе аммиака; 3. раствор сульфата тетраамминмеди(II);
- 16. 2Cu + 8NH3 + O2 + 2H2O = 2[Cu(NH3)4]2(ОН)2 Гидроксид тетраамминмеди(II) Доказательство участия кислорода в реакции
- 17. Взаимодействие меди с концентрированной HCl (А) и разбавленной H2SO4 (Б) 1. До начала реакции; 2. После
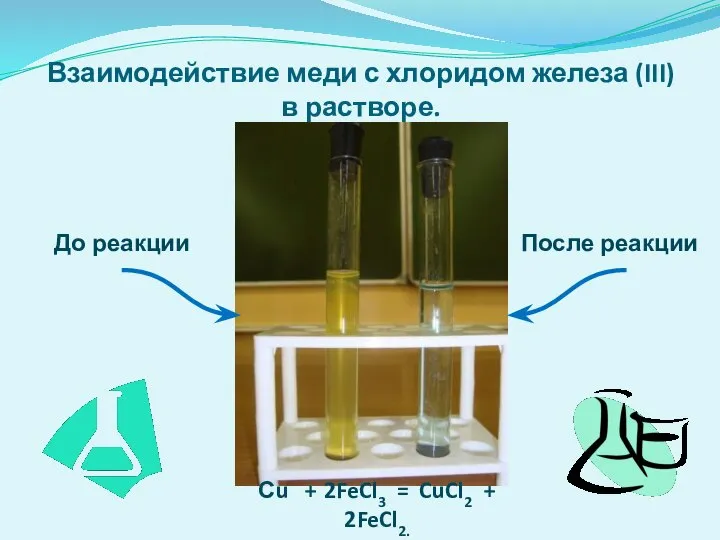
- 18. Взаимодействие меди с хлоридом железа (III) в растворе. Сu + 2FeCl3 = CuCl2 + 2FeCl2. До
- 19. Обнаружение катионов Fe2+ (1) и Cu2+(2) после реакции меди с раствором хлорида железа(III)
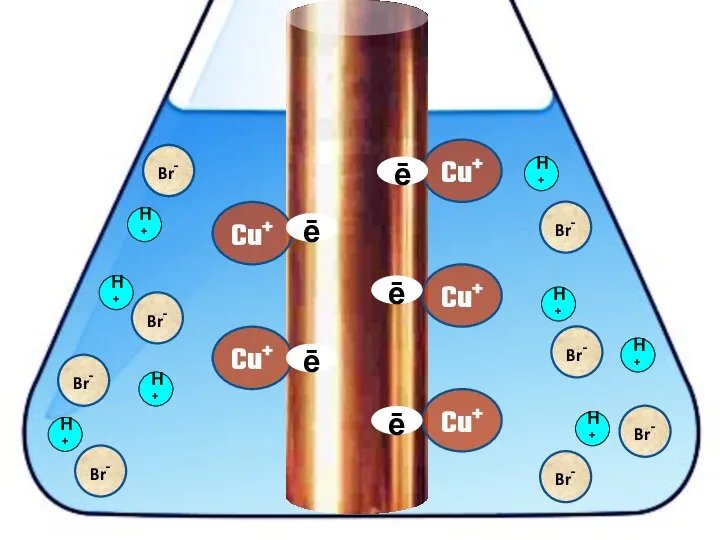
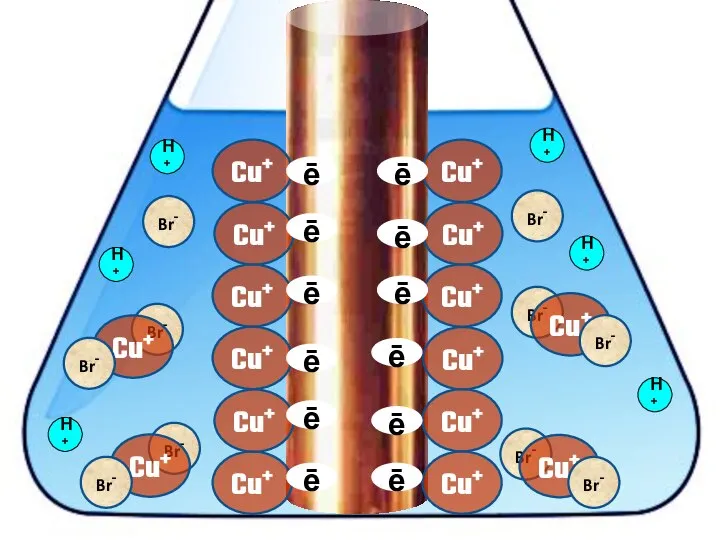
- 20. Взаимодействие меди с бромоводородной кислотой 4HBr + 2Сu = 2H[CuBr2] + H2↑
- 22. H+ H+ H+ H+ H+ H+ H+ H+ Br- Br- Br- Br- Br- Br- Br- Br-
- 23. Cu+ ē Cu+ Cu+ Cu+ Cu+ H+ H+ H+ H+ H+ H+ H+ H+ ē ē
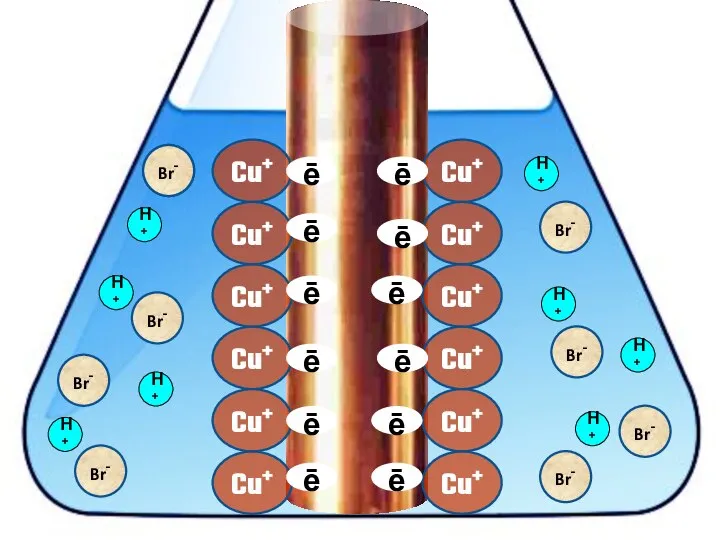
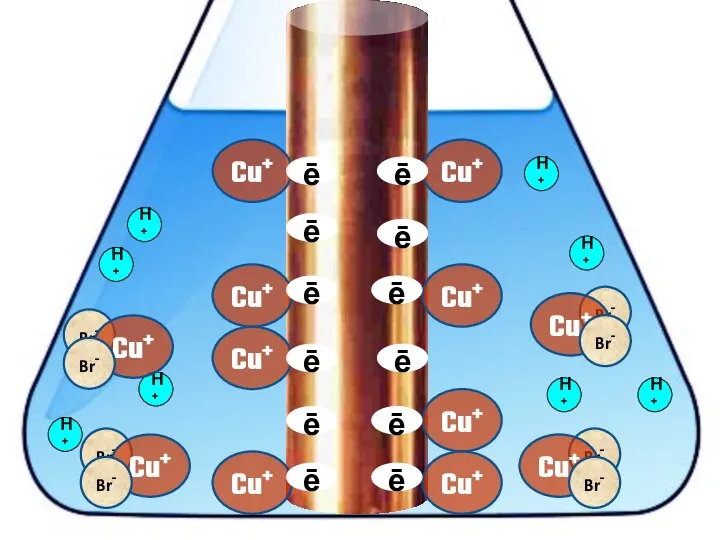
- 24. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ H+ H+
- 25. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Br- Br- Br-
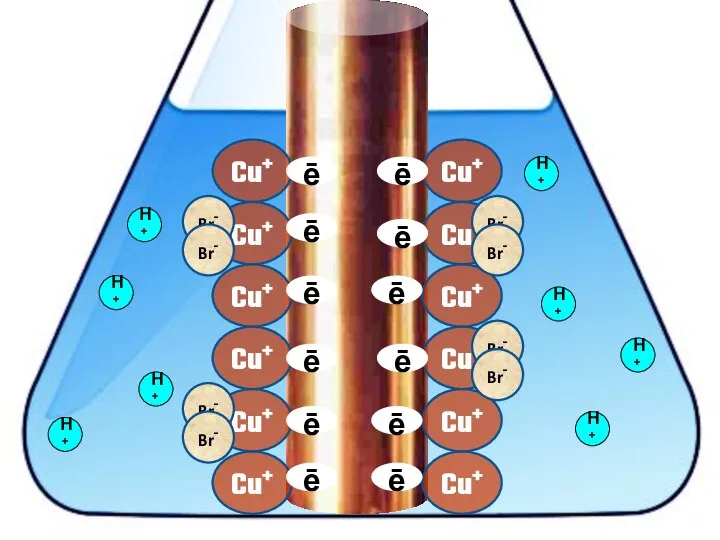
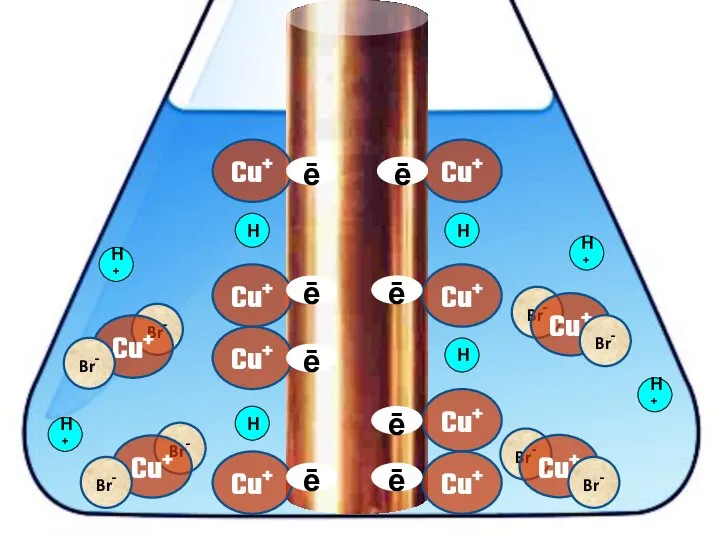
- 26. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ H+ H+ H+ H+ ē ē
- 27. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ H+ H+ H+ ē ē ē
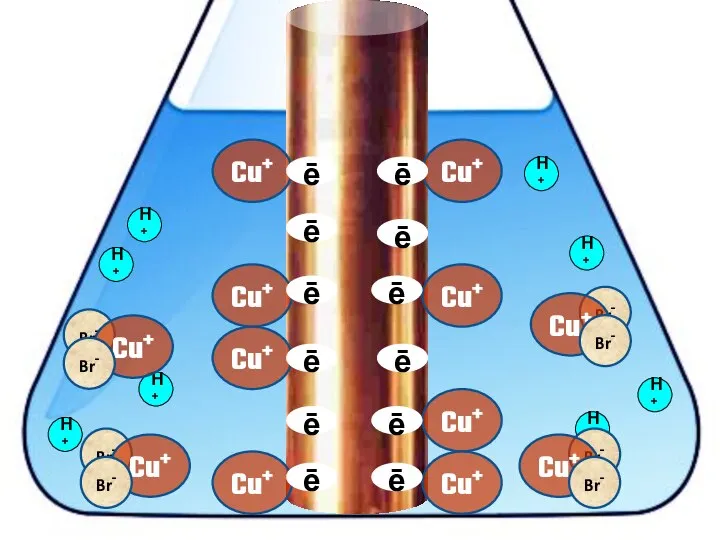
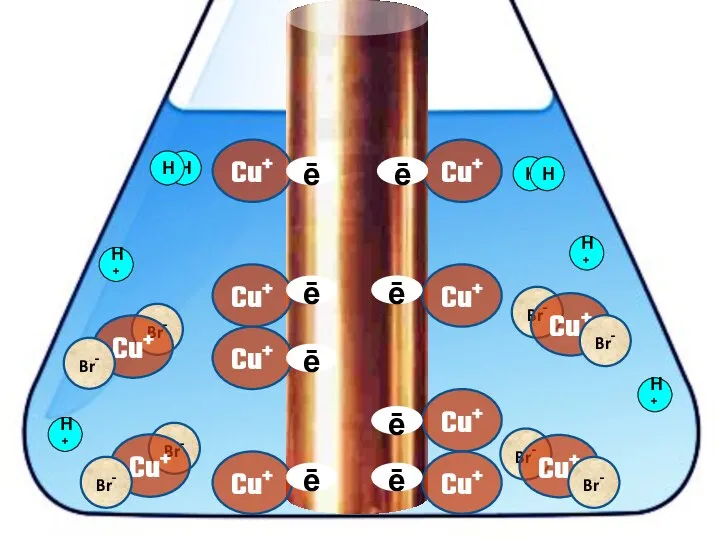
- 28. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ ē ē ē ē ē ē
- 29. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ ē ē ē ē ē ē
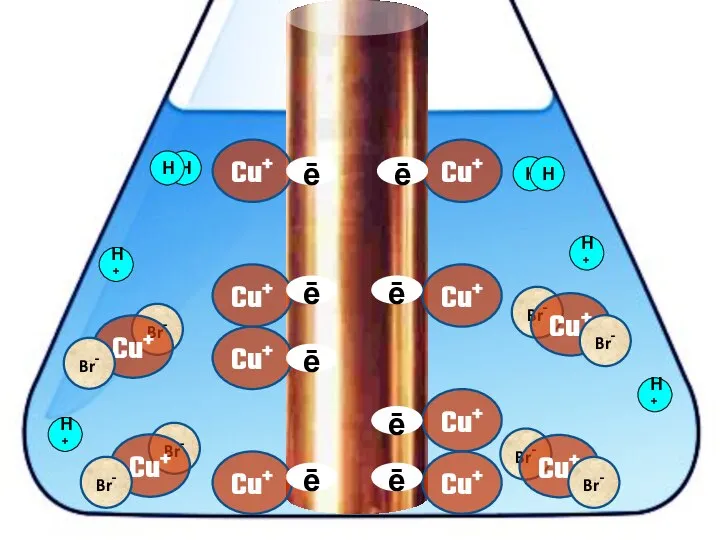
- 30. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ ē ē ē ē ē ē
- 31. Cu+ ē Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ Cu+ H+ ē ē ē ē ē ē
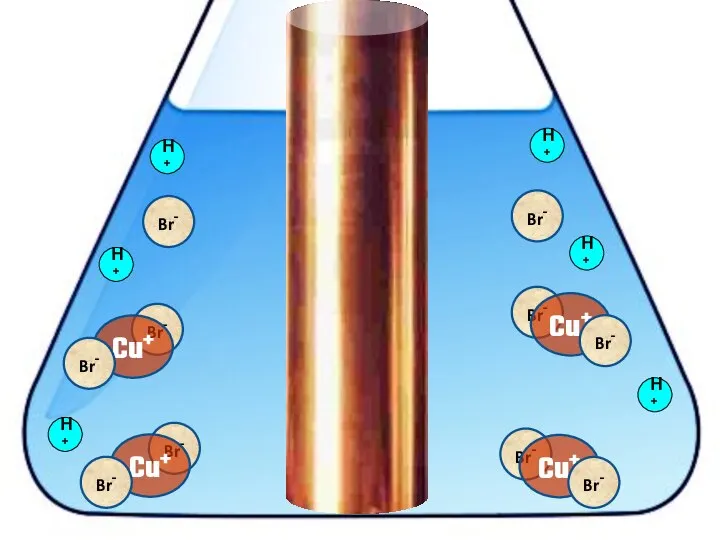
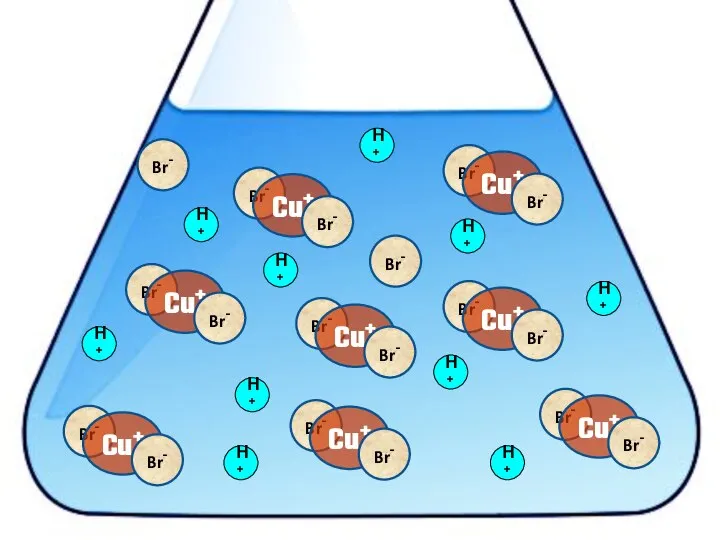
- 32. H+ H+ H+ H+ Br- Br- H+ H+
- 33. H+ H+ H+ H+ H+ H+ H+ H+ Br- Br- H+ H+
- 34. Изучение амфотерных свойств Соединения меди
- 35. Cu2Oт + 2HClр = 2CuCl т + H2O СuClт + HClр = H[CuCl2]р 2) Cu2Oт +
- 36. исходные образцы после добавления реактивов 1) CuO т + 2HCl р = CuCl2 ж + H2O
- 37. 1) Cu(OH)2 т + 2HCl р = CuCl2 ж + 2H2O ж 2) Cu(OH)2 т +
- 38. Выводы:
- 39. 1. В условиях школьной лаборатории выбраны и освоены методики, проведены опыты и получены данные, подтверждающие: -
- 40. Показана возможность развития наших представлений об окружающих предметах и явлениях.
- 41. Создан информационный ресурс для проведения уроков по теме «Медь и ее соединения».
- 43. Скачать презентацию












![2Cu + 8NH3 + O2 + 2H2O = 2[Cu(NH3)4]2(ОН)2 Гидроксид тетраамминмеди(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/791973/slide-15.jpg)


![Взаимодействие меди с бромоводородной кислотой 4HBr + 2Сu = 2H[CuBr2] + H2↑](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/791973/slide-19.jpg)








 Полимеры и мономеры
Полимеры и мономеры Три элемента таблицы Менделеева
Три элемента таблицы Менделеева Первоначальные химические понятия (обобщающий урок)
Первоначальные химические понятия (обобщающий урок) Физические явления - основа разделения смесей в химии
Физические явления - основа разделения смесей в химии Компоненты нефти, газов и нефтепродуктов. Состав, строение, свойства. Насыщенные углеводороды
Компоненты нефти, газов и нефтепродуктов. Состав, строение, свойства. Насыщенные углеводороды Хром
Хром Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Свойства металла. Подготовительная группа 2
Свойства металла. Подготовительная группа 2 Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Разложение отходов. 11 класс
Разложение отходов. 11 класс Презентация по Химии "«Основания»" - скачать смотреть
Презентация по Химии "«Основания»" - скачать смотреть  Физиология микроорганизмов. (Лекция 7)
Физиология микроорганизмов. (Лекция 7) Лабораторное оборудование и вспомогательные принадлежности. Лекция №2
Лабораторное оборудование и вспомогательные принадлежности. Лекция №2 Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны Основные классы неорганических соединений
Основные классы неорганических соединений Классификация неорганических соединений
Классификация неорганических соединений Аэрированный сшитый полимерный раствор (АСПР)
Аэрированный сшитый полимерный раствор (АСПР) Презентация по Химии "Белки." - скачать смотреть бесплатно
Презентация по Химии "Белки." - скачать смотреть бесплатно Исследование защитных свойств зубных паст. Автор работы- ученик 11 Б класса Гиря Научный руководитель- Якимова М.А. МОУ Южно-росс
Исследование защитных свойств зубных паст. Автор работы- ученик 11 Б класса Гиря Научный руководитель- Якимова М.А. МОУ Южно-росс Научная работа на тему «Уголь» Научная работа на тему «Уголь» Подготовила: Шакарова Ксения Руководитель: Э.М. Курант
Научная работа на тему «Уголь» Научная работа на тему «Уголь» Подготовила: Шакарова Ксения Руководитель: Э.М. Курант Деловая игра «Деятельность учителя и деятельность ученика». обучающий семинар «Системно – деятельностный
Деловая игра «Деятельность учителя и деятельность ученика». обучающий семинар «Системно – деятельностный  Химия. Роберт Бойль
Химия. Роберт Бойль Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды) Лавсан (полиэтилентерефталат)
Лавсан (полиэтилентерефталат) Хром және оның қосылыстары
Хром және оның қосылыстары Цитрусты жемістерді жерорта теңізінің жеміс шыбынынан, тұқымдық және азық-түліктік картопты картоп күйесіне қарсы бромды
Цитрусты жемістерді жерорта теңізінің жеміс шыбынынан, тұқымдық және азық-түліктік картопты картоп күйесіне қарсы бромды Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Макроэлементтер N,Cа,P
Макроэлементтер N,Cа,P