Требования к технической и эксплуатационной документации медицинских изделий в национальной системе и ЕАЭС
Содержание
- 2. ОКОНЧАНИЕ ДЕЙСТВИЯ НАЦИОНАЛЬНЫХ СИСТЕМ РЕГИСТРАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ
- 3. ОКОНЧАНИЕ ДЕЙСТВИЯ НАЦИОНАЛЬНЫХ СИСТЕМ РЕГИСТРАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ
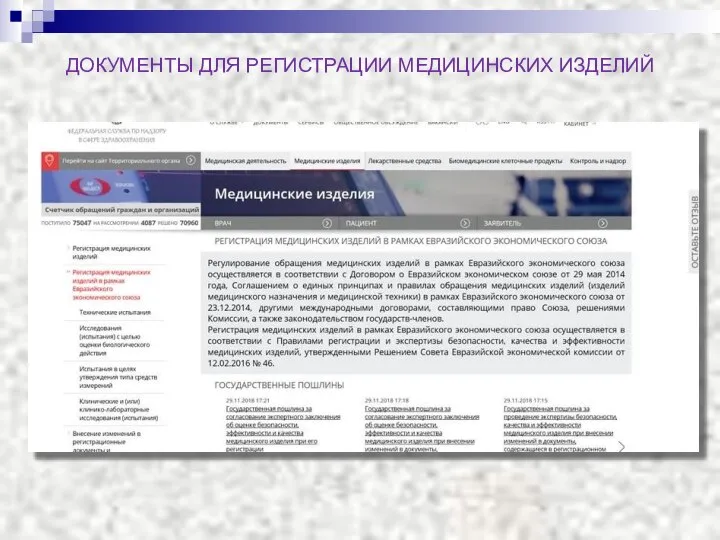
- 4. ДОКУМЕНТЫ ДЛЯ РЕГИСТРАЦИИ МЕДИЦИНСКИХ ИЗДЕЛИЙ
- 5. ПЕРЕЧЕНЬ ДОКУМЕНТОВ ДЛЯ РЕГИСТРАЦИИ
- 6. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
- 7. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
- 8. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
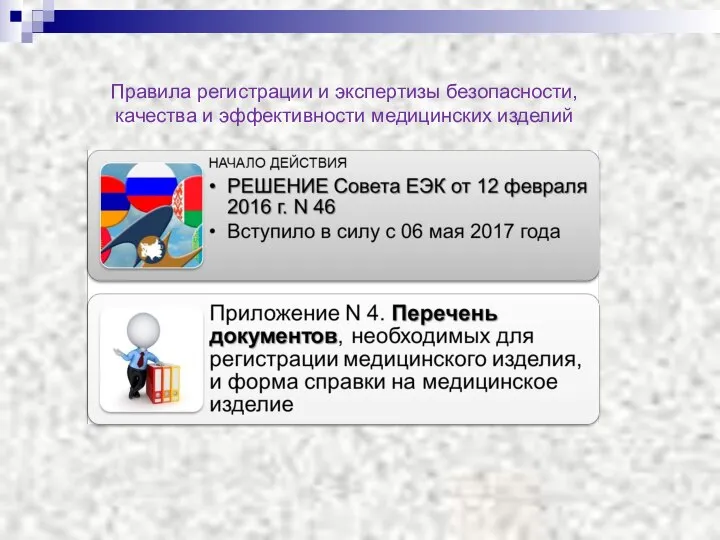
- 9. Правила регистрации и экспертизы безопасности, качества и эффективности медицинских изделий
- 10. Правила регистрации и экспертизы безопасности, качества и эффективности медицинских изделий
- 11. Документ, устанавливающий требования к техническим характеристикам медицинского изделия В решениях совета ЕАЭС: форма документов не установлена;
- 12. Документ, устанавливающий требования к техническим характеристикам медицинского изделия Для медицинских изделий производства Российской Федерации в качестве
- 13. Решения ЕЭК, которые необходимо принимать во внимание при подготовке Документа с техническими требованиями и Эксплуатационной документации
- 14. Решения ЕЭК, которые необходимо принимать во внимание при подготовке Документа с техническими требованиями и Эксплуатационной документации
- 15. Решения ЕЭК, которые необходимо принимать во внимание при подготовке Документа с техническими требованиями и Эксплуатационной документации
- 16. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ РАЗДЕЛОВ ДОКУМЕНТА С ТЕХНИЧЕСКИМИ ТРЕБОВАНИЯМИ
- 17. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ РАЗДЕЛОВ ДОКУМЕНТА С ТЕХНИЧЕСКИМИ ТРЕБОВАНИЯМИ
- 18. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ РАЗДЕЛОВ ДОКУМЕНТА С ТЕХНИЧЕСКИМИ ТРЕБОВАНИЯМИ
- 19. ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ РЕШЕНИЕ от 12 февраля 2016 г. N 27 14. Требования к информации, содержащейся в
- 20. ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ РЕШЕНИЕ от 12 февраля 2016 г. N 27 14. Требования к информации, содержащейся в
- 21. ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ РЕШЕНИЕ от 12 февраля 2016 г. N 27 14. Требования к информации, содержащейся в
- 22. ОБЩИЕ РЕКОМЕНДАЦИИ
- 24. Скачать презентацию



















 Гражданское общество и правовое государство
Гражданское общество и правовое государство Правовые условия использования электронной подписи в органах внутренних дел
Правовые условия использования электронной подписи в органах внутренних дел Закон о социальном предпринимательстве
Закон о социальном предпринимательстве Экслибрис. Древнейший русский экслибрис
Экслибрис. Древнейший русский экслибрис Бухгалтерский учет и анализ при несостоятельности (банкротстве) организации
Бухгалтерский учет и анализ при несостоятельности (банкротстве) организации Особенности закупки оргтехники для государственных и муниципальных нужд
Особенности закупки оргтехники для государственных и муниципальных нужд Основа стандарта нового поколения: системно-деятельностный подход
Основа стандарта нового поколения: системно-деятельностный подход Понятие, система и значение особенной части уголовного права. Квалификация преступлений
Понятие, система и значение особенной части уголовного права. Квалификация преступлений Конституционно-правовой статус человека и гражданина
Конституционно-правовой статус человека и гражданина История и источники Прав человека
История и источники Прав человека Функции государства
Функции государства Правоохранительные органы РФ
Правоохранительные органы РФ Основы конституционного строя России
Основы конституционного строя России Подведомственность и подсудность дел
Подведомственность и подсудность дел Новая конституция РФ (часть 4)
Новая конституция РФ (часть 4) Права граждан в области охраны здоровья и жизни
Права граждан в области охраны здоровья и жизни Гражданин России
Гражданин России День Российского флага
День Российского флага День защиты прав потребителей
День защиты прав потребителей Захист інформації в СМДН: поняття, основні ознаки та відмінності
Захист інформації в СМДН: поняття, основні ознаки та відмінності Коррупция
Коррупция Формирование российской государственности
Формирование российской государственности Профессия юрист
Профессия юрист Метод та методологія “Теорія права”. “Теорія права” в системі юридичних наук
Метод та методологія “Теорія права”. “Теорія права” в системі юридичних наук Воинская служба – особый вид государственной службы граждан Республики Казахстан. 11 класс
Воинская служба – особый вид государственной службы граждан Республики Казахстан. 11 класс Административная ответственность за земельные правонарушения
Административная ответственность за земельные правонарушения Общие положения об обязательствах
Общие положения об обязательствах Помощник адвоката уголовно-правовой специализации. Сложности и вызовы
Помощник адвоката уголовно-правовой специализации. Сложности и вызовы