Содержание
- 2. Содержание 1/Локализации ферментов в клетке, органоспецифические и маркерные ферменты 2.Качественное обнаружение и количественное определение активности. Единицы
- 3. Локализация ферментов в клетке Все ферменты и метаболические процессы компартментализованы (разделены и изолированы). В нормальной клетке
- 4. Ядро: локализованы РНК-полимеразы, НАД-синтетаза, ферменты, участвующие в репликации ДНК. Митохондрии: ферменты тканевого дыхания, окислительного фосфорилирования, ферменты
- 5. Мультиферментные системы локализуются в структуре органелл таким образом, что каждый фермент располагается в непосредственной близости от
- 6. Органоспецифические ферменты: Под органоспецифичностью понимают наличие метаболических путей, присущих только данному органу. Так вот органоспецифические ферменты
- 7. так для печени характерна высокая активность АсАТ, АлАТ, сорбитдегидрогеназы, ГДГ. Причем активность АлАТ выше, чем АсАТ,
- 8. Костная ткань - щелочная фосфатаза. Простата - кислая фосфатаза. Glandula parotis et pancreas - амилаза. Миокард
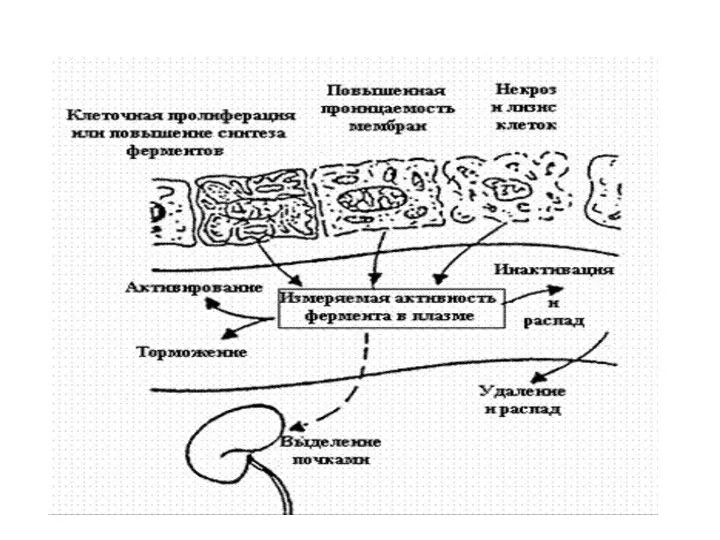
- 9. При нарушении целостности тканей этих органов, ферменты выделяются в сыворотку крови, где их активность резко повышается.
- 11. Но для более конкретной и точной диагностики заболеваний, для определения интенсивности и глубины повреждения тканей нужны
- 12. Активность фермента Активность - это изменение количества субстрата под влиянием фермента в единицу времени. Под изменением
- 13. Понятие "активность фермента" по сути дела идентична понятию "скорость ферментативной" реакции. Ферментативная активность выражается в единицах
- 14. В системе СИ в качестве единицы ферментативной активности используют "катал" (kat). Катал определяется как 1 моль/сек.
- 15. Размерность её слишком велика, на практике пользуются меньшими кратными значениями, начиная с нанокатала (нкат). Это одна
- 16. В практике лабораторий широко пользуются понятием удельная активность. Для этого число cтандартных единиц пересчитывают на какую-либо
- 17. При исследовании кинетики реакций используется и такое понятие как молекулярная активность. Она показывает, сколько молекул субстрата
- 18. Методы исследования активности Эти методы применяют и для определения количества продуктов или субстратов реакции, и для
- 19. В случае, если молярный коэффициент экстинкции ( исследуемого вещества неизвестен, исследователь определяет экспериментально зависимость между поглощением
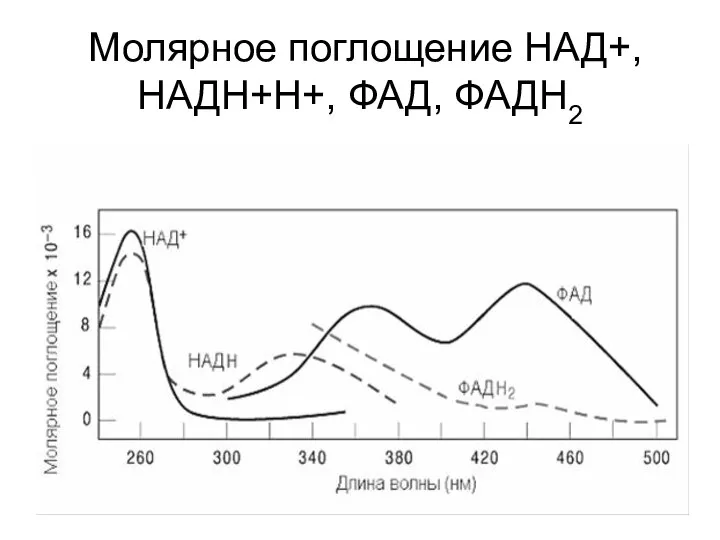
- 20. Молярное поглощение НАД+,НАДН+Н+, ФАД, ФАДН2
- 21. 4 показаны спектральные характеристики коферментов НАД и ФАД в окисленной и восстановленной форме. Измерение поглощения при
- 22. Допустим, за время проведения реакции поглощение при длине волны 340 нм изменялось на 0.31 единицы в
- 23. Классификация ферментов В настоящее время известны и используются 3 вида классификации ферментов: 1. Тривиальная (исторически сложившаяся)
- 24. 1) Оксидоредуктазы: катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Название дается по схеме: донор: «
- 25. 2) Трансферазы: ферменты, катализирующие перенос (внутри- и межмолекулярный) различных групп атомов. Название дается по форме: «донор
- 26. 3) Гидролазы: ферменты, катализирующие расщепление внутримолекулярных связей при участии молекулы воды. Название: «субстрат-гидролаза». К ним относятся
- 27. 4) Лиазы - ферменты, расщепляющие C-C, C-N, C-O связи не гидролитическим путем с образованием двойной связи.
- 28. 6) Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из 2-х исходных молекул с использованием энергии
- 29. Первая цифра указывает на номер одногоиз классов ферментов. Вторая цифра озночает подкласс, который характеризует тип связи,
- 30. В основе классификации ферментов - тип катализируемой реакции
- 31. Оксидоредуктазы - ферменты, которые катализируют реакции восстановления или окисления. Например алкогольдегидрогеназа, фермент, который окисляет этиловый спирт
- 34. Различают аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (е) непосредственно на кислород; анаэробные дегидрогеназы ускоряющие перенос
- 35. Оксидоредуктазы (1.0.0.0.) 1.1.0.0. Действуют на СН-ОН группы доноров 1.1.1.0. НАД+ или НАДФ+ в качестве акцепторов 1.1.1.1.
- 36. Трансферазы: ферменты, катализирующие перенос (внутри- и межмолекулярный) различных групп атомов. Название дается по форме: «донор -
- 37. Трансферазы (2.0.0.0.) 2.1.0.0.Переносят одноуглеродные группы 2.1.1.0. Метилтрансферазы 2.1.1.1. Никотинамид метилтрансфераза 2.1.1.45. Тимидилат синтаза 2.3.0.0. Ацилтрансферазы 2.3.1.6.
- 38. Гидролазы: Гидролазы: ферменты, катализирующие расщепление внутримолекулярных связей при участии молекулы воды. Название: «субстрат-гидролаза». К ним относятся
- 39. Гидролазы (3.0.0.0.) 3.1.0.0.Действуют на эфирные связи 3.1.1.0.Гидролазы эфиров карбоновых кислот 3.1.1.17. Ацетилхолинэстераза 3.2.1.0. Гликозидгидролазы 3.2.1.1. амилаза
- 40. Лиазы (десмолазы) –ферменты, которые катализируют распад C-C, C-O и C-N связями негидролитическим путем с образованием двойных
- 41. Лиазы(4.0.0.0)4.1.0.0.Углерод-углерод лиазы 4.1.1.0.Карбокси лиазы 4.1.1.1. Пируватдекарбоксилаза 4.2.0.0. Углерод-кислород-лиазы 4.2.1.0. Гидролиазы 4.2.1.11. Енолаза 4.2.1.12. Фосфоглюконатдегидраза
- 42. Изомеразы: ферменты, катализирующие различные типы реакций изомеризации. Сюда относятся рацемазы и эпимеразы.
- 43. Изомеразы (5.0.0.0.)5.1.0.0. Рацемазы и эпимеразы 5.1.1.0. Действуют на аминокислоты и их производные 5.1.1.1. Аланинрацемаза 5.3.0.0. Внутримолекулярные
- 44. 6) Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из 2-х исходных молекул с использованием энергии
- 45. Лигазы (6.0.0.0)6.1.0.0. Образуют С-О связи 6.1.1.0.Образуют молекулы аминоацил-тРНК и родственные им соединения. 6.1.1.1. Тирозил-тРНК синтаза 6.5.0.0.
- 47. Скачать презентацию










































 Лекция 6. Цель как объективная системная категория Содержание лекции: Анализ содержания категории «цель» Целесообразность и пов
Лекция 6. Цель как объективная системная категория Содержание лекции: Анализ содержания категории «цель» Целесообразность и пов Анализ и оценка внешних климатических условий и меры регулирования
Анализ и оценка внешних климатических условий и меры регулирования Problem of doping in sport. (Lecture 7)
Problem of doping in sport. (Lecture 7) Презентация Международное право и мировой правопорядок
Презентация Международное право и мировой правопорядок  О чём рассказывают нам гербы и эмблемы
О чём рассказывают нам гербы и эмблемы С. Ф. Русова – видатний педагог, психолог, громадський діяч.
С. Ф. Русова – видатний педагог, психолог, громадський діяч. Лэпбук «Минем туганнарым» как средство обучения татарскому языку
Лэпбук «Минем туганнарым» как средство обучения татарскому языку Презентация на тему "Дружная семья" - скачать презентации по Педагогике
Презентация на тему "Дружная семья" - скачать презентации по Педагогике Материал к урокам алгебры в 8 классе по теме: Квадратные уравнения. Их решение по формуле.
Материал к урокам алгебры в 8 классе по теме: Квадратные уравнения. Их решение по формуле. Презентация Оценка основных средств
Презентация Оценка основных средств ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ МУЖСКИХ ПОЛОВЫХ ОРГАНОВ
ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ МУЖСКИХ ПОЛОВЫХ ОРГАНОВ Портрет как один из способов знакомства с биографией и творчеством автора
Портрет как один из способов знакомства с биографией и творчеством автора Казақстан ремпубликасынын конституциясы
Казақстан ремпубликасынын конституциясы динозавры 2 класс - презентация для начальной школы_
динозавры 2 класс - презентация для начальной школы_ Страхование ответственности нотариусов
Страхование ответственности нотариусов Рельсовая цепь на железной дороге
Рельсовая цепь на железной дороге Грамматика языка
Грамматика языка Невада-Семей қозғалысы
Невада-Семей қозғалысы C / С++. Элементы ЯПВУ. Символы
C / С++. Элементы ЯПВУ. Символы Особенности таможенного контроля и таможенного оформления при международных воздушных перевозках
Особенности таможенного контроля и таможенного оформления при международных воздушных перевозках Ukrainian traditions
Ukrainian traditions Сложение с переносом
Сложение с переносом Коттедж на 6-ти сотках, молодой сад, с видом на море и горы, в цокольном этаже два гаража, бойлерная, подсобное помещение
Коттедж на 6-ти сотках, молодой сад, с видом на море и горы, в цокольном этаже два гаража, бойлерная, подсобное помещение Презентация на тему "Педагогика как наука об образовании" - скачать презентации по Педагогике
Презентация на тему "Педагогика как наука об образовании" - скачать презентации по Педагогике Дота 2
Дота 2 Преступления против свободы, чести и достоинства личности (ст. 126-1281 УК РФ)
Преступления против свободы, чести и достоинства личности (ст. 126-1281 УК РФ) Современный этап ФСБ
Современный этап ФСБ Построение диаграмм и графиков
Построение диаграмм и графиков