Содержание
- 2. Кислотность и основность - важные свойства соединений, определяющие их фундаментальные физико-химические и биологические свойства. Ферментативные реакции
- 3. Кислотно-основные взаимодействия А-Н + :В ↔ А- + В-Н кислота основание сопряженное сопряженная основание кислота По
- 4. [НСОО-]×[Н3О+] К= [НСООН]×[Н2О] Ка = К×[Н2О] [НСОО-]×[Н3О+] К= [НСООН]
- 5. Чем ниже кислотность, тем выше рКа Ка = 1,75×10-5 рКа = -lg Ка = 4,75
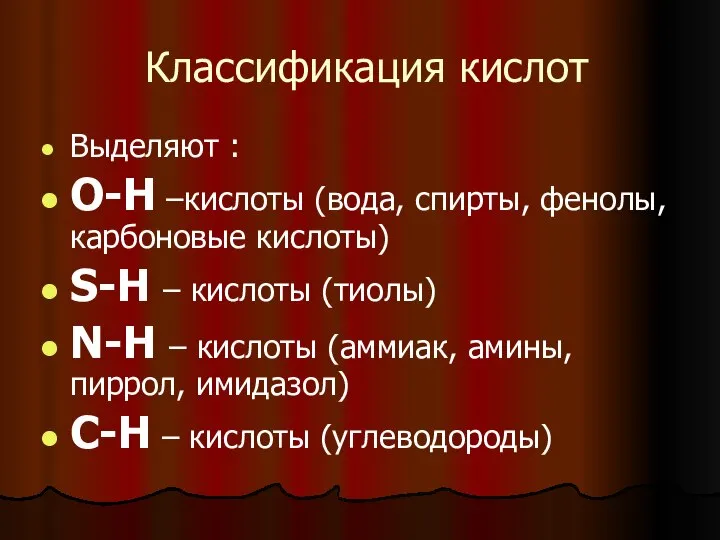
- 6. Классификация кислот Выделяют : О-Н –кислоты (вода, спирты, фенолы, карбоновые кислоты) S-H – кислоты (тиолы) N-H
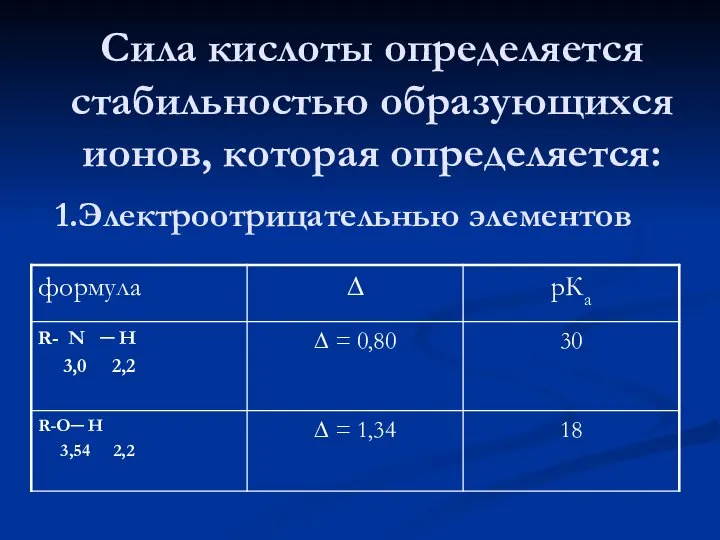
- 7. Сила кислоты определяется стабильностью образующихся ионов, которая определяется: 1.Электроотрицательнью элементов
- 8. ПОЛЯРИЗУЕМОСТЬ 2. Влияние электронных эффектов δ- δ+ рКа=18 рКа=10 рКа=12
- 9. Поляризуемость Для S-H кислот преобладающим фактором является поляризуемость. Атомы серы больше по размеру и имеют вакантные
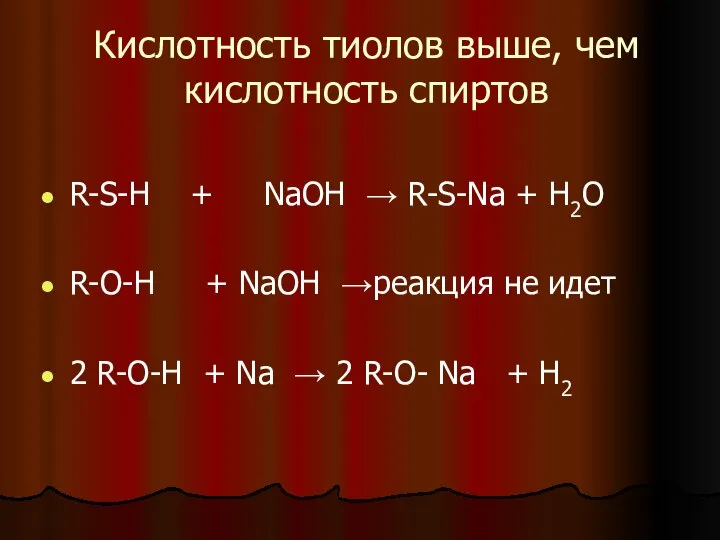
- 10. Кислотность тиолов выше, чем кислотность спиртов R-S-H + NaOH → R-S-Na + H2O R-O-H + NaOH
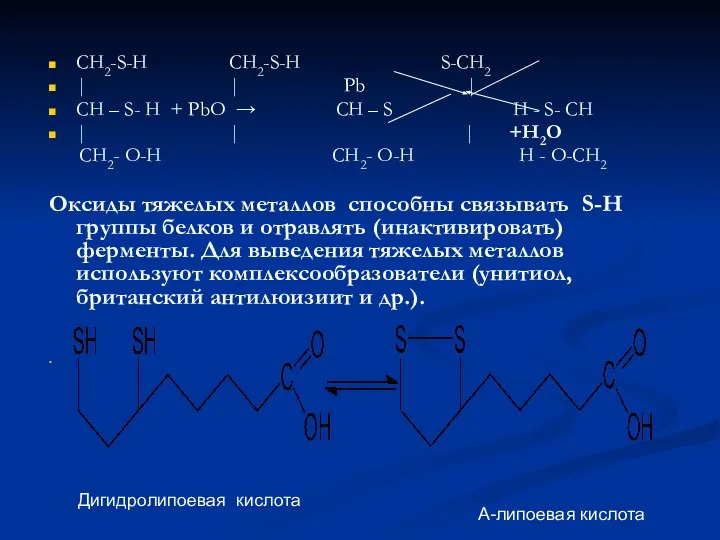
- 11. CH2-S-H CH2-S-H S-CH2 | | Pb | CH – S- H + PbO → CH –
- 12. Делокализации заряда способствует наличие электроноакцепторных заместителей в молекуле (-J-эффект). Электроноакцепторы стабилизируют анион и тем самым увеличивают
- 13. Атомы хлора выполняют роль электроноакцепторов ( - J ) СCl3←СООН > Cl←СH2 ←СООН >СH3→СООН pKa =
- 14. Основность –способность принимать и удерживать протоны Для образования ковалентной связи с протоном Н+ органические основания должны
- 15. Сравнительная оценка основных свойств Величина основности определяется теми же факторами, что и кислотность, но действие этих
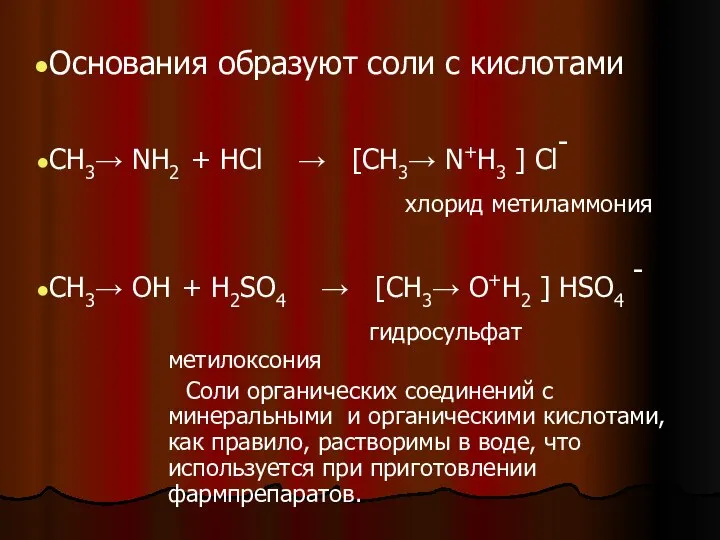
- 16. Основания образуют соли с кислотами CH3→ NH2 + HCl → [CH3→ N+H3 ] Cl- хлорид метиламмония
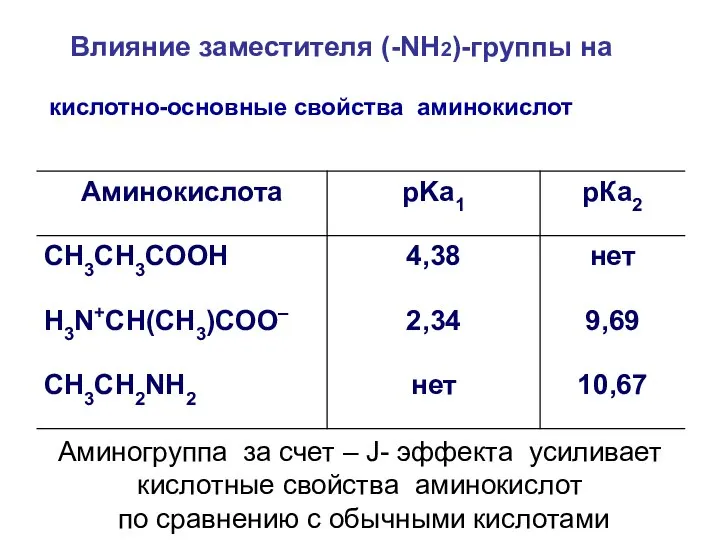
- 17. кислотно-основные свойства аминокислот Влияние заместителя (-NH2)-группы на Аминогруппа за счет – J- эффекта усиливает кислотные свойства
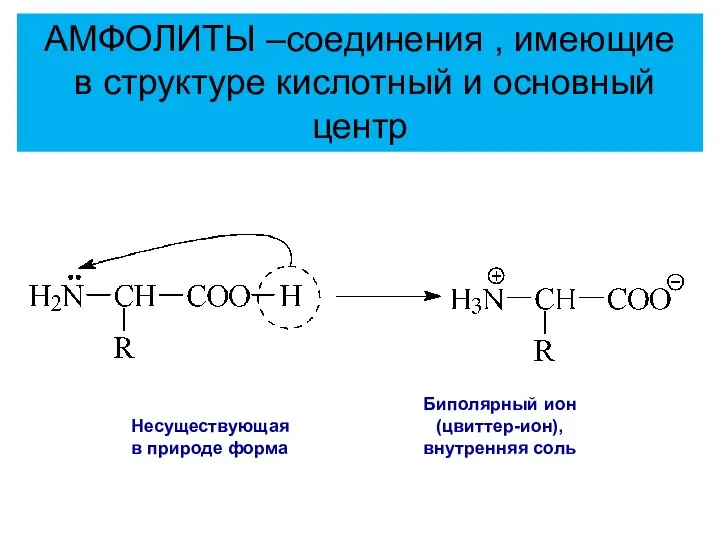
- 18. Несуществующая в природе форма Биполярный ион (цвиттер-ион), внутренняя соль АМФОЛИТЫ –соединения , имеющие в структуре кислотный
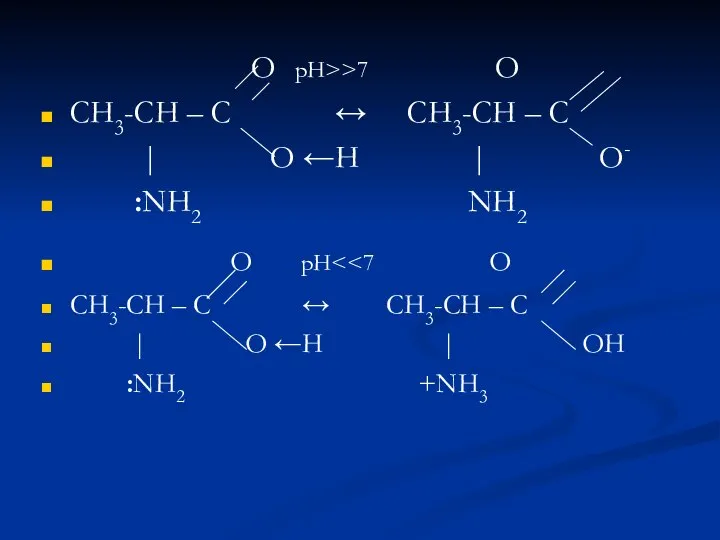
- 19. О рН>>7 O СН3-СН – С ↔ СН3-СН – С | O ←H | O- :NH2
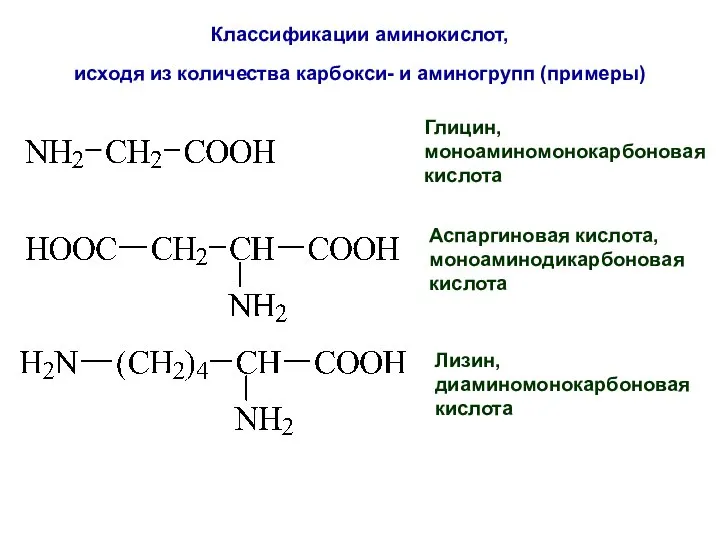
- 20. Классификации аминокислот, исходя из количества карбокси- и аминогрупп (примеры) Глицин, моноаминомонокарбоновая кислота Аспаргиновая кислота, моноаминодикарбоновая кислота
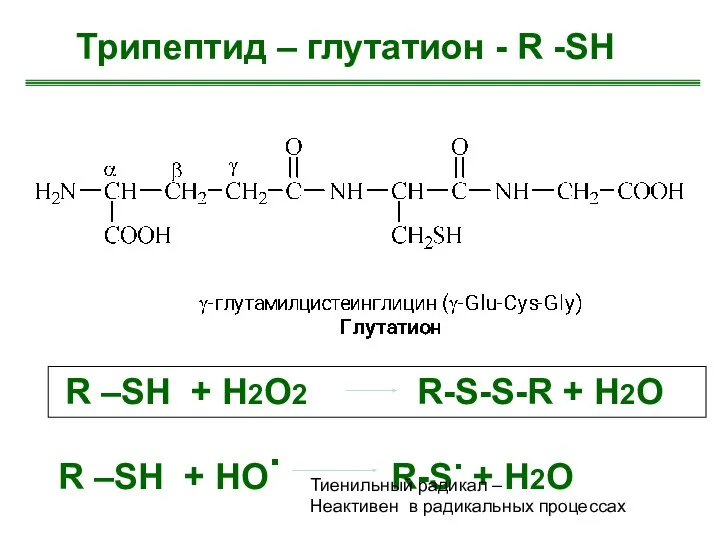
- 21. Трипептид – глутатион - R -SH R –SH + H2О2 R-S-S-R + H2O R –SH +
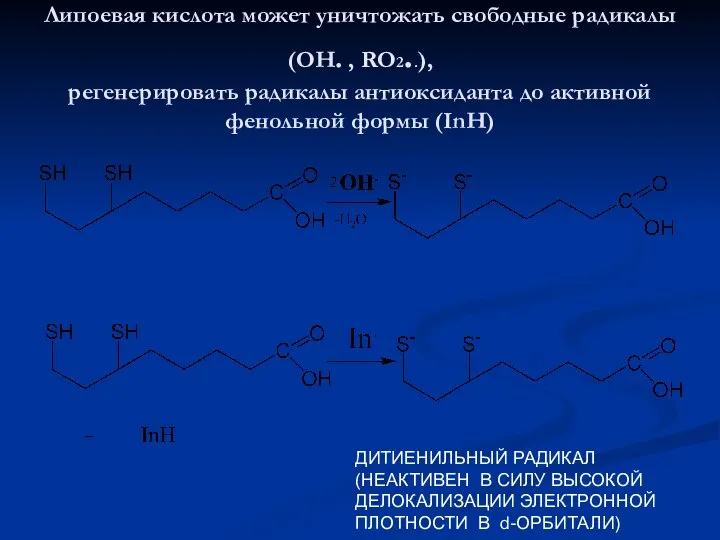
- 22. Липоевая кислота может уничтожать свободные радикалы (ОН. , RO2..), регенерировать радикалы антиоксиданта до активной фенольной формы
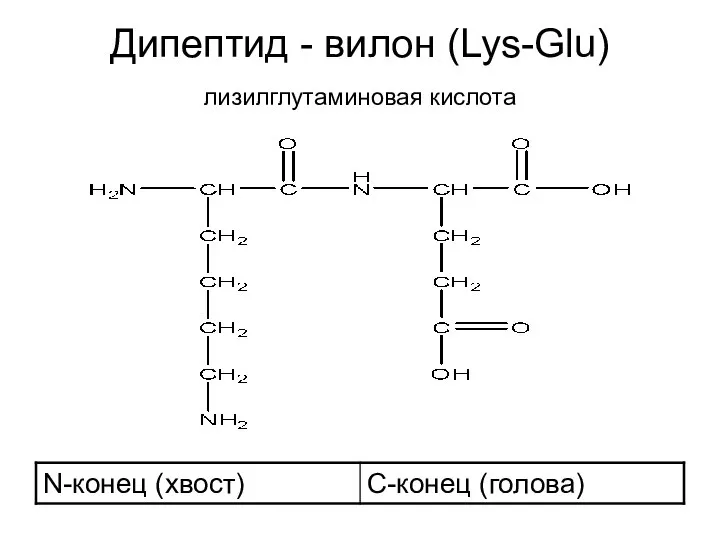
- 23. Дипептид - вилон (Lys-Glu) лизилглутаминовая кислота
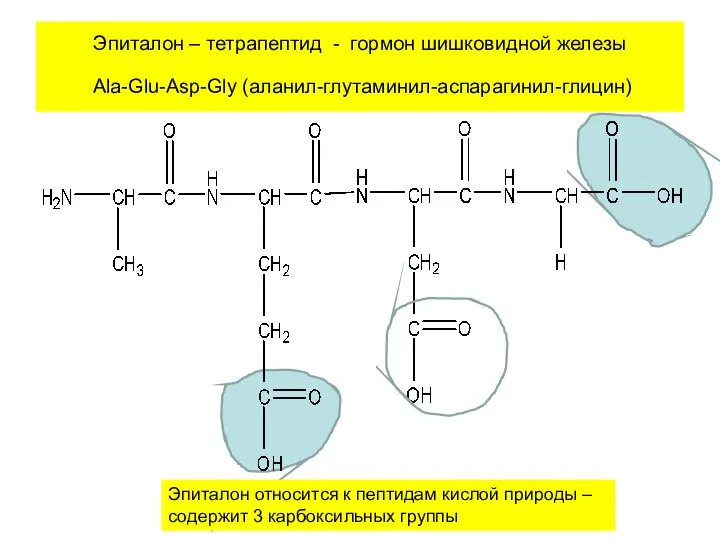
- 24. Эпиталон – тетрапептид - гормон шишковидной железы Ala-Glu-Asp-Gly (аланил-глутаминил-аспарагинил-глицин) Эпиталон относится к пептидам кислой природы –
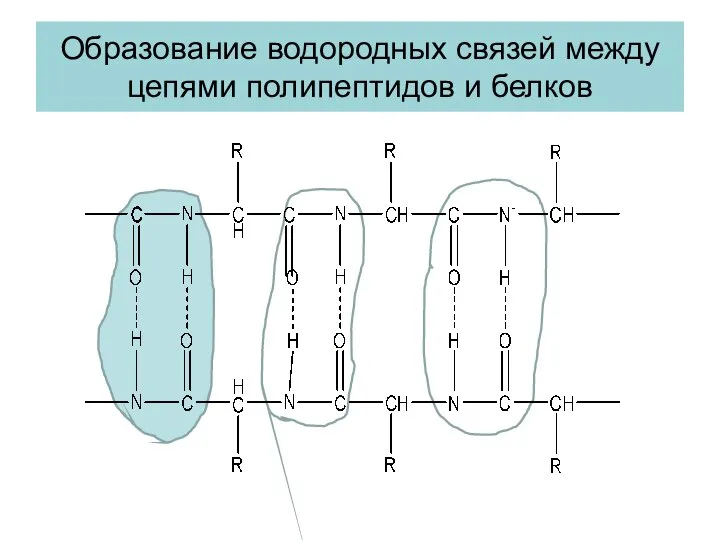
- 25. Образование водородных связей между цепями полипептидов и белков
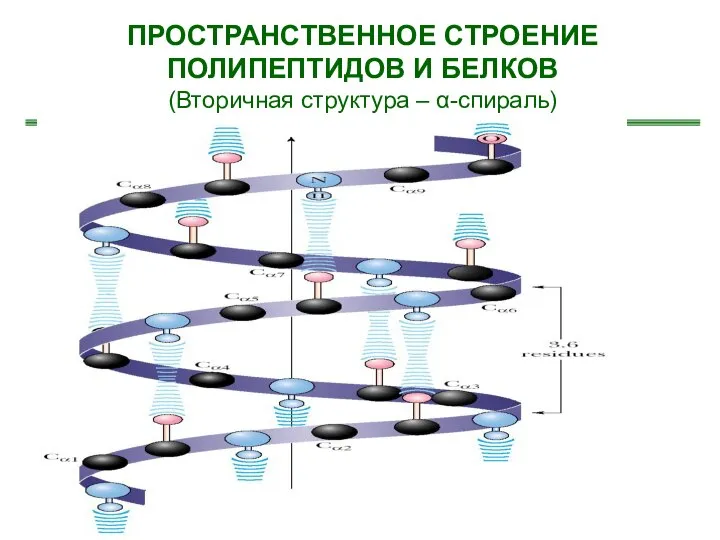
- 26. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Вторичная структура – α-спираль)
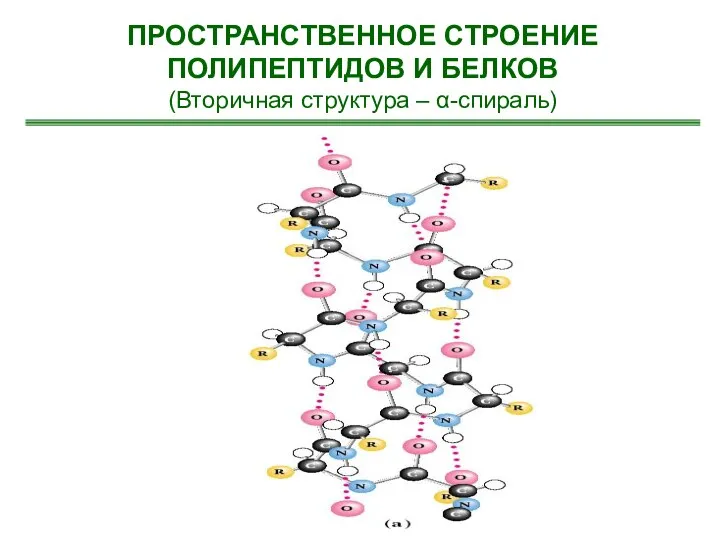
- 27. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Вторичная структура – α-спираль)
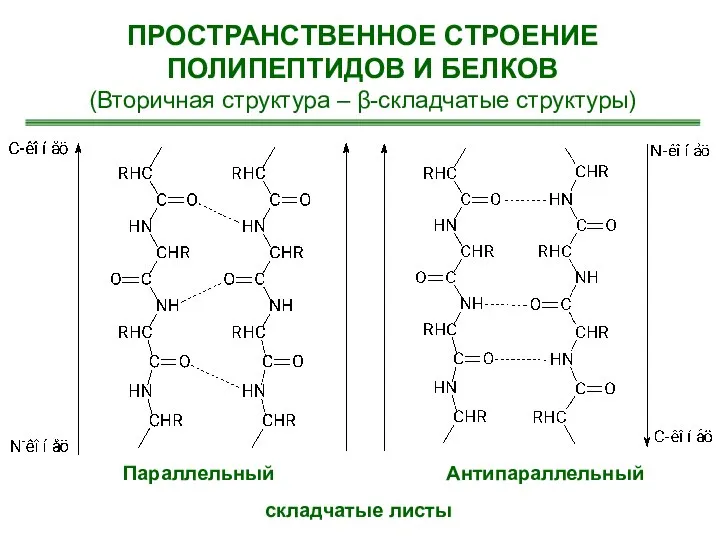
- 28. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Вторичная структура – β-складчатые структуры) Параллельный Антипараллельный складчатые листы
- 30. Скачать презентацию


![[НСОО-]×[Н3О+] К= [НСООН]×[Н2О] Ка = К×[Н2О] [НСОО-]×[Н3О+] К= [НСООН]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1303396/slide-3.jpg)







 Адиб Тахерзаде Доверенные Всемилостивого
Адиб Тахерзаде Доверенные Всемилостивого Коллоидные ПАВ. Мицеллообразование в растворах ПАВ. Липосомы
Коллоидные ПАВ. Мицеллообразование в растворах ПАВ. Липосомы GET и POST запросы в MVC5
GET и POST запросы в MVC5 Заключение эксперта
Заключение эксперта Основы веб-программирования. Лекция 2
Основы веб-программирования. Лекция 2 Handysüchtig
Handysüchtig Алгоритм BlowFish
Алгоритм BlowFish Экономика Израиля Брановицкий Р.С. Прокопчик А. Т.
Экономика Израиля Брановицкий Р.С. Прокопчик А. Т. История управления проектами и основные задачи управления
История управления проектами и основные задачи управления Конституционное право России Конституционные права, свободы и обязанности человека и гражданина в Российской Федерации
Конституционное право России Конституционные права, свободы и обязанности человека и гражданина в Российской Федерации  Семінар №3. Закони розвитку технічних систем
Семінар №3. Закони розвитку технічних систем Введение в программную инженерию
Введение в программную инженерию Презентация Социальная поддержка лиц из группы социального риска: понятие, цели, задачи
Презентация Социальная поддержка лиц из группы социального риска: понятие, цели, задачи  Контрольно-кассовая техника
Контрольно-кассовая техника Выдающиеся скульпторы Древней Греции и Древнего Рима
Выдающиеся скульпторы Древней Греции и Древнего Рима Программа «Специальная олимпиада - присоединяйтесь!»
Программа «Специальная олимпиада - присоединяйтесь!» Культурные нормы
Культурные нормы Правовая охрана изобретений Федина Юля
Правовая охрана изобретений Федина Юля Опрос по психологии Подготовили: студенты 2 курса ФТД группы Т-1207 Жидовленков Александр и Жеребен Евгений
Опрос по психологии Подготовили: студенты 2 курса ФТД группы Т-1207 Жидовленков Александр и Жеребен Евгений Презентация "ОАО «АК Мобилтелеком»" - скачать презентации по Экономике
Презентация "ОАО «АК Мобилтелеком»" - скачать презентации по Экономике Презентация "Средневековое искусство. Время соборов" - скачать презентации по МХК
Презентация "Средневековое искусство. Время соборов" - скачать презентации по МХК патриотическое воспитание
патриотическое воспитание образ сказочного коня - презентация для начальной школы
образ сказочного коня - презентация для начальной школы Внетабличные случаи умножения и деления - презентация для начальной школы
Внетабличные случаи умножения и деления - презентация для начальной школы Родительское собрание в 8 классе на тему: «Развитие самосознания и адекватной самооценки подростка» Педагог-психолог МОУ «Травн
Родительское собрание в 8 классе на тему: «Развитие самосознания и адекватной самооценки подростка» Педагог-психолог МОУ «Травн Соотношение, общие характеристики и принципиальные отличия тарифных и нетарифных мер регулирования внешнеторговой деятельности
Соотношение, общие характеристики и принципиальные отличия тарифных и нетарифных мер регулирования внешнеторговой деятельности  Physical education communication
Physical education communication Mini-project «Winston Churchill»
Mini-project «Winston Churchill»